УЗИ во время операции на предстательной железе (простате)
а) Трансректальное исследование. Развитие технологий УЗИ способствовало улучшению качества изображения, и в настоящее время разрабатывается трехмерная реконструкция предстательной железы при трансректальном исследовании. Трансректальные датчики меньше по размеру и позволяют в режиме реального времени одновременно визуализировать предстательную железу в сагиттальной и поперечной плоскости.
Кроме того, предстательную железу можно исследовать через трансабдоминальный и трансректальный доступы. Первый не дает возможности полностью оценить предстательную железу, но позволяет определить внутрипузырный рост.
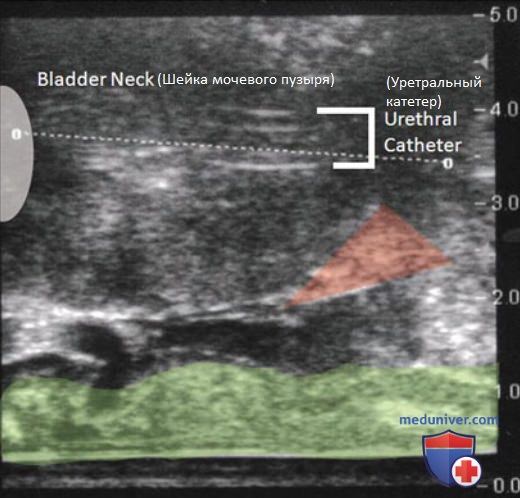
Недавно на трупном материале показана корреляция ультразвуковых данных и сравнительной анатомии наружного сфинктера уретры. Рабдосфинктер на УЗИ выглядит как гиперэхогенный треугольник в верхушке предстательной железы (рис. 1), а в кадаверной модели определяется значительное количество мышечных волокон, заходящих на верхушку предстательной железы.
Ультразвуковой датчик. Для исследования предстательной железы и окружающих структур необходимо использовать биплановый и концевой трансректальный датчик с диапазоном частот от 6,0 до 9,0 МГц. Конвексный датчик позволяет оценить размер предстательной железы и ее морфологию через трансабдоминальный доступ.
Трансректальный датчик дает возможность установить насадку для биопсии предстательной железы. Насадка может быть одноразовой или многократного использования.
Техника. Для оптимальной визуализации во время ТРУЗИ пациенту необходимо сделать очистительную клизму вечером предыдущего дня и утром перед исследованием. Наличие калового содержимого и газа ухудшает видимость. Трансректальный датчик необходимо вводить медленно, вращательными движениями, с использованием лубриканта, до момента, пока не будет визуализирована предстательная железа.
При использовании руки можно проверить правильную модель для работы с различными датчиками. Техника исследования отличается в зависимости от положения пациента (на левом боку или дорзального литотомического). Хирург должен выводить и стандартизировать изображения в поперечной и сагиттальной плоскости.
б) Промежностная биопсия предстательной железы. Промежностная биопсия предстательной железы в Европе имеет большую популярность, чем в США. Хотя она была описана еще в 1963 г., Игаль и соавт. впервые выполнили шаблонную систематическую биопсию под ультразвуковым контролем только в 2001 г. В настоящее время биопсию проводят под ТРУЗИ-контролем с использованием стандартной сектантной схемы или картированием всей железы.
Кроме того, Барзелл и соавт. описали технику расширенной биопсии под ТРУЗИ-контролем у пациентов с гистологически подтвержденным раком предстательной железы небольшого объема низкой степени злокачественности, которых отбирают на экспериментальную фокальную терапию. Перед биопсией необходимо определить объем предстательной железы на ТРУЗИ, поскольку она не должна быть слишком большой (<65 см3) или располагаться за дугой лонной кости.
Если предстательная железа слишком большая или промежностный доступ затруднен, вначале пациенту можно назначить ингибиторы 5-альфа-редуктазы с повторной оценкой каждые 3 мес до тех пор, пока предстательная железа не будет полностью визуализирована. Биопсию обычно проводят в операционной под регионарной анестезией в высоком литотомическом положении пациента с использованием стандартной решетки для брахитерапии с 5-миллиметровым шагом и стандартного пистолета для биопсии с иглой 18 G.
Шаг 5 мм считается оптимальным для того, чтобы пропустить минимальное число образований. Стандартный трансректальный датчик позволяет получать срезовые изображения, и их можно использовать для трехмерной реконструкции предстательной железы при обозначении ее границ. Во время биопсии уролог должен определять положение уретры, чтобы не перфорировать ее. Необходимо проявлять внимательность для покрытия всего объема предстательной железы с глубоким (основание) и поверхностным (верхушка) вколом иглы в одном положении в решетке, поскольку длина железы может быть больше, чем ход стандартной биопсийной иглы 18 G.
Каждый биоптат подписывается по системе координат х—у—z и направляется на морфологическое исследование в отдельном контейнере. Специализированное программное обеспечение позволяет комбинировать результаты морфологического исследования (фокусов рака) с трехмерной моделью предстательной железы, созданной по трансректальным изображениям.
в) Криотерапия. Впервые криотерапию предложили и применили для лечения рака в XIX в. При нанесении комбинации соли и льда на поверхность рака шейки матки и молочной железы уменьшались болевой синдром и размер опухоли. Впоследствии превращение воздуха (кислород и азот) в жидкие формы и возможность хранить их в достаточном количестве для постоянного использования привели ко второму рождению криотерапии в начале XX в.
Первый криозонд был создан в 1961 г. Купер и Ли, в нем циркулировал жидкий азот, позволяя замораживать ткани, с которыми контактирует зонд. На предстательной железе этот зонд впервые применили в 1964 г.. Развитие ультразвукового контроля сделало криотерапию более привлекательным методом абляции для лечения рака предстательной железы.
В 1996 г. Американская ассоциация урологов признала криотерапию методом лечения локализованного рака предстательной железы. Современные аппараты относятся к третьему поколению, и в них используются уретральные нагреватели, комбинация аргона (замораживание) и гелия (оттаивание) (эффект Джоуля—Томсона) и ТРУЗИ.
Техника. В модифицированном дорзальном литотомическом положении на промежность устанавливают решетки для брахитерапии. Для визуализации предстательной железы, уретры, шейки мочевого пузыря и прямой кишки используют многочастотный биплановый трансректальный датчик. В зону фасции Денонвилье, наружного сфинктера уретры и сосудисто-нервных пучков устанавливают температурные зонды для контроля над уровнем замораживания и избегания термального повреждения этих чувствительных структур.
По современным рекомендациям, их температура должна оставаться выше 15°C. Криозонды вводят под ТРУЗИ-контролем через решетку либо по всей предстательной железе, либо, при фокальной терапии, в зону интереса, определенную на промежностной биопсии (рис. 2). Наконец, под цистоскопическим контролем устанавливают уретральный нагреватель. При тотальной криоабляции в зону замораживания необходимо включать 2—4 мм перипростатических тканей. Во время цистоскопии уретра осматривается на предмет возможной перфорации иглами или термодатчика ми, для того чтобы можно было скорректировать их положение до начала замораживания.
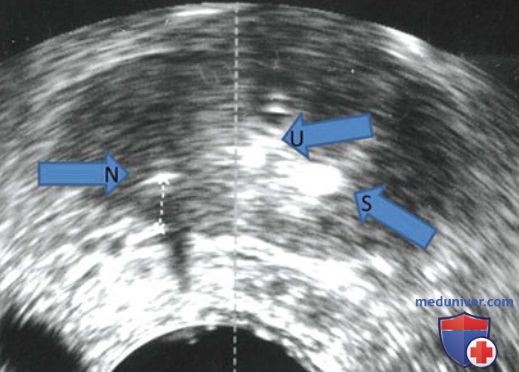
Замораживание проводят в передне-заднем направлении, чтобы сохранить видимость на ТРУЗИ до —40 °C в течение двух циклов замораживания-оттаивания. Визуальный ультразвуковой контроль имеет свои ограничения, которые необходимо учитывать.
УЗИ не позволяет сохранять информацию по температуре ткани во время операции, а видимые изменения могут не соответствовать определенным температурным диапазонам. В связи с этим перед криозондами устанавливают температурные датчики. Хирург должен определить локализацию наружного сфинктера уретры для правильной установки датчика с целью профилактики недержания мочи. Мы описали ультразвуковую картину и провели корреляцию с исследованиями наружного сфинктера на трупах.
Гиперэхогенный треугольник дистальнее верхушки предстательной железы представляет собой рабдосфинктер, который имеет важный сегмент в верхушке предстательной железы. Для визуализации сфинктера можно надавить указательным пальцем на основание мошонки под ветвью лонной кости. Для оценки распространения ледяного шара и профилактики повреждения прямой кишки и сфинктера необходимо постоянно переключать изображение из сагиттальной в поперечную плоскость. Типичная зона замораживания описывается как хорошо ограниченный гиперэхогенный ободок с акустической тенью посередине (рис. 3).
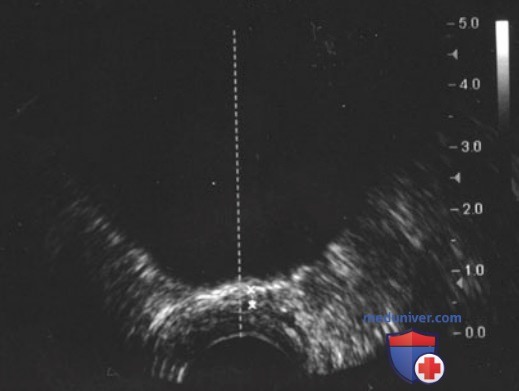
Этот ободок закрывает заднюю границу замороженной ткани, скрывая тем самым истинную зону замораживания. Для контроля над кровотоком в зоне прямой кишки можно использовать режим цветовой допплерографии, но он не считается объективным методом. После полного оттаивания ледяного шара предстательная железа выглядит так же, как и перед началом вмешательства.
г) Брахитерапия. Брахитерапия, или установка радиоактивных зерен в предстательную железу, впервые описана Александр Грейам Белл в 1908 г.. Появление ТРУЗИ позволило равномерно имплантировать зерна через промежностную решетку для перманентной низкодозной (йод-125, палладий-103) или временной высокодозной брахитерапии (иридий-192).
Ультразвуковой контроль также помогает устанавливать зерна в отдалении от уретры, нервов или прямой кишки, ограничивая осложнения, такие как симптомы нарушения мочеиспускания, ЭД и проктит. На УЗИ во время имплантации обычно определяются гиперэхогенные иглы с акустической тенью. Зерна также выглядят как небольшие гиперэхогенные точки. Уверенность в адекватной дозиметрии при установке зерен имеет важнейшее значение и считается операторзависимой.
При этом компьютерное планирование в сочетании с ТРУЗИ способствует точной и прогнозируемой имплантации, которая становится воспроизводимой (рис. 4). Интраоперационное предпланирование заменило амбулаторное обращение для планирования имплантации.
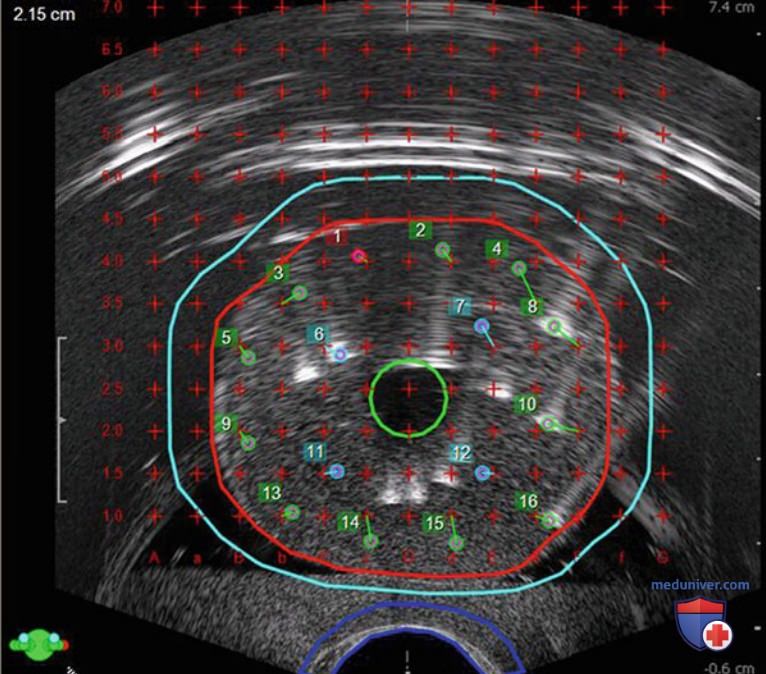
Поскольку точное число требуемых зерен до начала операции неизвестно, его примерно рассчитывают по номограммам, включающим объем железы по данным ТРУЗИ (во время биопсии предстательной железы) или КТ. В модифицированном литотомическом положении проводится биплановое ТРУЗИ с подключением системы планирования, после чего выполняется промежностная имплантация зерен в соответствии со схемой. Биплановое ТРУЗИ, установленное на руке, используют для контроля положения игл с подтверждением на флюороскопии, поскольку ТРУЗИ обычно не позволяет увидеть 2—45% зерен во время или после имплантации. В настоящее время изучаются новые технологии совмещения ТРУЗИ и флюороскопии во время брахитерапии для верификации установки зерен и точного расчета дозиметрии.
д) Терапия высокоинтенсивным сфокусированным ультразвуком. H1FU впервые описан 15 лет назад для лечения ДГПЖ, а в 1996 г. Джелет и соавт. использовали новую технологию для лечения пациентов с локализованным раком предстательной железы низкой степени злокачественности. HIFU представляет собой один из методов, которые можно использовать для фокальной абляции опухолевых очагов, с применением ультразвуковой энергии для механического и термального повреждения ткани предстательной железы. Когда HIFU проводят для лечения локализованного рака предстательной железы, в прямую кишку устанавливают многочастотный датчик для подведения акустической энергии, которая направлена на ткань-мишень, и создания высокой температуры и необратимого коагуляционного некроза.
HIFU основан на принципе trackless, подразумевающем отсутствие повреждения тканей вне фокальной плоскости. Трансректальный датчик лежит на слизистой оболочке прямой кишки и излучает акустическую энергию, которая вызывает нагрев таргетного объема ткани. Для захвата всей ткани предстательной железы положение датчика меняют вручную. HIFU выполняют под спинальной или общей анестезией и объеме железы не более 40 см3.
Следует отметить, что протоколы исследований в США не допускают проведения трансуретральной резекции перед HIFU. Визуализацию предстательной железы проводят в режиме реального времени на диагностических изображениях, создаваемых датчиком при использовании низкой акустической энергии (0,1—100 мВт/см2). После определения мишени происходит абляция ткани высокоэнергетическими импульсами (1300—2200 Вт/см2), направленными на небольшие участки ткани шириной 1—3 мм и длиной 5—26 мм. Каждый импульс нагревает ткани до 80—98 °C в течение 3 с. Между импульсами происходит визуализация предстательной железы с использованием более низкой энергии.
Затем датчик полуавтоматически сдвигается и вращается (зависит от аппарата) под контролем низкоэнергетических изображений для захвата прилежащей ткани предстательной железы. Конечная цель — создание перекрывающихся зон абляции во всей железе. Механизм деструкции ткани при HIFU основан на термальном и механическом эффекте неионизирующего акустического излучения (звуковых волн), направленного на ткани после фокусирования акустической линзой, чашеобразным датчиком или электронной фазированной решеткой. На низкоэнергетических изображениях зона абляции становится гиперэхогенной. Поскольку HIFU основан на неионизирующем излучении, его можно повторять один и более раз в течение нескольких сеансов.
Термальные эффекты, достигаемые при нагревании ткани до 60 °C и выше, приводят к практически необратимому коагуляционному некрозу и клеточной смерти. За счет фокусирования энергии в фокальной зоне достигается более выраженная деструкция, но вне ее ткани не повреждаются, поскольку интенсивность энергии намного ниже.
е) Лапароскопическая радикальная простатэктомия. Недавно Укимура, Джилл и соавт. описали использование ТРУЗИ в режиме реального времени во время лапароскопической простатэктомии для визуализации ключевых структур, таких как сосудисто-нервные пучки, шейка мочевого пузыря, верхушка предстательной железы, с целью облегчения диссекции тканей.
В их исследовании по интраоперационному использованию ТРУЗИ у 25 последовательных пациентов показано, что высокочастотное двумерное УЗИ, режим энергетического допплера и трехмерное изображение способствуют выявлению основных структур. В частности, авторы отметили, что интраоперационное использование УЗИ помогает в достижении трех основных целей лапароскопической простатэктомии. Во-первых, оно позволяет определить правильную плоскость между задней поверхностью шейки мочевого пузыря и основанием предстательной железы, обеспечивая лапароскопическую визуализацию семенных пузырьков и семявыносящих протоков.
Во-вторых, авторы смогли увидеть дистальную протрузию верхушки предстательной железы кзади от мембранозной уретры в сложных случаях для расширения апикальной диссекции и достижения отрицательного края. В-третьих, УЗИ позволяет обнаружить гипоэхогенные очаги, прилежащие к капсуле предстательной железы, помогая хирургу выполнить в этих зонах более широкую диссекцию.
Видео УЗИ простаты в норме и при патологии
- Рекомендуем ознакомиться далее "УЗИ во время операции на яичке"
Редактор: Искандер Милевски. Дата публикации: 31.8.2023

