Механизмы гематогенного метастазирования опухоли по сосудам
Во время циркуляции в кровотоке опухолевые клетки уязвимы, поскольку могут быть разрушены с помощью разнообразных механизмов, включающих механическое разрушение, апоптоз вследствие утраты адгезии с другими клетками (этот процесс называют аноикис), а также факторами врожденного и приобретенного иммунитета.
В кровотоке некоторые клетки опухоли формируют эмболы, соединяясь и адгезируя циркулирующие лейкоциты, особенно тромбоциты. Агрегированные таким образом клетки опухоли получают некоторую защиту от противоопухолевых эффекторных клеток организма-хозяина. Опухолевые клетки могут присоединять и активировать факторы коагуляции крови, что приводит к образованию тромбоэмболов.
Задержка и экстравазация опухолевых эмболов в отдаленных органах происходят за счет адгезии к эндотелию с последующим выходом через базальную мембрану. В этот процесс вовлечены молекулы адгезии (интегрины, рецепторы ламинина) и протеолитиче-ские ферменты.
Особого внимания заслуживают молекулы адгезии CD44, экспрессируемые Т-лимфоцитами для миграции в определенные зоны лимфоидной ткани. Такая миграция сопровождается связыванием CD44 с гиалуронаном на венулах с высоким эндотелием. Усиленная экспрессия CD44 может способствовать метастазированию опухолевых клеток.
В новом месте опухолевые клетки должны пролиферировать, обеспечить себе кровоснабжение и устоять против антибластомной защиты организма-хозяина.
Место, где опухолевые клетки будут покидать капилляры и сформируют вторичные узлы, отчасти зависит от локализации первичного узла, т.к. большинство метастазов возникает на месте встречи циркулирующих опухолевых клеток с первым капиллярным барьером. Однако не всегда возможно объяснить распределение метастазов механизмом естественного дренажа.
Например, карцинома предстательной железы часто дает метастазы в кости, карцинома легкого — в надпочечники и головной мозг, а нейробластома — в печень и кости. Такой органный тропизм может быть связан со следующими факторами:
- поскольку первым этапом экстравазации является адгезия к эндотелию, опухолевые клетки могут экспрессировать молекулы адгезии, лиганды для которых экспрессирует преимущественно эндотелий органов-мишеней. Установлено, что сосудистый эндотелий разных органов экспрессирует различное количество лигандов для молекул адгезии;
- хемокины выполняют важнейшую функцию в определении органа-мишени для метастазирования. Например, клетки рака молочной железы человека экспрессируют высокие уровни хемокиновых рецепторов CXCR4 и CCR7. Хемокины, которые связываются с этими рецепторами, содержатся в больших количествах только в тех органах, куда и метастазирует рак молочной железы.
Блокирование взаимодействия между CXCR4 и хемокином ограничивает метастазирование в лимфоузлы и легкие. Некоторые органы-мишени могут высвобождать хемоаттрактанты и тем самым привлекать опухолевые клетки. В качестве таких факторов выступают IGF-1 и -2;
- некоторые ткани представляют собой неподходящую среду для роста и распространения опухолевых клеток. Например, хотя скелетные мышцы хорошо васкуляризованы, в них редко развиваются метастазы опухолей.
Несмотря на «изобретательность» опухолевых клеток после их отделения от первичной опухоли, они оказываются малоприспособленными для колонизации отдаленных органов. Миллионы опухолевых клеток ежедневно покидают первичный узел опухоли даже при ее малых размерах. Такие клетки выявляются в кровотоке и в виде небольших островков в костном мозге даже у тех пациентов, которые не имеют в дальнейшем макроскопически видимых метастазов.
Длительное состояние покоя метастатических клеток, т.е. длительное существование микрометастазов без их прогрессирования (латентные, или дремлющие, метастазы), описано при меланоме, раке молочной и предстательной желез.
Молекулярные механизмы процесса колонизации еще только начинают распутывать с помощью экспериментов на животных моделях (на мышах), но вполне очевиден факт взаимодействия опухолевых клеток и предсуществующих стромальных клеток в местах формирования метастазов: опухолевые клетки продуцируют цитокины, факторы роста и компоненты внеклеточного матрикса (ВКМ), воздействующие на стромальные клетки, а те, в свою очередь, создают нишу для их обитания.
Например, метастазы рака молочной железы сопровождаются остеолизом вследствие активации остеокластов в местах метастазирования. Опухолевые клетки молочной железы секретируют паратиреоидный гормонсвязыва-ющий белок (PTHRP), стимулирующий остеобласты к синтезу лиганда рецептора-активатора ядерного фактора (RANK). Этот лиганд активирует остеокласты, деградирующие матрикс кости и вызывающие высвобождение таких факторов, как IGF и TGF-b. Более глубокое понимание молекулярных основ метастазирования расширит наши возможности по созданию таргетных методов лечения.
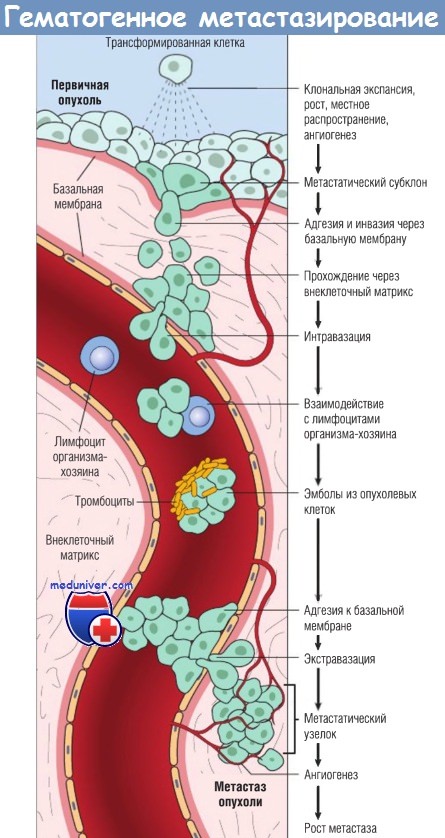
Схема последовательных стадий гематогенного распространения злокачественной опухоли.
- Вернуться в оглавление раздела "Патофизиология"
Оглавление темы "Патофизиология опухоли":- Ген PTEN и его значение в развитии опухоли
- Гены NF1, NF2 и их значение в развитии опухоли
- Ген VHL и его значение в развитии опухоли
- Ген WT1 и его значение в развитии опухоли
- Ген PTCH и его значение в развитии опухоли
- Механизмы уклонения клеток опухоли от апоптоза
- Механизмы безграничного потенциала деления клеток
- Механизмы ангиогенеза опухоли
- Механизмы инвазии опухоли
- Механизмы гематогенного метастазирования опухоли по сосудам

