Механизмы уклонения клеток опухоли от апоптоза
Накопление опухолевых клеток может быть не только результатом усиленной пролиферации за счет активации стимулирующих рост онкогенов или инактивации подавляющих рост генов-супрессоров злокачественных опухолей, но также возникать вследствие мутаций генов, которые регулируют апоптоз. Апоптоз представляет собой барьер, который должны преодолеть клетки в ходе канцерогенеза. Во взрослом организме апоптоз является физиологическим ответом на ряд патологических ситуаций, которые могут привести к развитию злокачественных опухолей.
Клетка с поврежденным геномом может самоуничтожиться, предотвратив тем самым накопление мутаций в потомстве. Апоптоз могут запускать множество разнообразных сигналов, начиная от повреждения ДНК и заканчивая утратой адгезивных свойств базальной мембраной. Идентифицировано большое семейство генов, регулирующих апоптоз. Чтобы разобраться, как опухолевые клетки уклоняются от апоптоза, очень важно рассмотреть биохимические регуляторные пути, индуцирующие апоптоз.
Есть две отличающиеся между собой программы, которые активируют апоптоз по внешнему и внутреннему сигнальным путям. На рисунке в упрощенной форме показана последовательность событий, приводящая к апоптозу через рецептор смерти Fas (CD95) (внешний сигнальный путь) и после повреждения ДНК (внутренний сигнальный путь). Внешний сигнальный путь запускается при связывании Fas (CD95) с его лигандом, FasL (CD95L), что приводит к тримеризации рецептора, включая его цитоплазматические домены смерти, которые связывают внутриклеточный белок-адаптер FADD.
Этот белок, воздействуя на прокаспазу-8, формирует комплекс сигнальных молекул, вызывающих смерть клетки. Прокаспаза-8 активируется путем расщепления на меньшие субъединицы, генерирующие каспазу-8. Затем каспаза-8 активирует каскад других каспаз, в т.ч. каспазы-3 — каспазы, разрушающей ДНК и другие основания, чтобы вызвать смерть клетки.
Кроме того, каспаза-3 может расщеплять и активировать белок BID из группы BH3-only, запускающий внутренний сигнальный путь апоптоза. Этот сигнальный путь могут запустить множество стимулов, в т.ч. потеря факторов выживания, стресс и повреждение. Активация этого пути приводит к повышению проницаемости наружной мембраны митохондрий с выходом молекул, таких как цитохром С, инициирующих апоптоз. Целостность наружной мембраны митохондрий регулируется про- и антиапоптозными членами семейства онкобелков Bcl-2.
Проапоптозные белки ВАХ и ВАК нужны для апоптоза и непосредственно вызывают увеличение проницаемости мембран митохондрий. Действие этих белков ингибируют антиапоптозные члены семейства Bcl-2 и Bcl-x1.
Третий набор белков — белки BH3-only, включающий BAD, BID и PUMA, — регулирует баланс между проапоптозными и антиапоптозными членами семейства Bcl-2. Белки BH3-only стимулируют апоптоз путем нейтрализации действия антиапоптозных белков Bcl-2 и Bcl-x1. Когда общее количество всех белков ВНЗ-only превышает количество антиапоптозных белков Bcl-2 и Bcl-xl, происходит активация ВАХ и ВАК с формированием пор в митохондриальной мембране.
Цитохром С выходит в цитозоль, где связывается с фактором активации протеаз апоптоза 1 (APAF1), активируя каспазу-9. Как каспаза-8 из внешнего сигнального комплекса, так и каспаза-9 могут расщеплять и приводить в активное состояние каспазу-3. Каспазы могут быть подавлены с помощью семейства ингибирующих апоптоз белков. Некоторым опухолям удается уклониться от апоптоза при нарушении регуляции этих белков, что может быть использовано при разработке новых лекарственных средств, способных блокировать взаимодействие каспаз и ингибирующих апоптоз белков. Опираясь на проапоптозные свойства белков BH3-only, предпринимаются попытки создания лекарственных форм с действием, аналогичным BH3.
На рисунке ниже проиллюстрированы участки, на которых механизмы апоптоза разрушены опухолевыми клетками. Снижение апоптоза в опухолевых клетках может быть результатом уменьшения количества Fas (CD95) на их поверхности, что делает их менее восприимчивыми к FasL (CD95L). В небольшом количестве опухолей обнаруживают высокие уровни белка FLIP, который может связать комплекс сигнальных молекул, вызывающих смерть клетки, и предотвратить активацию каспазы-8.
Из всех известных генов лучше всего изучена роль Bcl-2 в уклонении опухолевых клеток от апоптоза. Около 85% В-клеточных лимфом фолликулярного типа имеют характерную транслокацию t(14;18)(q32;q21). Следует напомнить, что участок 14q32, где локализуются гены тяжелых цепей Ig, также вовлечен в патогенез лимфомы Беркитта. Транслокация Bcl-2 (расположенного на 18q21) на участок 14q32 вызывает сверхэкспрессию белка Bcl-2.
Это, в свою очередь, приводит к активации Bcl-2 и Bcl-x1, что позволяет опухолевым В-клеткам выжить в течение длительного срока и приводит к накоплению их в лимфоузлах и развитию лимфаденопатии, а также формированию инфильтратов в костном мозге. Поскольку рост лимфом со сверхэкспрессией Bcl-2 идет в значительной степени не за счет усиленной пролиферации опухолевых клеток, а за счет снижения количества погибающих клеток, то такие лимфомы имеют тенденцию к медленному росту по сравнению с другими лимфомами.
p53 — важный проапоптозный ген, который вызывает апоптоз клеток, не способных восстанавливать поврежденную ДНК. Действия p53 опосредуются частично транскрипционной активацией ВАХ, хотя есть и другие связи между p53 и апоптозом. Следовательно, в опухоли апоптоз может быть нарушен как за счет мутаций в проапоптозных сигнальных путях, так и в результате потери молекул-контролеров целостности генома, таких как p53.
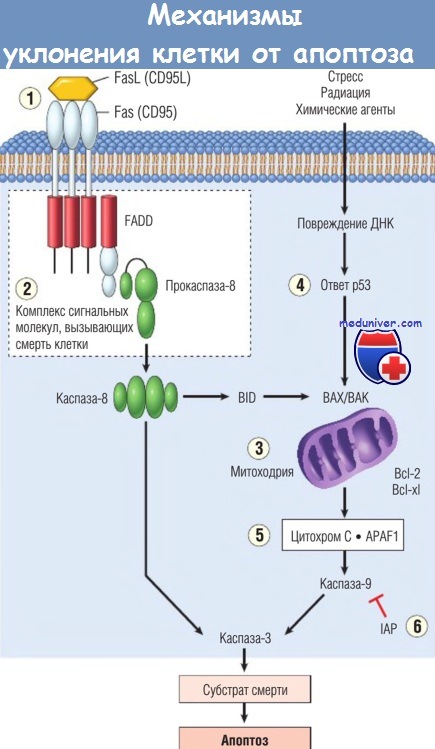
(1) Уменьшенное количество CD95.
(2) Инактивация комплекса сигнальных молекул, вызывающих смерть клетки, белком FLICE (каспазой-8; апоптоз-связанной с цистеином пептидазой).
(3) Уменьшенный выход цитохрома С из митохондрий в результате нарушенного регулирования Bcl-2.
(4) Уменьшение экспрессии проапоптозного онкопротеина ВАХ в результате утраты р53.
(5) Потеря фактора активации протеаз апоптоза 1 (APAF1).
(6) Повышение экспрессии ингибиторов апоптоза. IAP — ингибирующие апоптоз белки; FADD — Fas-ассоциированный домен смерти; FasL — Fas-лиганд; ДНК — дезоксирибонуклеиновая кислота.
- Рекомендуем ознакомиться со следующей статьей "Механизмы безграничного потенциала деления клеток"
Оглавление темы "Патофизиология опухоли":- Ген PTEN и его значение в развитии опухоли
- Гены NF1, NF2 и их значение в развитии опухоли
- Ген VHL и его значение в развитии опухоли
- Ген WT1 и его значение в развитии опухоли
- Ген PTCH и его значение в развитии опухоли
- Механизмы уклонения клеток опухоли от апоптоза
- Механизмы безграничного потенциала деления клеток
- Механизмы ангиогенеза опухоли
- Механизмы инвазии опухоли
- Механизмы гематогенного метастазирования опухоли по сосудам

