Механизмы ангиогенеза опухоли
Без васкуляризации солидная опухоль не может увеличиться более 1-2 мм в диаметре, несмотря на все генетические аномалии. Как и нормальным тканям, опухолям нужны кислород и питательные вещества, а также удаление продуктов обмена. По-видимому,
1-2-миллиметровая зона представляет собой максимальное расстояние, через которое кислород и питательные вещества могут попасть в опухоль, а метаболиты — покинуть ее.
Клетки злокачественной опухоли могут стимулировать неоангиогенез, характеризующийся почкованием новых сосудов от уже существующих капилляров, а в некоторых случаях — васкулогенез, при котором эндотелиальные клетки, формирующие новые сосуды, происходят из костного мозга.
Сосудистое русло в опухоли отличается от нормального. Сосуды злокачественной опухоли обладают повышенной проницаемостью, расширены и имеют неупорядоченные связи.
Неоваскуляризация оказывает двойной эффект на рост опухоли: с одной стороны, обеспечиваются перфузия ткани и доставка необходимых питательных веществ и кислорода; с другой — недавно сформированные эндотелиальные клетки стимулируют рост прилежащих клеток опухоли, секретируют такие факторы роста, как инсулиноподобные факторы роста (IGF), PDGF и колониестимулирующий фактор роста макрофагов и гранулоцитов.
Ангиогенез обеспечивает не только постоянный рост опухоли, но также возможность проникать в сосудистое русло, что является основой метастазирования. Таким образом, ангиогенез — биологическое проявление злокачественности.
Как происходит ангиогенез в растущих опухолях? Ангиогенез в опухоли обусловлен балансом между ангиогенными факторами и факторами, ингибирующими ангиогенез. На ранних стадиях развития злокачественных опухолей человека ангиогенез не индуцирован. Опухоль остается маленькой или растет in situ в течение многих лет, пока регуляторные механизмы ангиогенеза не заканчивают эту стадию сосудистого покоя.
Молекулярный базис для запуска ангиогенеза заключается в увеличенном производстве ангиогенных факторов и/или потере ингибиторов ангиогенеза. Эти факторы могут образовываться непосредственно самими клетками опухоли, клетками воспаления (например, макрофагами) или стромаль-ными клетками. Протеазы, продуцируемые как самими опухолевыми клетками, так и стромальными клетками, образовавшимися в ответ на рост опухоли, также принимают участие в регулировании баланса между ангиогенными и антиангиогенными факторами.
Так, с одной стороны, многие протеазы могут высвобождать из ВКМ и активировать проангиогенный FGF-2, с другой стороны, протеазы способствуют продукции трех потенциальных ингибиторов антиогенеза — ангиостатина, эндостатина и васкулостатина, образующихся при протеолитическом расщеплении плазминогена, коллагена и транстиретина соответственно. Переключение ангиогенеза контролируется несколькими физиологическими стимулами, например гипоксией. Относительный дефицит кислорода стимулирует продукцию множества проангиогенных цитокинов, например VEGF и FGF-2, через активацию HIF-la, фактора транскрипции, чувствительного к кислороду.
Эти факторы создают так называемый ангиогенный градиент, стимулируя пролиферацию эндотелия и направляя рост новых сосудов к опухоли. VEGF также усиливает экспрессию лигандов, активирующих сигнальный путь Notch, являющийся ключевым в регуляции ветвления и плотности новообразованных сосудов. И про-, и антиангиогенные факторы регулируются многими другими генами, часто мутантными при злокачественных опухолях. Например, в нормальных клетках p53 может стимулировать экспрессию антиангиогенных молекул, таких как тромбоспондин-1, и подавлять экспрессию проангиогенных молекул, таких как VEGF.
Таким образом, утрата p53 в клетках опухоли не только приводит к потере точек контроля клеточного цикла, но и обеспечивает подходящее микроокружение для ангиогенеза. Транскрипция VEGF также регулируется сигнальным путем RAS/MAPK, а мутации RAS или MYC стимулируют производство VEGF. В главе 3 были обсуждены вопросы, как VEGF, FGF-2 и сигнальный путь Notch взаимодействуют между собой и координируют ангиогенез.
VEGF и FGF-2 обычно экспрессируются многими опухолями человека, а повышение уровня данных факторов в крови и моче определяется у значительной части пациентов со злокачественными опухолями. Для лечения многих видов злокачественных опухолей одобрено использование бевацизумаба (моноклональных антител к VEGF). Еще один новый подход — применение антител, блокирующих активацию сигнального пути Notch, что приводит к формированию дефектных сосудов, которые не обеспечивают эффективного кровоснабжения опухоли.
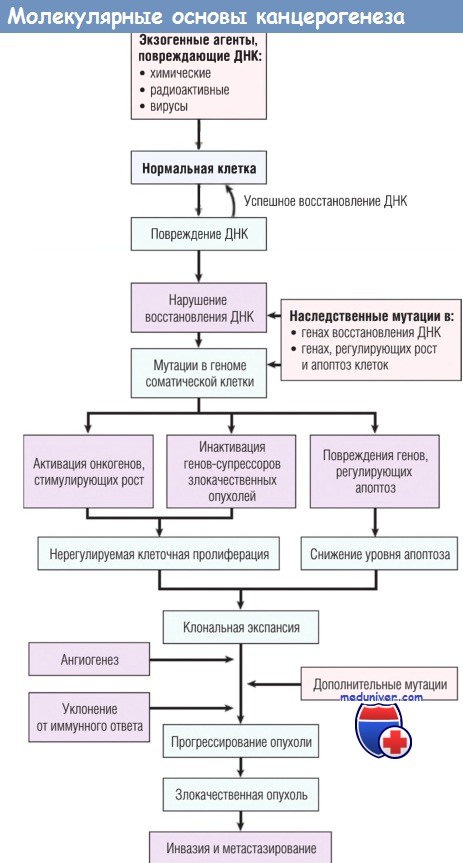
ДНК — дезоксирибонуклеиновая кислота.
- Рекомендуем ознакомиться со следующей статьей "Механизмы инвазии опухоли"
Оглавление темы "Патофизиология опухоли":- Ген PTEN и его значение в развитии опухоли
- Гены NF1, NF2 и их значение в развитии опухоли
- Ген VHL и его значение в развитии опухоли
- Ген WT1 и его значение в развитии опухоли
- Ген PTCH и его значение в развитии опухоли
- Механизмы уклонения клеток опухоли от апоптоза
- Механизмы безграничного потенциала деления клеток
- Механизмы ангиогенеза опухоли
- Механизмы инвазии опухоли
- Механизмы гематогенного метастазирования опухоли по сосудам

