Х-сцепленная доминантная протопорфирия - краткая характеристика
Х-сцепленная доминантная протопорфирия - краткий обзор:
- Последняя из недавно открытых порфирий.
- Очень редкая форма, сведений о распространенности еще нет.
- Х-сцепленное доминантное заболевание, развивающееся вследствие мутации с приобретением патологических функций эритроидной синтазы δ-аминолевуленовой кислоты II типа.
- Возраст манифеста, кожные симптомы и осложнения сходны с таковыми при эритропоэтической протопорфирии (ЭПП).
- Частота развития заболеваний печени, вероятно, выше, чем при эритропоэтической протопорфирии (ЭПП).
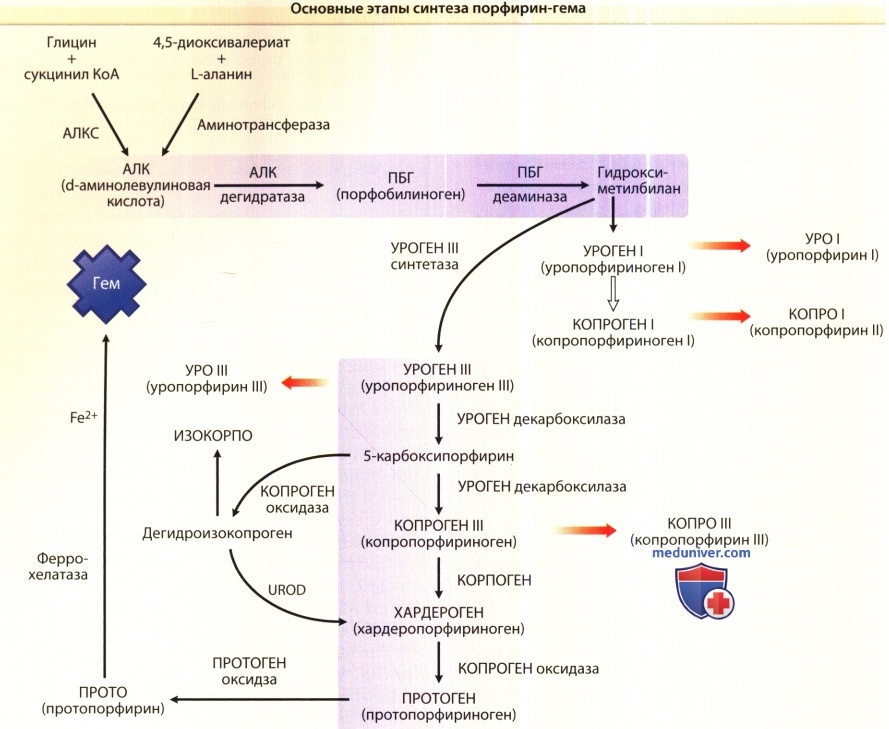
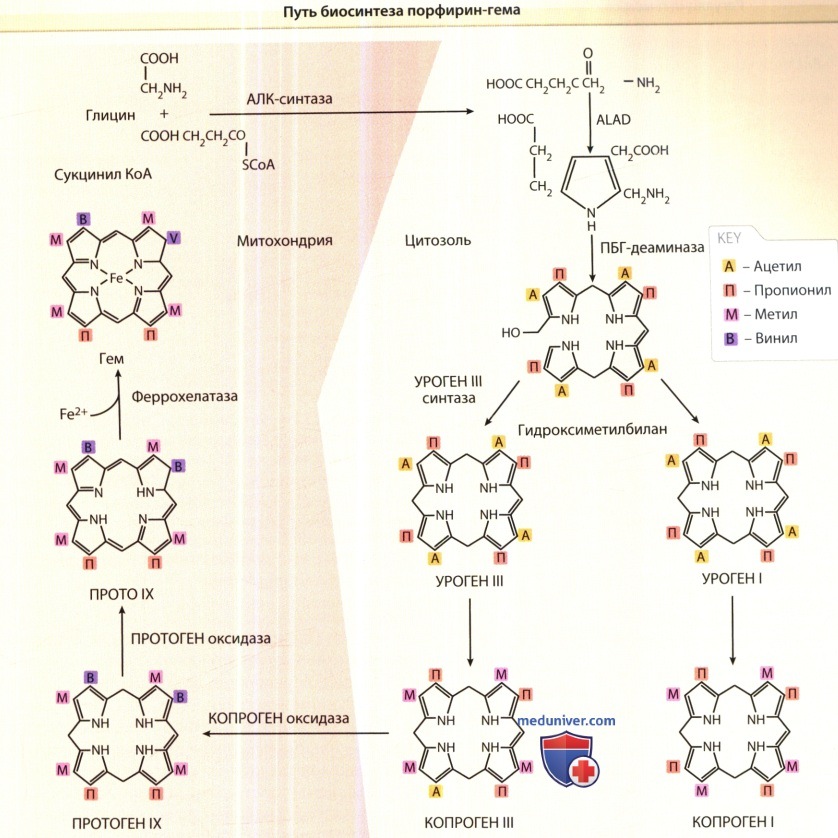
Аминолевуленовая кислота может образовываться из глицина и сукцинилКоА(СКоА), что является основным источником у млекопитающих и катализируется митохондриальным энзимом АЛА синтазой (АЛАС).
Две молекулы АЛА формируют монопирроль порфобилиногена (ПБГ) в реакции, катализированной ферментом АЛА дегидратазой (АЛАД).
Четыре молекулы ПБГ упакованы с помощью ПБГ деаминазы (ПБГД), также известной как гидроксиметилбилансинтаза (ГМБС), в линейный тетрапиррол, гидрокисметилбилан (ГМБ), который может спонтанно зациклироваться и образовывать уропорфириноген (УРОГЕН) 1.
Четыре ацетильные группы УРОГЕНа 1 последовательно декарбоксилируются уропорфириногендекарбоксилазой (УРОД), чтобы образовать копропорфириноген (КОПРОГЕН) 1.
ГМБ также может превращаться в УРОГЕН III с помощью фермента уропрфириноген III синтазы (УРОС), в этой реакии одно из колец монопирроля «опрокидывается», что меняет последовательность концевых цепей.
Ацетильная группы УРОГЕН III последовательно декарбоксилируются с помощью УРОД до КОПРОГЕН III.
КОПРОГЕН III превращается в протопорфириноген (ПРОТОГЕН) IX с помощью фермента копропорфириноген оксидазы (КПОКС), которая оксидативно декарбоксилирует каждую пропионильную группу.
ПРОТОГЕН IX превращается в протопорфирин (ПРОТО) IX с помощью протопорфириногеноксидазы (ППОКС). ПРОТО IX превращается в гем с помощью феррохелатазы (ФЕХ), которая катализирует внедрение в молекулу закис-ных соединений железа.
Синтаза δ-аминолевуленовой кислоты является митохондриальным ферментом, который катализирует превращение δ-аминолевуленовой кислоты и представляет собой гомодимер двух идентичных каталитически активных субъединиц молекулярной массой в 55 кДа, сцепленных с каталитически неактивными субстратами большей молекулярной массы.
Основная задача этого фермента—контроль синтеза гема в печени посредством механизма обратной отрицательной связи. Гем регулирует печеночную синтазу δ-аминолевуленовой кислоты, оказывая воздействие сразу на несколько участков.
В настоящее время известны две различным образом экспрессируемые изоформы синтазы δ-аминолевуленовой кислоты: одна секретируется повсеместно, включая печень (I тип), другая — лишь в эритроидных тканях— II тип. Считается, что существуют два пула (цитозольный и ядерный), регулирующие соответствующие изоферменты. Обнаружены два гена, кодирующие различные тканеспецифические мРНК синтазы δ-аминолевуленовой кислоты.
Человеческий конститутивный ген расположен в хромосоме 3р21, а эритроидный ген — в дистальном субрегионе хромосомы Xp21-Xq21. Эритроидный предбелок на 75% похож на печеночный белок. Иммунохимические различия этих двух белков наблюдаются у различных видов животных. В отличие от недостаточности предпоследнего из восьми ферментов пути биосинтеза гема, снижение активности синтазы δ-аминолевуленовой кислоты не связано с развитием специфического вида порфирии.
Мутации гена синтазы δ-аминолевуленовой кислоты II типа (ALAS2) были изначально связаны с Х-сцепленной сидеробластной анемией. Однако описано восемь случаев в семьях с делецией ALAS2 в результате сдвига рамки считывания, что вызывало замену или делецию 19-20 концевых остатков фермента, и в свою очередь приводило к приобретению патологических функций и значительно увеличивало его каталитическую активность.
Характерным биохимическим признаком у этих пациентов явилось увеличение как свободного, так и цинк-хелатированного протопорфирина в эритроцитах. Клинические проявления Х-сцепленной доминантной протопорфирии напоминают таковые при ЭПП.
- Вернуться в оглавление раздела "дерматология."
Редактор: Искандер Милевски. Дата публикации: 30.11.2018

