Хромосомные изменения при опухоли
Генетическое повреждение, которое активирует онкогены или инактивирует гены-супрессоры злокачественных опухолей, может быть едва уловимым (например, точечные мутации) или достаточно серьезным и вовлекать хромосомы, что можно обнаружить в кариотипе. Активация онкогенов и утрата функционирующих генов-супрессоров вследствие мутаций уже были обсуждены в этой главе. Далее рассмотрим хромосомные изменения, значимые для канцерогенеза.
При определенных неоплазиях изменения кариотипа не случайны и обычны. Аномалии были идентифицированы в большинстве лейкемий и лимфом, во многих саркомах и карциномах. При определенных опухолях могут быть увеличены в размерах или утрачены целые хромосомы. Считается, что изменение количества хромосом (анеуплоидия) и их структурные нарушения развиваются на поздних стадиях развития опухоли, однако есть мнение, что анеуплоидия и генетическая нестабильность могут быть инициальными событиями канцерогенеза.
Важность изучения хромосомных изменений в опухолях объясняется двумя обстоятельствами. Во-первых, для идентификации онкогенов (например, Всl-2, ABL) и генов-супрессоров (например, АРС, RB) чрезвычайно важно молекулярное клонирование генов из мест разрывов или делеций хромосом. Во-вторых, определенные изменения кариотипа достаточно специфичны, что имеет диагностическую ценность, а в отдельных случаях может стать прогностическим фактором клинического течения заболевания.
Транслокации онкогена ABL при хронической миелоидной лейкемии и c-MYC при лимфоме Беркитта описаны ранее в контексте молекулярных дефектов в опухолевых клетках. Ряд других изменений кариотипа в опухолевых клетках отдельных типов опухолей рассмотрены в следующих главах.
К активации протоонкогенов приводят 2 типа хромосомных перестроек — транслокации и делеции.
а) Транслокации. Этот тип хромосомных перестроек встречается значительно чаще. Транслокации могут активировать протоонкогены двумя способами:
- в лимфоидных опухолях специфические транслокации приводят к сверхэкспрессии протоонкогенов путем отдаления от собственных нормальных регуляторных генов и попадания на новом месте под влияние активного промотора;
- во многих опухолях системы кроветворения, саркомах и некоторых карциномах транслокации могут привести к слияниям двух не связанных между собой последовательностей двух разных хромосом и образованию рекомбинантных гибридных генов, которые кодируют химерные белки, а также в разной степени стимулируют рост и выживаемость клеток или усиливают их самообновление и блокируют дифференцировку.
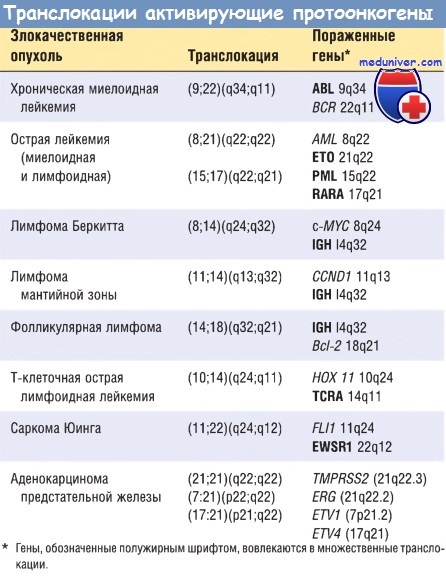
Гиперэкспрессию протоонкогенов, которую вызывает транслокация, наиболее полно можно продемонстрировать на примере лимфомы Беркитта. В подобных опухолях обнаруживается одна из трех транслокаций, связанных с хромосомой 8q24, где локализуется ген MYC, а также с хромосомами, несущими один из трех генов Ig.
Нормальный локус MYC полностью контролируется и высоко экспрессируется в основном в делящихся клетках. В лимфоме Беркитта наиболее часто обнаруживают транслокацию MFC-содержащего сегмента 8-й хромосомы на хромосому 14q32 вблизи гена IGH. Генетическое обозначение данной транслокации — t(8:14)(q24;q32). Молекулярные механизмы транслокационной активации MYC, а также точки разрывов в гене могут быть различными.
В большинстве случаев при транслокации происходит точечная мутация или утрата регуляторной последовательности гена MYC, который замещается промоторными участками локуса IGH с высокой экспрессией в клетках-предшественниках В-лимфоцитов. Поскольку кодирующие последовательности остаются интактными, происходит высокая нерегулируемая экспрессия гена.
Постоянное обнаружение транслокации MYC в лимфоме Беркитта подтверждает важную роль повышенной экспрессии МУС в патогенезе данной опухоли.
Другим примером транслокации онкогенов в локусы антигенных рецепторов являются лимфоидные опухоли. Как упоминалось ранее, в лимфоме из клеток мантийной зоны отмечается усиленная экспрессия гена циклина D1 (CCND1), возникающая в результате его транслокации с хромосомы 11q13 на хромосому 14q32, где он соседствует с локусом гена IGH.
В В-клеточных фолликулярных лимфомах реципрокная транслокация t(14;18)(q32;q21) между 14-й и 18-й хромосомами, которая является наиболее типичной транслокацией в злокачественных лимфоидных опухолях, приводит к сверхэкспрессии гена Bcl-2 на 18-й хромосоме. Неудивительно, что все опухоли с вовлечением генов Ig имеют В-клеточный гистогенез. В аналогичных ситуациях повышенная экспрессия протоонкогенов в Т-клеточных опухолях является результатом их транслокации в зону Т-клеточных рецепторов. Вовлеченные онкогены относятся к разным группам, но в большинстве случаев, как это происходит и с MYC, они кодируют ядерные факторы транскрипции.
Филадельфийская хромосома, характерная для хронической миелоидной лейкемии и острой лимфобластной лейкемии, также является прототипом онкогена, образованного в результате слияния двух отдельно расположенных генов. При этом в результате реципрокной транслокации происходит перемещение части протоонкогена с-ABL (с 9-й хромосомы) к онкогену BCR на 22-й хромосоме. Гибридный ген BCR-ABL кодирует синтез химерного белка, обладающего тирозинкиназной активностью.
Как упоминалось ранее, BCR-ABL-тирозинкиназу используют как терапевтическую мишень при лечении лейкемий с замечательными результатами. По данным цитогенетических исследований транслокации при хронической миелоидной лейкемии и острой лимфобластной лейкемии идентичны, но на молекулярном уровне они обычно различаются. В большинстве случаев хронической миелоидной лейкемии химерный белок BCR-ABL имеет молекулярную массу 210 кДа, а при острой лимфобластной лейкемии — 190 кДа.
Факторы транскрипции нередко выступают в роли партнеров при слиянии генов в клетках злокачественных опухолей. Например, ген MLL (миелоидной и лимфоидной лейкемий), локализованный на хромосоме 11q23 и являющийся компонентом комплекса, ремоделирующего хроматин, вовлечен в 50 вариантов транслокаций с различными генами-партнерами, некоторые из которых являются факторами транскрипции.
Саркома Юинга и примитивные нейроэктодермальные опухоли отличаются транслокацией гена саркомы Юинга (EWSR1) на хромосому 22q12. Ген EWSR1 вовлечен в множество различных транслокаций, при этом его партнерами выступают гены факторов транскрипции. В саркоме Юинга и примитивных нейроэктодермальных опухолях ген EWSR1 сливается с геном FLI1, являющимся фактором транскрипции семейства ETS. Образующийся химерный белок EWS-FLI1 обладает трансформирующим действием. Почему транслокации строго коррелируют с определенными типами опухолей, до сих пор остается непонятым.
Отчасти объяснение можно найти в постоянно обсуждаемом факте, что как минимум один из генов-партнеров является фактором транскрипции, используемым для развития и дифференцировки нормальных клеток того же типа, что и опухоль. Например, многие гены, участвующие в постоянных транслокациях при острых лейкемиях (в частности, MLL), играют важную роль в регенерации КСК и нормальной дифференцировке миелоидных и лимфоидных клеток. Химерный белок, образующийся в результате транслокации, чаще всего ингибирует, но иногда и усиливает транскрипционную активность.
До недавнего времени большинство транслокаций выявляли при лейкемиях, лимфомах и саркомах; значительно реже транслокации идентифицировали в карциномах, даже несмотря на то, что карциномы встречаются намного чаще. Комплексное изучение кариотипа в карциномах представляет определенные трудности. Однако недавно была обнаружена транслокация регуляторного гена андрогенов TMPRSS2 (21q22) и одного из факторов транскрипции семейства ETS (ERG [21q22], ETV1 [7р22.2] или ETV4 [17q21]) в свыше 50% наблюдений аденокарцином предстательной железы.
Подобные транслокации, похоже, происходят на ранних стадиях канцерогенеза и присутствуют в интраэпителиальной неоплазии предстательной железы высокой степени (предопухолевом состоянии). Патогенетическая связь между указанными транслокациями и развитием рака предстательной железы полностью не ясна, однако следует обратить внимание на перемещение генов семейства ETS из области с нормальной системой контроля в локус регуляторного гена андрогенов TMPRSS2, с которым и происходит слияние. Таким образом, при раке предстательной железы факторы транскрипции семейства ETS чрезмерно экспрессируются, что, как это было показано при саркоме Юинга, приводит к трансформации клеток.
Большой интерес представляет выявление гибридных генов в других карциномах. Многие гибридные гены служат маркерами канцерогенеза и определяют свойства злокачественных неоплазий по аналогии со значением BCR-ABL при хронической миелоидной лейкемии. Таким образом, блокирование таких генов становится задачей таргетной терапии карцином.
б) Делеции. Хромосомные делеции — вторая по распространенности структурная аномалия в клетках опухоли. По сравнению с транслокациями делеции больше распространены в солидных опухолях, не ассоциированных с системой кроветворения. Делеции специфических областей хромосом связаны с утратой генов-супрессоров. Как обсуждалось ранее, делеция хромосомы 13q14 (сайт гена RB) связана с ретинобластомой. Делеции 17р, 5q и 18q найдены при колоректальном раке; эти области содержат три гена-супрессора злокачественных опухолей.
Делеция 3р отмечена в нескольких опухолях, она чрезвычайно типична для мелкоклеточных карцином легкого, поэтому поиски генов-супрессоров злокачественных опухолей ведут именно в этом месте.
- Рекомендуем ознакомиться со следующей статьей "Амплификация генов при опухоли"
Оглавление темы "Патогенез опухоли":- Молекулярная генетика метастазирования опухоли
- Геномная трансформация как причина развития опухоли
- Влияние стромы на развитие опухоли
- Эффект Варбурга в метаболизме опухоли
- Хромосомные изменения при опухоли
- Амплификация генов при опухоли
- Эпигенетические изменения как причина опухоли
- МикроРНК как причина злокачественной опухоли
- Молекулярные механизмы многоступенчатого канцерогенеза
- Механизмы и фазы химического канцерогенеза
- Когда и зачем организму нужны сорбенты

