Роль хемокинов в миграции лейкоцитов кожи
В целом считается, что хемокины исполняют как минимум три различные роли, рекрутируя защитные клетки организма, преимущественно лейкоциты, к местам воспаления. Во-первых, они обеспечивают сигнал или сигналы, необходимые для полной остановки (то есть захвата) лейкоцитов в кровеносных сосудах на участках воспаления, таких как кожа.
Во-вторых, хемокины участвуют в трансмиграции лейкоцитов с люменальной поверхности кровеносного сосуда на его наружную поверхность. В-третьих, после трансмиграции хемокины привлекают лейкоциты к участкам воспаления в дерме или эпидермисе. Богатым источником хемокинов при стимуляции соответствующими цитокинами являются кератиноциты и эндотелиальные клетки. Кроме того, известно, что хемокины и их рецепторы играют важную роль в эмиграции резидентных дендритных клеток кожи (ДК) [то есть клеток Лангерганса (КЛ) и дермальных ДК] из кожи в дренирующие лимфоузлы через афферентные лимфатические сосуды — процесс, который имеет большое значение для развития приобретенного иммунного ответа.
Данная статья разбита на три подсекции. Первая посвящена базовой концепции захвата лейкоцитов в воспаленных кровеносных сосудах перед трансмиграцией и описывает многоэтапную модель рекрутирования лейкоцитов. Во второй подробно освещаются механизмы Т-клеточной миграции. Финальная подсекция посвящена механизмам, посредством которых хемокины опосредуют физиологическую миграцию дендритных клеток из кожи в региональные лимфоузлы.
а) Многоэтапная модель рекрутирования лейкоцитов. Для адгезии и миграции лейкоцитов в периферические ткани, им необходимо преодолеть силу кровотока, когда они связываются с активированными эндотелиальными клетками на участке воспаления. Согласно модели многоэтапного каскада рекрутирования лейкоцитов, одна группа гомологичных молекул адгезии, называемых селектинами, осуществляет временное прикрепление лейкоцитов к эндотелиальным клеткам, в то время как другая группа адгезивных молекул, называемых интегринами, и их рецепторы (члены суперсемейства иммуноглобулинов), осуществляют более прочное связывание (то есть захват) и трансмиграцию.
Селектины (Е-, L- и Р-селектин) являются членами более крупного семейства связывающих углеводы белков, называемых лектинами. Селектины связывают соответствующие им углеводородные лиганды, расположенные на белковых каркасах, и, таким образом, опосредуют временное связывание или «качение» (роллинг) лейкоцитов на эндотелиальных клетках.
Ассоциированный с кожей сосудистый селектин, известный как Е-селектин, стимулируется на эндотелиальных клетках воспалительными цитокинами, такими как фактор некроза опухоли (ФНО)-а и связывается с углеводородами на основе сиалил-Льюис-Х. Лиганды Е-селектина образуют характерные эпитопы, известные как кожный лимфоцит-ассоциированный антиген (CLA). CLA экспрессируется в 10-40% Т-клеток памяти и предложен в качестве маркера хоуминговых Т-клеток кожи.
Как минимум два хемокиновых рецептора [рецептор 10 хемокина СС (CCR10) и CCR4] экспрессируются преимущественно Т-клетками памяти CLA+. В то время как Е-селектин является важным компонентом избирательного хоуминга кожи, имеются данные о том, что L-селектин участвует в миграции Т-клеток в кожу.
На втором этапе этой модели должны «включиться» или активироваться из покоящегося состояния лейкоцитарные интегрины, такие как интегрины семейства β2, чтобы связаться с контррецепторами, такими как молекула внутриклеточной адгезии-1 (ICAM-1), экспрессированными на эндотелиальных клетках. Большое количество данных дает основание предположить, что связывание хемокинов с хемокиновыми рецепторами лейкоцитов играет решающую роль в активации обоих интегринов β1 и β2.
Активация хемокиновых рецепторов приводит к сложному сигнальному каскаду, вызывающему конформационное изменение в индивидуальных интегринах, которое в свою очередь повышает аффинность и авидность индивидуальных лейкоцитарных интегринов к их лигандам.
Более того, поздние этапы миграции (например, трансмиграция или диапедез) в избранных случаях также оказались зависимыми от хемокинов. Способность нейтрофилов к адгезии на воспаленных кровеносных сосудах, вероятно, зависит от экспрессии ими лигандов L-селектина и Е-селектина, в то время как их захват на активированном эндотелии, скорее всего, зависит от экспрессии ими CXCR1 и CXCR2, как описано ниже для заживления ран. Активация интегрина посредством хемокин-опосредумых сигналов в Т-клетках представляется более сложной. Эти клетки используют множественные рецепторы хемокинов, что будет описано подробнее в следующей статье.
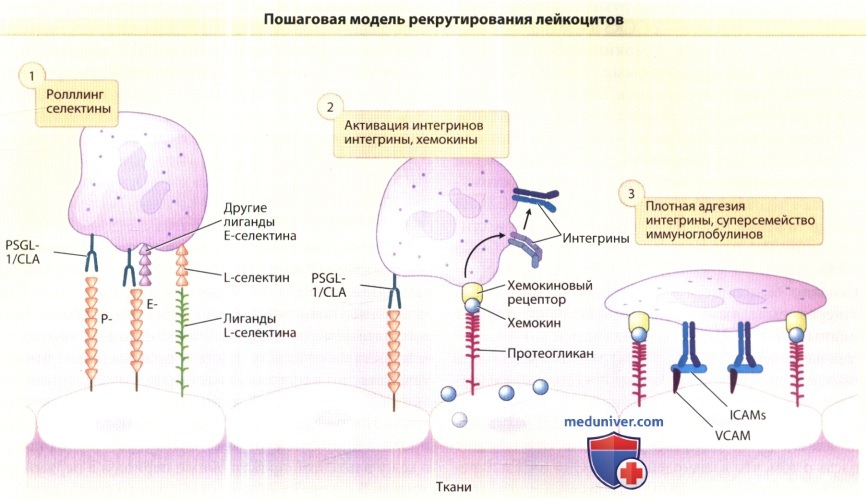
Лейкоциты, подталкиваемые кровотоком, вначале временно связываются или «перекатываются» на поверхности активированных эндотелиальных клеток посредством быстрых взаимодействий с Р-, Е- или L-селектином.
Хемокины секретируются эндотелиальными клетками и связываются с протеогликанами, которые презентируют молекулы хемокинов хемокиновым рецепторам на поверхности лейкоцита.
После связывания хемокинового рецептора, каскад внутриклеточной сигнализации приводит к изменению конформации интегринов и изменениям в их распределении на плазматической мембране, в результате чего интегрины активируются.
Эти изменения приводят к высокоафинному/авидному связыванию интегринов с молекулами внутриклеточной адгезии эндотелиальной клетки (ICAM) и молекулой адгезии сосудистой клетки (VCAM-1) на этапе под названием «прочная адгезия»,
за которым следует трансмиграция лейкоцита между эпителиальными клетками в ткань.
б) Опосредуемая хемокинами миграция Т-клеток. Т-клетки, которые не контактировали с антигенами, называются «наивными». Их можно идентифицировать по экспрессии трех белков на клеточной поверхности: CD45RA (изоформа панлейкоцитарного маркера), L-селектина и рецептора хемокина CCR7. Эти Т-клетки эффективно мигрируют во вторичные лимфоузлы, где они могут контактировать с антиген-несущими дендритными клетками с периферии. После активации презентирующим антигеном дендритных клеток, Т-клетки экспрессируют CD45RO и называются Т-клетками памяти.
Они экспрессируют ряд молекул адгезии и рецепторов хемокинов, которые способствуют их экстравазации из кровеносных сосудов в воспаленную периферическую ткань. Специфическая субпопуляция клеток памяти с фенотипом CCR7, L-селектин предложена как представитель субпопуляции эффекторных Т-клеток «памяти», готовых быстро проявить на периферических участках свою цитотоксическую активность и способность мобилизовать цитокины.
Хотя хемокины могут быть и секретированными, и растворимыми, общий положительный заряд на большинстве хемокинов позволяет им связываться с отрицательно заряженными протеогликанами, такими как сульфат гепарина, которые присутствуют на лю метальной поверхности эндотелиальных клеток, способствуя их презентации Т-клеткам по мере того, как они «катятся» вдоль этой поверхности. После связывания лиганда рецепторы хемокинов посылают внутриклеточные сигналы, которые приводят к возрастанию аффинности и авидности Т-клеточных интегринов, таких как ассоциированный с лимфоцитарной функцией антиген-1 и очень поздний антиген-4, с их эндотелиальными рецепторами: молекулой внутриклеточной адгезии-1 и адгезивной молекулой-1 сосудистой клетки соответственно.
Лишь немногие хемокиновые рецепторы (CXCR4, CCR7, CCR4 и CCR6) экспрессированы на достаточном уровне на покоящихся Т-клетках периферической крови, чтобы осуществить это преобразование. По мере активации и стимуляции интерлейкина (ИЛ) -2 на активированных Т-клетках экспрессируется увеличение количества хемокиновых рецепторов (например, CXCR3), что повышает вероятность их реакции с другими хемокинами. В нескольких различных системах ингибиция специфических хемокинов, произведенных в эндотелиальных клетках или хемокиновых рецепторах на Т-клетках, существенно влияет на захват Т-клеток in vivo и in vitro.
CXCR3 служит рецептором лигандов хемокинов Mig (монокина, индуцируемого интерфероном-у), индуцируемого интерфероном белка 10 (IP-10) и интерфероном хемоаттрактанта-а Т-клеток. Все эти три хемокина отличаются от других хемокинов тем, что активно реагируют на стимуляцию интерфероном-у. Покоящиеся Т-клетки не экспрессируют функциональных уровней CXCR3, но стимулируют этот рецептор при активации, а также цитокины, в частности ИЛ-2. Будучи экспрессирован на Т-клетках, CXCR3 способен осуществлять захват Т-клеток памяти на активированных эндотелиальных клетках. На экспрессию его хемокиновых лигандов существенно влияет цитокиновый интерферон-у, синергично работающий с провоспалительными цитокинами, такими как ФНО-а, чтобы усилить экспрессию этих лигандов активированными эндотелиальными клетками и эпителиальными клетками.
В целом активация Т-клеток цитокинами, такими как ИЛ-12, ассоциируется с повышенной экспрессией CCR1, CCR2, CCR5 и CXCR3. Поскольку функциональные роли субпопуляции Т-хелперных клеток типа 1 (Th1) и Т-клеток типа ТЬ2 различны, можно предсказать, что эти две субпопуляции Т-клеток будут экспрессировать различные хемокиновые рецепторы. И действительно, CCR4 и CCR3 in vitro ассоциируются с клетками Th2, в то время как клетки ТЫ —с CCR5 и CXCR3.
В некоторых случаях хемокиновые рецепторы можно считать функциональными маркерами, которые различают лимфоциты типов ТЫ и Th2, одновременно способствуя их миграции к местам воспаления, для которых характерна картина «аллергического» или «клеточно-опосредуемого» иммунитета. Когда Т-клетки активируются in vitro в присутствии цитокинов, стимулирующих Тh1, наблюдается сильная экспрессия CXCR3 и CCR5, в то время как в присутствии цитокинов, стимулирующих Тh2, превалирует экспрессия CCR4, CCR8 и CCR3.
Недавно был описан маркер особой популяции Т-хелперов, выделяющих специальные эффекторные цитокины ИЛ-17 и ИЛ-22, обозначенный как CCR6. Эти так называемые Th17-клетки играют ведущую роль в патогенезе псориаза и других хронических воспалительных аутоиммунных заболеваний. Однако в здоровой коже большинство персистирующих резидентных Т-клеток также экспрессирует CCR6. Это наводит на мысль о том, что взаимодействие CCR6 и CCL20 регулирует Т-клеточную инфильтрацию кожи при воспалении, а также в гомеостатических условиях.
В то время как определенные хемокиновые рецепторы характерны для определенных Т-клеточных популяций, гибкая регуляция их экспрессии может усиливать миграционный потенциал циркулирующих Т-клеток и их перемещение в определенные ткани. Например, при некоторых условиях и Тh1, и Тh2-типы клеток могут экспрессировать CCR4. Также Т-регуляторные клетки (Treg) и Тh17-клетки имеют общие с другими Т-клеточными группами хемокиновые рецепторы и способны менять профили экспрессии хемокиновых рецепторов в зависимости от той микросреды, в которой они активированы.
Эпидермис является особенно богатым источником хемокинов, включая RANTES, хемоаттрактантный белок для макрофагов 1 (МСР-1), IP-10, ИЛ-8, LARC и регулируемый при активации хемокин тимуса (TARC), вероятно, способствующих эпидермальной миграции Т-клеток. Кератиноциты пациентов с характерными кожными заболеваниями имеют уникальный цитоки-новый профиль. Например, кератиноциты пациентов с атопическим дерматитом в ответ на ИЛ-4 и ФНО-а синтезировали РНК для RANTES значительно раньше, чем кератиноциты здоровых лиц и пациентов с псориазом. При псориазе кератиноциты синтезировали более высокие уровни IP-10 при стимуляции цитокинами, а также более высокие конституциональные уровни ИЛ-8, хемокина, который, как известно, рекрутирует нейтрофилы.
ИЛ-8 способствует возрастанию числа нейтрофилов, локализующихся при псориазе в надбазальном и роговом слоях эпидермиса. IP-10 может рекрутировать активированные Т-клетки фенотипа Тh1 в эпидермис и играет определенную роль в миграции злокачественных Т-клеток в кожу при кожных Т-клеточных лимфомах.
Хемокиновый лиганд 27 (CCL27) хемокина (СТАСК), привлекающего Т-клетки в кожу, избирательно и конституционально экспрессирован в эпидермисе, и его экспрессия в случае воспалительных заболеваний усиливается незначительно. Интересно, что в моделях воспалительных заболеваний СТАСК in vitro привлекает преимущественно Т-клетки памяти CLA+ и играет определенную роль в рекрутировании и функционировании хоуминговых Т-клеток кожи.
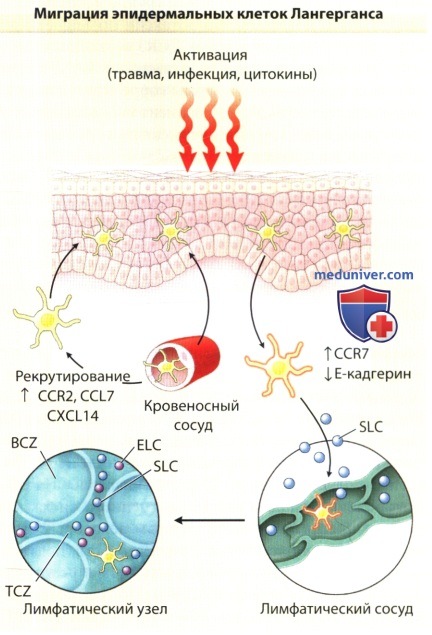
КЛ стимулируются различными факторами, включая травму, инфекционные агенты и цитокины, такие как, интерлейкин-1β и фактор некроза опухоли-α.
Выбрав антигены, активированные клетки Лангерганса ингибируют Е-кадхерин и интенсивно стимулируют рецептор 7 хемокина СС (CCR7).
Обнаружив лиганд рецептора CCR7, хемокин вторичного лимфоидного органа SLC (•), синтезируемый лимфатическими эндотелиальными клетками,
клетки Лангерганса мигрируют в лимфатические сосуды, пассивно перетекают в лимфоузлы и останавливаются в зонах Т-клеток (TCZ),
богатых двумя лигандами CCR7: SLC и хемокиновым лигандом ELC (индуцированная вирусом Эпштейна-Барр молекула 1).
Заметьте, что хемокины также способствуют рекрутированию клеток Лангерганса как в состоянии покоя, так и при воспалении.
BCZ = Зона В-клеток; CCL=Лиганд хемокина СС; СХCL = Лиганд хемокина СХС.
в) Роль хемокинов в миграции дендритных клеток из кожи в региональные лимфоузлы. Антиген-презентирующие клетки, включая дендритные клетки кожи (ДК), являются главными инициаторами иммунных ответов, а способы их миграции влияют на исход иммунологических процессов. Их задача состоит в захвате антигенов на участках инфекции или травмы и в доставке этих антигенов в региональные лимфоузлы, где они и представляют антиген и регулируют реакции Т- и В-клеток. Резидентные дендритные клетки кожи, как правило, происходят из гематопоэтических прогениторных клеток костного мозга и мигрируют в кожу в поздний пренатальный период и в первый год жизни.
В условиях покоя (стабильного состояния) гомеостатическая выработка CXCL14 кератиноцитами (рецептор неизвестен) может участвовать в привлечении прекурсоров ДК фенотипа CD14+ в базальный слой эпидермиса. Сходным образом клетки Лангерганса (LC), как и клетки-предшественники CD1c+LC, обладают выраженной реакцией на хемоаттрактант кератиноцитов CCL20. При воспалении, когда резидентные ДК кожи и клетки Лангерганса в больших количествах покидают кожу, кератиноциты секретируют много разных хемокинов, включая CCL2 и CCL7 (посредством CCR2) и CCL20 (посредством CCR6), что может привлечь прекурсоры моноцитоподобных ДК в эпидермис для восполнения популяции клеток Лангерганса.
При активации воспалительными цитокинами (например, ФНО-а и ИЛ- 1β) липополисахариды или (при травме) ДК кожи, включая клетки Лангерганса, покидают эпидермис, поступают в афферентные лимфатические сосуды и мигрируют в дренирующие региональные лимфоузлы, где встречают наивные Т-клетки и Т-клетки памяти. На этом пути дендритными клетками руководят хемокины. Активированные ДК специфически стимулируют экспрессию CCR7, который связывается с хемокином вторичной лимфоидной ткани (SLC/CCL21), хемокином, конституционально экспрессируемым лимфатическими эндотелиальными клетками. SLC направляет дендритные клетки в кожные лимфатические сосуды, помогая им задержаться в богатой вторичными лимфоидными хемокинами ткани региональных дренирующих лимфоузлов.
Интересно, что наивные Т-клетки также в значительной мере экспрессируют CCR7 и используют этот рецептор для закрепления в эндотелиальных венулах.
Важность механизма CCR7 демонстрируется на примере клеток Лангерганса мышей, лишенных CCR7 и плохо мигрирующих из кожи в региональные лимфоузлы, а также блокировкой антител к SLC миграции ДК с периферии в региональные лимфоузлы. Таким образом, CCR7 и его лиганды способствуют рекрутированию клеток как минимум двух разных типов — наивных Т-клеток и ДК — в лимфоузлы по двум разным маршрутам как в условиях воспаления, так и в условиях покоя.
После того как дендритные клетки достигнут лимфатического узла, они должны взаимодействовать с Т-клетками, чтобы образовать так называемый «иммунологический синапс», важный для активации Т-клеток. Активированные ДК секретируют ряд хемокинов, включая производимый макрофагами хемокин, который привлекает Т-клетки в окружение дендритных клеток и способствует адгезии между этими двумя типами клеток. Рецептор CCR5 (через лиганд CCL3/4) также был идентифицирован как медиатор миграции наивных Т-клеток CD8 к скоплениям антиген-специ-фических Т-клеток CD4+ и дендритных клеток. Следовательно, хемокины организуют сложную серию миграционных процессов, доставляя как дендритные клетки, так и Т-клетки в пределы лимфоузла, где экспрессия хемокинов самими дендритными клетками является прямым сигналом для связывания Т-клеток.
- Рекомендуем далее ознакомиться со статьей "Хемокины при атопическом дерматите"
Оглавление темы "Иммунология болезней кожи.":- Подсемейства и структура хемокинов кожи
- Хемокиновые рецепторы и передача сигнала в коже
- Роль хемокинов в миграции лейкоцитов кожи
- Хемокины при атопическом дерматите
- Хемокины при псориазе
- Хемокины при раке кожи
- Хемокины при инфекции кожи
- Кратко что такое аллергический контактный дерматит (АКД)?
- У кого чаще встречается аллергический контактный дерматит (АКД)? Эпидемиология
- Причины и как развивается аллергический контактный дерматит? Этиология, патогенез

