Клетки Лангерганса как антигенпредставляющие клетки кожи
В 1868 г. студент-медик Пауль Лангерганс, движимый интересом к анатомии кожных нервов, выделил популяцию клеток дендритной формы в надбазальных слоях эпидермиса после импрегнации кожи человека солями золота. Эти клетки, которые позднее были обнаружены в многослойном плоском эпителии практически всех млекопитающих, называются теперь клетками Лангерганса (КЛ).
Экспрессия Са2+-зависимого лектина Лангерина (CD207) в настоящее время является наилучшим признаком, отличающим клетки Лангерганса от других клеток. Лангерин представляет собой трансмембранную молекулу, которая ассоциируется с гранулами Бирбека и является достаточной для их формирования. Гранулы Бирбека — это прототипические, определяющие тип клетки органеллы клеток Лангерганса (КЛ). Они представляют собой пятислойные цитоплазматические структуры, часто имеющие форму теннисной ракетки (на ультраструктурном уровне).
Дополнительное присутствие Лангерина на поверхности клеток Лангерганса (КЛ) в сочетании со специфичным для него связыванием маннозы позволяет предположить, что Лангерин участвует в захвате клетками Лангерганса патогенов, содержащих маннозу. Однако разрушение гена Лангерина у экспериментальных животных не приводило к выраженной потере функциональных свойств клеток Лангерганса (КЛ).
В норме в условиях целостности эпидермиса идентификацию клеток Лангерганса помимо лангерина обеспечивают и некоторые дополнительные молекулы. К ним относятся CD1а; антигены ГКГ класса II, HLA-DR, HLA-DQ и HLA-DP, а также CD39, мембранная, устойчивая к формалину, сульфгидрил-зависимая аденозинтрифосфатаза (АТФаза).
Плотность популяции клеток Лангерганса (КЛ) в коже человека варьирует в различных регионах эпидермиса. В коже головы, лица, шеи, туловища и конечностей плотность клеток Лангерганса (КЛ) составляет от 600 до 1000/мм2. Сравнительно низкая плотность (примерно 200/мм2) обнаруживается в коже ладоней, подошв, аногенитальной и крестцово-копчиковой областей, а также в слизистой оболочке щек. Плотность КЛ у человека уменьшается с возрастом, а количество КЛ в коже при хроническом актиническом повреждении значительно ниже, чем в коже, не подвергавшейся воздействию ультрафиолетового облучения.
Дендритные клетки фенотипа HLA-DR+/ATФaзa+ идентифицируются в эпидермисе человека к 6-7 неделе эмбрионального развития. Эти клетки происходят из гемопоэтических протениторных клеток желточного мешка или печени эмбриона и первичных участков гемопоэза в эмбриональный период. К 14 неделе внутриутробного развития эти клетки последовательно приобретают фенотипические характеристики, свойственные клеткам Лангерганса. Относительная стабильность количества клеток Лангерганса (КЛ) в последующей жизни достигается соблюдением хрупкого баланса между созреванием КЛ и их поступлением в эпидермис, а также гибелью КЛ и их миграцией из эпидермиса.
В пределах эпидермиса клеток Лангерганса (КЛ) прикреплены к окружающим кератиноцитам посредством гомотопической, опосредованной Е-катедрином адгезии. Это прикрепление и экспозиция TGF-βl также препятствуют окончательной дифференцировке и миграции, обеспечивая, таким образом, пребывание клеток в состоянии гомеостаза в пределах эпидермиса. Могут существовать два взаимно неисключающих друг друга пути возобновления популяции клеток Лангерганса (КЛ) в эпидермисе: (1) деление КЛ в пределах эпидермиса и (2) дифференцировка КЛ из резидентных клеток кожи или прекурсоров в составе крови. Свидетельством первой возможности является наличие циркулирующих/митотических КЛ в эпидермисе, однако еще предстоит установить, достаточно ли одного этого деления для поддержания эпидермальной популяции КЛ.
Данные о том, что период полужизни клеток Лангерганса в эпидермисе мышей в физиологических условиях составляет около 2-3 месяцев, позволяют предполагать значительное обновление популяции эпидермальных клеток Лангерганса даже в отсутствие воспалительного процесса. Кажущееся противоречие присутствует в наблюдении, согласно которому популяция клеток Лангерганса фрагмента человеческой кожи, трансплантированного мутантным «лысым» мышам (nude mouse), сохраняется в неизменном виде в течение всей жизни трансплантанта, несмотря на пролиферацию эпидермиса и отсутствие циркулирующих предшественников человеческих клеток Лангерганса.
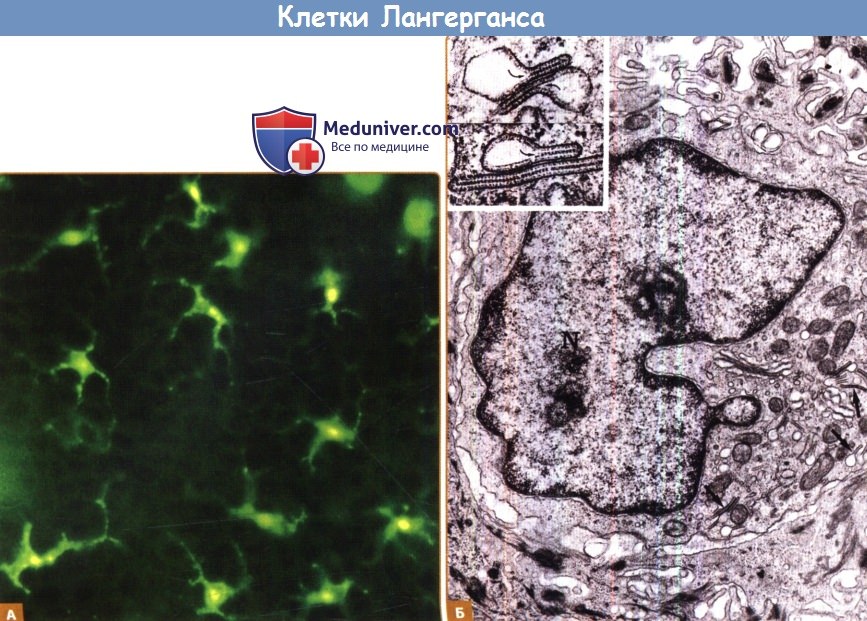
Б. Электронный микрограф клетки Лангерганса в эпидермисе человека. Стрелками показаны гранулы Бирбека.
N=ядро. Вставка: электронный микрограф гранул Бирбека. Изогнутые стрелки показывают напоминающее замок-молнию слияние ворсистых оболочек везикулярного участка гранулы.
Пограничная мембрана охватывает два слоя прилегающих к ней частиц и центральную пластинку, состоящую из двух линейных скоплений частиц.
Более того, эпидермальные клетки Лангерганса мышей, костный мозг которых подвергся летальному облучению и последующей трансплантации, лишь частично замещаются клетками Лангерганса донора, тогда как дендритные клетки других органов в массовом порядке заменяются донорскими клетками.
Оба этих факта позволяют предполагать, что предшественники это клеточной популяции персистируют в дерме, которая в отсутствие воспалительного процесса постоянно задействована в самообновлении популяции эпидермальных клеток Лангерганса. Главным кандидатом в предшественники клеток Лангерганса являются дермальные CD 14+/CD11 с+-клетки, способные дифференцироваться в условиях in vitro в клетки Лангерганса под действием TGFβl.
В условиях воспаления (например, при УФ облучении, реакции трансплантат против хозяина), активизируется дополнительный путь рекрутинга эпидермальных клеток Лангерганса. При этом предшественники клеток Лангерганса проникают в ткань, и их потомки заселяют эпидермис под действием хемоаттрактантов, взаимодействующих с экспрессируемыми клетками Лангерганса хемокиновыми рецепторами CCR2 и CCR6, лиганды которых секретируются эндотелиальными клетками и кератиноцитами. Таким образом, CCR6 и его лиганд MIP-3a/CCL20 может отвечать за локализацию эпидермальных клеток Лангерганса in vivo, как это было ранее продемонстрировано в исследованиях клеток Лангерганса, дифференцирующихся из человеческих прогениторных клеток в условиях in vitro.
Эффект MIP-3α/CCL20 в отсутствие воспаления может поддерживаться или заменяться действием хемокина BRAK/CXCL14, который постоянно вырабатывается кератиноцитами. Стадия дифференцировки биологически релевантных циркулирующих предшественников клеток Лангерганса при вхождении в кожу при воспалении в условиях in vivo остается неустановленной. Однако имеются данные, что у экспериментальных животных предшественниками эпидермальных клеток Лангерганса могут быть клетки миелоидной, гранулоцитарно-макрофагальной, моноцитарной и даже общей лимфоидной линии.
Существуют убедительные доказательства, полученные в исследованиях in vitro и in vivo, что клетки Лангерганса играют ключевую роль в индукции адаптивных иммунных реакций на антигены, попадающие в кожу и/или образующиеся в ней (иммунный надзор). Это положение лучше всего иллюстрируют данные, полученные в ранних исследованиях, согласно которым суспензии эпидермальных клеток, содержащие клетки Лангерганса (в отличие от суспензий, из которых эти клетки удалены), периодически подвергающиеся воздействию либо растворимых белковых антигенов, либо гаптенов, вызывают генетически детерминированный, антиген-специфический, пролиферативный Т-клеточный ответ.
Inaba и соавт. обнаружили, что свежеизолированные «незрелые» клетки Лангерганса могут представлять растворимый антиген примированным Т-клеткам МНС класса II, однако являются очень слабыми стимуляторами необученных («наивных») аллогенных Т-клеток. Напротив, клетки Лангерганса, выделенные из суспензии эпидермальных клеток при культивировании в течение 72 часов или полученные из свежеизолированной мышиной культуры эпидермальных клеток, культивированных в течение 72 часов в присутствии GM-CSF и ИЛ-1 («зрелые» клетки Лангерганса), являются очень мощными стимуляторами первичных Т-клеточных пролиферативных реакций на аллоантигены, растворимые белковые антигены, гаптены.
Однако незрелые клетки Лангерганса значительно превосходят активированные цитокинами клетки Лангерганса по способности к захвату и процессингу нативных белковых антигенов. Соответственно незрелые клетки Лангерганса в большей степени, чем зрелые, экспрессируют рецепторы захвата антигенов. Зрелые клетки Лангерганса, хотя полностью сохраняют способность представлять предварительно прошедшие процессинг пептиды, однако теряют возможность к процессингу и представлению антигенов нативных белков.
При нарушениях гомеостаза кожи (например, при связывании с Толл-подобными рецепторами, контакте с гаптенами, в случаях гипоксии), клетки Лангерганса получают доступ к антигену/аллергену, проникающему в эпидермис, за счет удлинения дендритов, проникающих сквозь соединения эпидермальных клеток, что является примером удивительного взаимодействия между кератиноцитами и клетками Лангерганса. Несколько часов спустя клетки Лангерганса начинают увеличиваться в размерах, на их поверхности появляется все больше молекул МНС класса II. При этом клетки Лангерганса мигрируют в дерму, где проникают в афферентные лимфатические сосуды, и наконец, достигают Т-клеточных зон дренирующих лимфатических узлов.
В ходе этого процесса клетки Лангерганса подвергаются фенотипическим изменениям, сходным с происходящими в изолированных культурах эпидермальных клеток, т.е. происходит снижение активности молекул или структур, ответственных за захват антигена и его процессинг, а также за адгезию клетки Лангерганса к кератиноцитам (например, Fc-рецепторов, Е-кадгерина), при одновременной активации молекул, необходимых для миграции и стимуляции реакций необученных «наивных» Т-клеток (например, CD40, CD80, CD83, CD86). Механизмы, регулирующие миграцию клеток Лангерганса, становятся все более понятными. TNF-αand ИЛ-1β (под влиянием каспазы-1) являются ключевыми факторами, определяющими этот процесс, тогда как ИЛ-10, напротив, блокирует миграцию.
Усилении выработки и/или высвобождения в коже провоспалительных цитокинов, по всей вероятности, является одним из механизмов, в результате которых иммуностимулирующие факторы, попадающие на кожу или в кожу [например, имиквимод, олигонуклетид неметилированный цитозин-фосфат-гуанозин (CpG)] ускоряют миграцию клеток Лангерганса. Еще один пример — местное воздействие контактных аллергенов (например, динитрофторбензола), ведущее к активации определенных тирозинкиназ, модификации внутриклеточных структур и строения цитоплазматических органелл (повышения числа окаймленных ямок и везикул, эндосом и лизосом, гранул Бирбека), повышению подвижности клеток in situ.
Примечательно, что Cumberbatch et al. обнаружили при псориазе снижение способности клеток Лангерганса к миграции. Данная находка оказалась несколько неожиданной в связи с тем, что в коже больных псориазом зафиксирована значительная гиперпродукция TNF-a. Эти исследователи также обнаружили, что неспособность TNF-a и/или ИЛ-1β индуцировать миграцию клеток Лангерганса из непораженной кожи, не связана с изменениями экспрессии рецепторов к этим цитокинам. Важным барьером для мигрирующих клеток Лангергаса является базальная мембрана. Нa пути в дерму клетки Лангерганса, по всей видимости, соединяются с базальной мембраной с помощью α6-содержащих интегриновых рецепторов и вырабатывают протеолетические ферменты, например, коллагеназу IV типа (ММР-9), чтобы проникнуть сквозь нее и плотную сеть дермы в лимфатические сосуды. Мобилизацию клеток Лангерганса также индуцирует ИЛ-16.
Этот процесс, по всей видимости, может иметь место при атопическом дерматите. При этом заболевании дендритные клетки пораженной кожи экспрессируют на поверхности IgE, связанный с высокоаффинными Fc-рецепторами (FceRI), и опосредованное аллергеном перекрестное связывание с рецептором приводит к усилению выработки ИЛ-16. Накапливаются данные относительно того, что миграция дендритных клеток—не только активный, но и целенаправленный процесс. В этом отношении особо важен хемотаксический протеин остеопонтин. Он инициирует миграцию клеток Лангерганса из эпидермиса и является аттрактантом, за счет которого они направляются в лимфатические узлы, что реализуется за счет взаимодействия с N-терминальным эпитопом молекулы CD44.
Проникновение и активный транспорт кожных дендритных клеток по лимфатическим сосудам, по всей видимости, опосредовано связыванием моноритарных хемоатрактантных белков (МСР) с CCR2 и вторичных лифоидных хемокинов/CCL21, вырабатываемых клетками эндотелия лимфатических сосудов в дерме и соединяющихся с CCR7 на созревающих клетках Лангерганса и дендритных клетках кожи. Примечательно, что экспрессия CCL21 повышается при ирритантном и аллергическом контактном дерматите, что подразумевает регуляторную роль этой молекулы на миграцию дендритных клеток из кожи.
- Рекомендуем далее ознакомиться со статьей "Дендритные клетки дермы как антигенпредставляющие клетки"
Оглавление темы "Иммунология кожи.":- Регуляторные Т-клетки кожи (Treg-клетки)
- Фолликулярные Т-хелперы (Tfh-клетки) кожи
- Лимфоциты кожи в норме и при болезни
- Хоуминг Т-клеток памяти в коже
- Принципы представления антигенов антигенпредставляющими клетками кожи
- Дендритные клетки как антигенпредставляющие клетки кожи
- Клетки Лангерганса как антигенпредставляющие клетки кожи
- Дендритные клетки дермы как антигенпредставляющие клетки
- Определение и функции цитокинов кожи
- Классификация цитокинов кожи

