Дендритные клетки как антигенпредставляющие клетки кожи
Дендритные клетки являются единственными антигенпредставляющими клетками (АПК), способными к взаимодействию с интактными Т-клетками. В зависимости от статуса активации дендритных клеток (т.е., зрелых или незрелых) этот клеточный контакт будет приводить к продуктивной или непродуктивной Т-клеточной реакции. Впервые дендритные клетки были обнаружены в периферических лимфатических органах мышей (лимфоидные дендритные клетки).
Несколько лет спустя было показано присутствие дендритных клеток в нелимфоидной ткани (нелимфоидные дендритные клетки — nlDC), доказательством чему являлась экспрессия Fc и СЗ-рецепторов, а также МНСII-антигенов на клетках Лангерганса эпидермиса. Эта находка стала основанием для отнесения клеток Лангерганса к иммунным.
Дендритные клетки встречаются практически во всех тканях организма млекопитающих, как в норме (местные или резидентные дендритные клетки), так и при воспалительных процессах (воспалительные дендритные клетки). И резидентные, и воспалительные дендритные клетки развиваются из кроветворных стволовых и прогениторных клеток-предшественников (HSPC) в костном мозге. Клетки HSPC превращаются в прогениторные, которые способны к дальнейшей дифференцировке в одну или несколько субпопуляций дендритных клеток.
Предшественников дендритных клеток можно обнаружить в различных органах, включая костный мозг, тимус, а также в периферических лимфоидных тканях, включая кровь. Эти происходящие из крови предшественники дендритных клеток заселяют нелимфоидные ткани и органы благодаря специфическим хемокиновым рецепторно-лигандным взаимодействиям (например, CCR2-CCL2, CCR5-CCL5, CCR6-CCL20). Попадая на периферию, эти клетки либо переходят к дифференцировке, либо поддерживают свою популяцию за счет деления.
Воспалительные дендритные клетки в основном мобилизуются в ткани из предшественников в периферической крови при получении сигнала об опасности.
Видимо, они представляют собой не собственно субпопуляцию дендритных клеток, а в большей степени являются их активированной формой. На периферии дифференциированные дендритные клетки накапливаются экстравазально и «обследуют» окружающее пространство на предмет микробной инвазии, будучи в постоянной готовности к захвату антигена. В норме при физиологических условиях подавляющее большинство дендритных клеток находится в незрелом состоянии, что позволяет им эффективно поглощать антигены (например, белки плазмы, компоненты экстрацеллюлярного матрикса, погибшие клетки) с помощью специфических рецепторов (например, лангерин, маннозный рецептор макрофагов, лектиновый рецептор С-типа DEC-205, низкоафинный IgG рецептор CD32/FcyRII, высокоафинный IgE рецептор FceRI, рецептор тромбо-сподина CD36, DC-SIGN), однако не дает им возможности стимулировать необученные Т-клетки.
По всей видимости, дендритные клетки повышают свою эффективность в отношении захвата антигенов за счет постоянного удлинения и сокращения отростков в межклеточных пространствах (dSEARCH—dendrite surveillance extension and retracting cycling habitude—«надзор за счет регулярного циклического растяжения и ретракции дендритов»). Поглощение антигенов запускает процесс созревания дендритных клеток, что приводит к их выходу из тканей и зависимому от CCR7 сигналов перемещению в дренирующие лимфатические узлы.
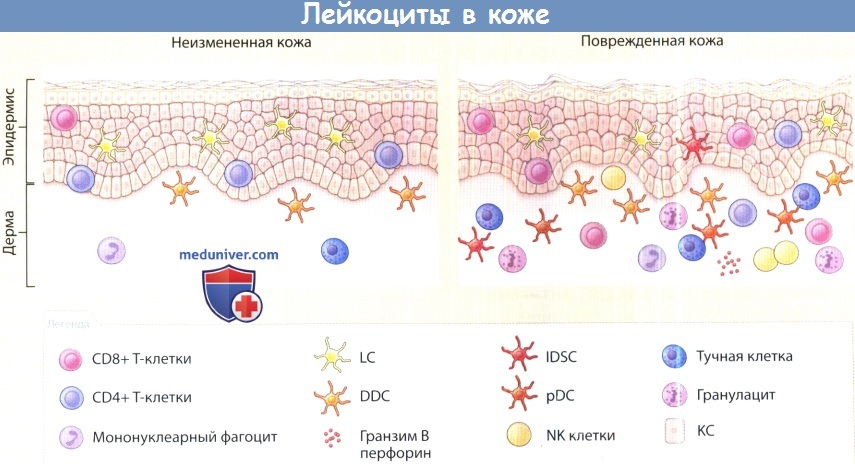
В нормальной коже при гомеостатических условиях постоянно находится лишь ограниченное число лейкоцитов.
Они представлены преимущественно дендритными клетками (клетками Лангерганса в эпидермисе и дермальными дендритными клетками в дерме),
в меньшей степени — Т-клетками эпидермиса (в основном CD8+) и дермы (в основном CD4+),
а также небольшим числом мононуклеарных фагоцитов и тучных клеток.
Гранулациты, естественные киллеры (NK-клетки), В-клетки, воспалительные дендритные клетки практически отсутствуют.
В коже, подвергшейся воздействию экзогенных факторов (например, микроорганизмов, химических раздражителей, ультрафиолетового излучения)
и эндогенных сигналов опасности, активируются такие резидентные клетки, как кератиноциты, и как следствие, они инициируют воспалительный ответ,
обусловленный, прежде всего, циркулирующими лейкоцитами, но вероятно, еще и резидентными лейкоцитами кожи.
КС = кератиноцит; LC = клетки Лангерганса; DDC = дермальные дендритные клетки; pDC = плазмацитоидные дендритные клетки;
IDSC = воспалительные дендритные клетки кожи; NK cell = естественный киллер.
Дендритные клетки перемещаются из нелимфоидных в лимфоидные ткани и в норме, хотя это происходит в ограниченном объеме. Этот процесс значительно интенсифицируется при появлении сигналов опасности. Во время своего путешествия дендритным клетками приходится преодолевать ряд преград, включая сосудистые стенки, соединительную ткань, базальные мембраны, а также другие структурные барьеры. Чтобы реализовать способность к перемещению, дендритные клетки снабжены рядом протеолитических ферментов, например, металлопротеиназами 2 (ММР-2) и 9 типов (ММР-9), которые обеспечивают деградацию белков внеклеточного матрикса.
Миграция дендритных клеток в интерстиции частично контролируется тканевыми ингибиторами металлопротеиназ (tissue inhibitors of metalloproteinases — TIMPs), которые дезактивируют металлопротеиназы (ММР) в физиологических условиях. Однако при созревании дендритных клеток экспрессия TIMP снижается, а функциональная активность металлопротеиназ повышается. Как продемонстрировали выполненные в условиях in vivo с применением двухфотонной прижизненно микроскопии исследования паховых лимфатических узлов мышей. В лимфатических узлах отростки дендритных клеток быстро удлиняются с целью установления непосредственных контактов с прилежащими Т-клетками. Экспозиция на поверхности дендритных клеток МНС-пептидных комплексов является «первым сигналом» Т-клеткам, вслед за которым начинается активное взаимодействие, т.е., активируется Т-клеточный антигенный рецептор (TCR) за счет комплекса пептид-МНС антиген-представляющих клеток. Активированные дендритные клетки обнаруживают усиленную и пролонгированную (по сравнению с неактивированным состоянием антиген-представляющих клеток) экспрессию на поверхности МНСП.
Хотя этого может быть достаточно для индукции пролиферации примированных антигеном (подготовленных) Т-клеток, этого недостаточно для эффективной активации необученных Т-клеток. Появление последних возможно только при получении «вторичных сигналов», которые также доставляются профессиональными антиген-представляющими клетками. Фактически антиген-специфические Т-клетки, которые сталкиваются с экспрессирующими МНС клетками, не способными подавать вторичные сигналы (например, индуцированными кератиноцитами II класса, эндотелиальными клетками, фибробластами), впадают в состояние анергии. Вторичные сигналы, к которым относятся секретируемые цитокины и связанные с мембраной костимулирующие молекулы, детерминируют интенсивность и качество первичных и вторичных Т-клеточных реакций. В результате контакта с цитокинами дендритных клеток, например ИЛ-12, Т-клетки превращаются в клетки, вырабатывающие 1 IFN-y, тогда как вырабатываемый дендритными клетками ИЛ-23 может направить Т-клеточные реакции по линии 17 типа (см. раздел «Функциональные возможности»).
При возникновении угрозы дендритные клетки вырабатывают ряд дополнительных цитокинов, включая ИЛ-1β, TNF-a, TGF-β, ИЛ-6, которые способны придавать определенное направление Т-клеточным реакциям. Выработка костимулирую-щих дендритные клетки молекул нарастает в процессе их созревания, индуцированного поверхностными рецепторами, в свою очередь, активированными лигандами, которые вырабатываются или презентируются другими соматическими клетками или микробными антигенами (сигналы опасности). Две наиболее изученные костимулирующие молекулы — это представители семейства В7 (B7.1/CD80 и B7.2/CD86). Клетки Лангерганса и дендритные клетки in situ такие костимулирующие молекулы не вырабатывают (или вырабатывают их в минимальных количествах), однако обладают выраженной способностью стимулировать их выработку в процессе созревания. К костимулирующим молекулам также относятся ICAM-1, связывающиеся с LFA-1, а также LFA-3, являющиеся лигандом CD2 Т-клеток. Другими важными лигандно-рецепторными парами, которые усиливают активацию Т-клеток дендритными клетками, являются термостойкий антиген CD24/CD24L, CD40/CD40L, CD70/CD27L, 0X40 (CD 134) /OX40L, а также активатор рецептора ядерного фактора кВ (RANK)/RANKL.
Еще одной крайне важной костимулирующей молекулой является мембраносвязывающий гликопротеин CD83. Ее выработка резко повышается при созревании дендритных клеток и усиливает пролиферацию CD8+Т-клеток за счет связывания с пока еще неизвестным лигандом на Т-клетках, экспрессия которого зависит исключительно от опосредованной CD28 костимуляции.
Согласно последним данным дендритные клетки и клетки Лангерганса сами по себе способны индуцировать иммунную толерантность. Основной механизм поддержания иммунной толерантности — это уничтожение Т-клеток высоко аффинными комплексами аутопептид/MITC в тимусе за счет индукции апоптоза (негативная селекция). Еще один способ формирования толерантности — анергия Т-клетки, индуцированная контактом с антиген-представляющей клеткой, не подающей вторичных сигналов. Наконец, дендритные клетки, по крайней мере, в незрелой форме, преимущественно активирует T-reg клетки. Если антиген контактирует с этими неактивированными дендритными клетками in vivo, возникает антиген-специфическая гипореактивность. Эти данные являются значимыми в плане терапевтических перспектив в отношении аутоиммунных заболеваний.
Механизмы, ответственные за индукцию толерантности неактивированных дендритных клеток, хотя и недостаточно изучены, однако включают:
(1) снижение экспрессии комплексов МНС-антиген и костимулирующих молекул на поверхности клеток;
(2) экспрессию коингибирующих рецеторы лигандов, например, программирующего клеточную смерть лиганда 1 (PDL1/В7-Н1) и в меньшей степени PD-L2 (B7-DC);
(3) секрецию иммуносупрессивных цитокинов, например, ИЛ-10, который при УФ-излучении является маркером индукции Т reg клеток, вырабатывающих ИЛ-10s;
(4) экспрессию иммуноингибирующих ферментов, например, индолеамина-2,3-диоксигеназы;
(5) получение сигналов, препятствующих созреванию и миграции дендритных клеток, например, под действием таких нейропептидов, как CGRP271 и вазоактивного интестинального пептида, или в результате запуска каскада белка-переносчика сигнала CD47/SHPS-1.
По всей видимости, эти различные механизмы не равнозначны в различных условиях. Например, клетки Лангерганса, с одной стороны, могут активировать находящиеся в покое аутоантиген-специфические CD8 Т-клетки, что приводит к развитию хронического кожного заболевания, однако с другой стороны клетки Лангерганса не вовлечены или даже могут блокировать индукцию контактной гиперчувствительности.
Дендритные клетки кожи в норме и при патологии. В коже человека при физиологических условиях обнаруживается несколько видов антигенпредставляющих клеток, включая клетки Лангерганса и кожные дендритные клетки. Клетки Лангерганса и кожные дендритные клетки относятся к лейкоцитам негативной линии дифференцировки (lineage-negative — Lin ), образующимся в костном мозге, которые фенотипически и функционально напоминают другие дендритные клетки, присутствующие в большинстве, если не во всех, лимфоидных и нелимфоидных тканях. Будучи первой линией обороны иммунной системы, эти клетки контролируют ответ на нарушения тканевого/кожного гомеостаза. У других видов животных, например, у мышей недавно были обнаружены дополнительные субпопуляции дендритных клеток, а именно CD103+CD207+, которые у человека пока не идентифицированы.
В здоровой коже также содержатся другие клетки, которые, по крайней мере, теоретически, могут содействовать выполнению антиген-представляющих функций, например, базофилы и мастоциты. Тогда как эти клетки способны играть некоторую роль в модуляции кожных иммунных реакций, их функции как антигенпредставляющих клеток требуют дальнейшего изучения. При воспалительных процессах в коже появляются подтипы дентритных клеток, которые в физиологических условиях в ней отсутствуют. К ним относятся клетки плазмоцитоидной линии, так называемые плазмоцитоидные дендритные клетки (pDC) и воспалительные кожные дендритные клетки (IDSC), которые развиваются из миелоидных предшественников и фенотипически похожи на миелоидные дендритные клетки (mDC) периферической крови.
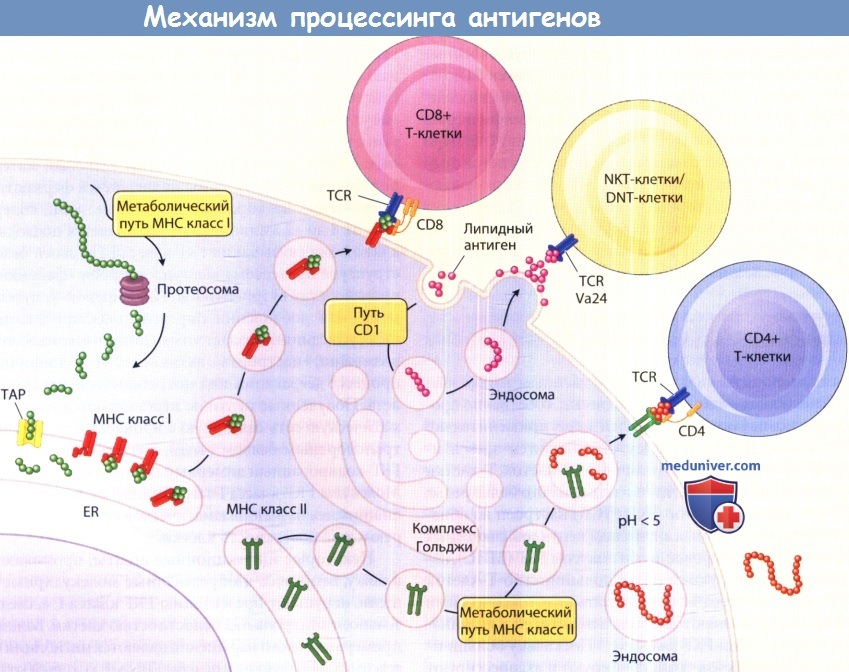
Внутриклеточные механизмы процессинга антигенов для главного комплекса гистосовместимости (ГКГ) класса I.
Механизм ГКГ класса I предполагает процессинг цитоплазматических белков, в то время как механизм ГКГ класса II включает процессинг экзогенных белков.
Путь CD1 регулирует процессинг и презентацию ауто-гликосфинголипидов и бактериальных липогликанов.
DNTcell=дважды отрицательная клетка (CD4-/CD8-); ER = эндоплазматическая сеть;
МНС=лизосомальный участок загрузки пептидов ГКГ класса II; NKT-cell = естественная киллерная Т-клетка;
ТАР = транспортный белок (транспортер), ассоциированный с процессингом антигенов; TCR=Т-клеточный рецептор.
- Рекомендуем далее ознакомиться со статьей "Клетки Лангерганса как антигенпредставляющие клетки кожи"
Оглавление темы "Иммунология кожи.":- Регуляторные Т-клетки кожи (Treg-клетки)
- Фолликулярные Т-хелперы (Tfh-клетки) кожи
- Лимфоциты кожи в норме и при болезни
- Хоуминг Т-клеток памяти в коже
- Принципы представления антигенов антигенпредставляющими клетками кожи
- Дендритные клетки как антигенпредставляющие клетки кожи
- Клетки Лангерганса как антигенпредставляющие клетки кожи
- Дендритные клетки дермы как антигенпредставляющие клетки
- Определение и функции цитокинов кожи
- Классификация цитокинов кожи

