Дендритные клетки дермы как антигенпредставляющие клетки
Аналогично резидентным клеткам Лангерганса в эпидермисе, дендритные клетки дермы представляют собой еще одну субпопуляцию резидентных дендритных клеток, обнаруживаемых в коже в норме и при воспалении, ответственных за активацию иммунной системы при поступлении сигналов опасности.
Исходно обнаруженные в области поверхностного сосудистого сплетения дендритные клетки дермы идентифицируются по экспрессии на их поверхности CD1b, CD1c (BDCA-1), CD11c, CD36, CD205, МНСII, а также субъединицы А фактора свертываемости XIII (FXIIIa). Они отличаются от клеток Лангерганса отсутствием экспрессии лангерина и гранул Бирбека. В соответствии с реакцией на FXIIIa дендритные клетки дермы, полученные из моноклеточных дермальных суспензий, исходно классифицировались на три различных подтипа: (1) CDla/ CD14-, (2) CD1a-/CD14-, (3) CD1a-/CD14+.
Множество исследований, проведенных с дендритными клетками дермы в последние годы, показали, что они обладают функциональной активностью, как макрофагов, так и дендритных клеток, т.е. с одной стороны, способны к эффективному фагоцитозу, а с другой стороны, могут представлять антигены, мигрировать и стимулировать Т-клетки.
Клетки Лангерганса и дендритные клетки дермы: роль в иммунитете кожи. В чем же функция клеток Лангерганса/дендритных клеток дермы при физиологических условиях? Существует ли естественное перемещение клеток Лангерганса/дендритных клеток дермы в рег ионарные лимфатические узлы? Если существует, то каковы последствия этого явления?
Имеются данные, что гранулы меланина, захваченные в коже, накапливаются только в регионарных лимфатических узлах, но не в других тканях. Дальнейшие исследования, обнаружившие крайне незначительное число клеток, содержащих гранулы меланина у TGF-β1- /- мышей, позволяют предполагать, что в физиологических условиях, эпидермальные и/или дермальные антигены переносятся в регионарные лимфатические узлы только TGF-β1 -зависимыми Т-клетками (скорее всего клетками Лангерганса/дендритными клетками дермы). Видимо, Т-лимфоциты, сталкивающиеся с такими антиген-представляющими клетками в условиях in vivo, приходят в состояние ареактивности в отношении специфического антигена.
Поэтому можно допустить, что незрелые резидентные кожные дендритные клетки, т.е. клетки Лангерганса и дендритные клетки дермы обладают способностью вызывать иммунную толерантность, ингибируя воспалительные Т-клеточные реакции в физиологических условиях, и следовательно, отсутствие патологического Т-клеточного аутоиммуного ответа и/или ареактивность в отношении безобидных средовых факторов (например, аэроаллергенов) на периферии первично является в большей степени следствием активных иммунных процессов, чем результатом их полного отсутствия. В последние несколько лет велась жаркая дискуссия об относительной сенсибилизирующей активности клеток Лангерганса по сравнению с дендритными клетками дермы в случае ассоциированных с кожей иммунных реакций.
Эта дискуссия была инициирована вследствие противоречивых результатов исследований, посвященных изучению различных линий лишенных клеток Лангерганса мышей, подвергавшихся воздействию контактных аллергенов.
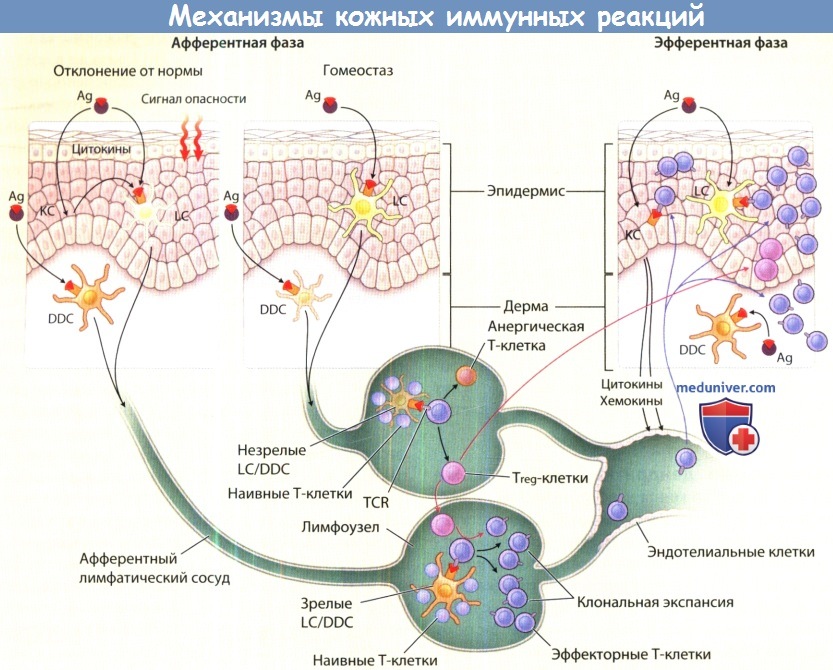
Индукция продуктивного Т-иммунитета кожи: накожное и внутрикожное появление de novo антигенов (то есть патогенов, таких как микроорганизмы и гаптены)
приводит к возбуждению продуктивного антиген-специфического иммунитета, когда в момент экспозиции антигена появляются «сигналы опасности»
(то есть бактериальная ДНК, с многочисленными повторами неметилированного цитозин-фосфат-гуанина и другими лигандами толл-подобных рецепторов).
Получение сигналов опасности приводит к изменениям в тканях, о чем свидетельствует увеличение секреции колониестимулирующего фактора гранулоцитов-макрофагов,
фактора некроза опухоли-альфа и интерлейкина 1 (ИЛ-1) в кератиноцитах (КС) и других клетках кожи.
Антиген-презентирующие клетки (АПК) [клетки Лангерганса (LC), дермальные дендритные клетки (DDC)],
которые захватывают антиген, перерабатывают его и повторно экспрессируют на своей поверхности полученный продукт в форме «пептид- главный комплекс гистосовметимости (МНС)»,
также подвергаются значительному воздействию сигналов опасности или индуцированных этими сигналами цитокинов.
Изменения LC/DDC включают повышенную экспрессию антигенов МНС, костимулирующих молекул и цитокинов (ИЛ-β1, ИЛ-6, ИЛ-12),
а также усиленную миграцию этих клеток из кожи к паракортикальным зонам дренирующих лимфоузлов.
На этом участке дендритные клетки кожи (DC) поставляют активационные стимулы наивным покоящимся Т-клеткам.
Это происходит антиген-специфическим образом и приводит к экспансии соответствующего клона (или клонов).
Эти премированные клетки начинают экспрессировать хоуминговые рецепторы кожи (например, CLA),
а также рецепторы для различных хемоаттрактантов, способствующих прикреплению этих клеток к эндотелиальным клеткам дермальных микрососудов воспаленной кожи и, в итоге, их попаданию в эту ткань.
Возбуждение опосредованного Т-клетками тканевого воспаления и защита от патогена:
при получении повторного антигенного стимула кожными АРС (LC, DDC) премированные хоуминговые Т-клетки кожи распространяются локально и выполняют эффекторные функции,
необходимые для элиминации или, как минимум, атаки на патоген. Напротив, премированные Т-клетки могут столкнуться с антигеном на поверхности «непрофессиональных» АРС
(например, кератиноцитов, несущих МНС класса II) — ситуация, приводящая к клональной Т-клеточной анергии.
Ингибиция и предупреждение Т-клеточного иммунитета: в отсутствии сигналов опасности (тканевый гомеостаз) загруженные антигеном LC/DDC покидают кожу и мигрируют по направлению к дренирующему лимфоузлу.
Эти клетки или резидентные дендритные клетки (DC) лимфоузла, захватившие антигенные структуры из афферентных лимфатических сосудов, представляют этот антиген непродуктивным образом, то есть они индуцируют антиген-специфичную Т-клеточную пассивность или разрешают дифференцировку реагирующих Т-клеток в иммуносупрессивные Т-регуляторные клетки.
Последние могут ограничивать вызванную антигеном клональную экспансию Т-клеток в ходе первичных иммунных реакций в лимфоузлах и в ходе вторичных иммунных реакций периферической ткани.
Эти явления приводят к ингибиции как желаемого (противоопухолевого, противомикробного), так и нежелательного (гаптен-специфического, ауто-реактивного) иммунных ответов.
Ад = антиген; Т= наивная Т-клетка; Т* = анергическая Т-клетка; ТСЯ = Т-клеточный рецептор; Т reg = регуляторные Т-клетки; EMT cells = эффекторные Т-клетки памяти.
Воспалительные дендритные клетки
Дендритные клетки, встречающиеся в воспаленной коже, можно разделить на две основные субпопуляции: (1) воспалительные дендритные эпидермальные/дермальные клетки (IDECs/IDDCs и (2) плазмоцитоидные дендритные клетки (pDCs). Первые далее будут обозначаться как воспалительные дендритные клетки кожи (IDSCs).
Воспалительные дендритные клетки кожи (IDSC). До сих пор до конца неясно, являются ли воспалительные дендритные клетки кожи подвидом миелоидных дендритных клеток, которые под действием сигналов опасности перемещаются в очаги воспаления из крови, или же речь идет о местных дендритных клетках дермы, превращающихся в специализированные IDSC, способные изменять свою функцию в зависимости от типа сигнала опасности. В подтверждение идеи циркулирующих предшественников дендритных клеток, инфильтрирующих кожу при поступлении сигналов опасности, были идентифицированы возможные прекурсоры — предендритные клетки (pre-DCs) или гематопоэтические клетки прекурсоры
Различными научно-исследовательскими коллективами проделана большая работа по идентификации и описанию популяций эпидермальных и/или дермальных воспалительных дендритных клеток при различных кожных заболеваниях. В дерме под высыпаниями при псориазе число CD11c+ дендритных клеток в 30 раз выше, чем в нормальной коже. В отличие от дендритных клеток дермы, обнаруживаемых в норме, эти дермальные CD11с+ дендритные клетки относятся к CD1с-, однако вырабатывают ряд провоспалительных цитокинов (например, TNF-a) и индуцируемую синтазу оксида азота (iNOS). Поэтому эти клетки обозначаются TIP-DCs (продуцирующие TNF-a и iNOS дендритные клетки).
Изначально обнаруженные в 2003 г. у мышей на модели инфекции Listeria monocytogenes, эти клетки позднее были выявлены в собственной пластинке кишки человека, а также в базальной карциноме человека, отвечающей на терапию имиквимодом. Имиквимод и другие имидазохинолины, будучи лигандами TLR7/8, индуцируют мощную воспалительную реакцию и, кроме того, приводят к обратному развитию вирусных акантом и других поверхностных кожных новообразований. В процессе лечения TIP-DC в изобилии определяются вокруг регрессирующих островков опухолевых клеток. При этом они способны экспрессировать молекулы, обладающие литической активностью, например, перфорин, гранзим В, TRAIL, с чем предположительно связана их цитотоксическая активность.
При псориазе TIP-DC способны запускать превращение Т-клеток в Тh1 и Тh17, а также в «гибрид» клеток Тh1/Тh17, которые могут одновременно вырабатывать IFN-γ и ИЛ-17325. Считается, что этот механизм играет значимую роль в патогенезе заболевания. Кроме того, их патогенетическая роль подтверждается снижением выработки TNF-a, iNOS, и других свойственных этим клеткам цитокинов, включая ИЛ-20 и ИЛ-23, при эффективном лечении псориаза. В недавно выполненных работах на дендритных клетках CD11c+CD1c TIP-DCs при псориазе обнаружен ФНО-связанный апоптоз-индуцирующий лиганд (TRAIL), что позволяет предполагать провоспалительные цитотоксические взаимодействия с кератиноцитами, экспрессирующими рецепторы, активирующие TRAIL (рецептор смерти 4 и рецептор-ловушку 2).
При атопическом дерматите в эпидермисе убедительно доказано появление воспалительных дендритных клеток эпидермиса (IDECs). Они характеризуются экспрессией CD1а, CD1b, CD1с, CD11с, FcεRI, CD23, HLA-DR, CD11b, CD206 (MMR/макрофагальный маннозный рецептор), CD36. В условиях in situ окрашивание костимулирующих молекул на клетках CD1a+ DC кожи при атопическом дерматите показало, что экспрессируют CD80 и CD86 в основном клетки с фенотипом IDEC, тогда как эпидермальные клетки Лангерганса типа Langerin+CD1a+ практически лишены этих молекул. Сигнальный путь CD86 является ключевым для стимулирующей функции IDEC.
Существуют доказательства, что за счет эффекта FcεRI иммунные реакции, запускаемые IDEC, идут в направлении Тh1. В недавно опубликованных работах в дерме в области высыпаний при атопическом дерматите также обнаруживается значительное число клеток Лангерганса типа CDla+CD11c+Langerin-DC. Примечательно, что эти клетки обнаруживают повышение продукции хемокинов CCL17 и CCL18, и таким образом, направляют дифференциацию в направлении Th2. Важно, что эта подгруппа IDSC не вырабатывает iNOS или TNF-a, что согласуется с обнаружением разных подвидов воспалительных дендритных клеток при различных кожных заболеваниях.
Плазмоцитоидные дендритные клетки. Плазмоцитоидные дендритные клетки (pDCs) представляют собой дендритные клетки, характеризующиеся сильно развитым эндоплазматическим ретикулумом, что приводит к формированию плазмоцитарного фенотипа. В функциональном отношении плазмоцитоидные дендритные клетки обладают уникальной способностью вырабатывать в 1000 раз больше естественных интерферонов в ответ на лиганды Толл-подобных рецепторов, чем любые другие мононуклеарные клетки крови. В этой связи речь идет об основном типе интерферон-1 продуцирующих клеток.
- Рекомендуем далее ознакомиться со статьей "Определение и функции цитокинов кожи"
Оглавление темы "Иммунология кожи.":- Регуляторные Т-клетки кожи (Treg-клетки)
- Фолликулярные Т-хелперы (Tfh-клетки) кожи
- Лимфоциты кожи в норме и при болезни
- Хоуминг Т-клеток памяти в коже
- Принципы представления антигенов антигенпредставляющими клетками кожи
- Дендритные клетки как антигенпредставляющие клетки кожи
- Клетки Лангерганса как антигенпредставляющие клетки кожи
- Дендритные клетки дермы как антигенпредставляющие клетки
- Определение и функции цитокинов кожи
- Классификация цитокинов кожи

