Фазы заживления раны на коже
Репарация ран - краткий обзор:
- Острые и хронические раны отличаются друг от друга, но часто сосуществуют.
- В случае острых ран наблюдается последовательная прогрессия от травмы к коагуляции, воспалению, пролиферации, миграции клеток и моделированию ткани.
- В начальных фазах важную роль играют различные факторы роста, в том числе фактор роста тромбоцитов и трансформирующий фактор роста β1. В фазах пролифера-ции/миграции и моделирования решающее значение имеют матричные металлопротеиназы ткани (ММР), интегрины, основной фактор роста фибробластов и фактор роста эндотелия. В процессе ремоделирования определяющими являются ММР-1, ММР-9 и ММР-10.
- Большинство ран заживают быстро, для этого имеется целый спектр различных перевязочных материалов. К ним относятся прозрачные пленки, гидроколлоиды, пенки, алгинаты, гели и коллагеновые продукты.
- Хронические раны отличаются от острых, поскольку направленное в одну сторону соотношение между различными фазами процесса утрачивается. Хронические раны являются комплексным результатом ишемии, давления и инфекции, и их заживление во многом зависит от воздействия на эти факторы.
- Заживление раны в случае кожных трансплантатов также имеет особенности, поскольку полностью зависит от реваскуляризации, будь то неоваскуляризация или анастомоз.
Термины «заживление раны», «репарация раны» или «репарация ткани» часто используются как взаимозаменяемые, однако фактически «заживление» и «репарация» — это две различные последовательности событий с разными результатами. Прежде всего, перед тем как выявлять различие, следует признать довольно очевидный факт, что термины «заживление» и «репарация» применяются не только для кожи, но могут относиться к системе любого органа. Технически, термин «заживление раны» следует применять только в контексте регенерации, когда исходная архитектура и структура органа или анатомического участка полностью восстанавливается такой, какой была до травмы.
Более примитивные животные, такие как малые амфибии и рептилии, все еще способны к такому типу регенерации. Однако по мере того, как животные становились более крупными и сложными, такая регенерация стала невозможной. Человеческий плод все еще в большой мере способен к регенерации (особенно на ранних стадиях), но у взрослых истинной регенерации не происходит, за возможным исключением печени (где, вероятно, имеет место компенсаторное увеличение, а не регенерация). У человека и других высших позвоночных заживление происходит, скорее, в процессе репарации (репарации раны или репарации ткани), причем окончательным результатом будет не истинное анатомическое восстановление, а функциональный компромисс.
Тем не менее, ввиду давно утвердившихся терминов и их применения в опубликованной литературе, даже в рамках предлагаемой нами здесь дискуссии мы можем иногда употреблять термины «заживление» и «репарация» как взаимозаменяемые; с большей спецификой термины будут применяться, когда речь пойдет именно о процессе регенерации тканей.
Тот факт, что у высших позвоночных происходит репарация, а не истинное заживление или регенерация, объясняется, вероятно, эволюционными причинами. С точки зрения телеологии и принципов эволюции, процесс репарации у высших животных должен быть быстрым и экономичным в смысле энергетических затрат, чтобы обеспечить немедленное выживание организма. Однако в силу необходимости репарация приводит к быстрому разрешению травмы и, следовательно, к рубцеванию. Еще одним важным аспектом является то, что большинство эволюционных механизмов репарации раны нацелены на устранение острого повреждения ткани, а не на противодействие хроническим состояниям.
Действительно, с точки зрения эволюции не предполагалось, что у человека будут развиваться дегенеративные заболевания, или, что он будет жить настолько долго, что у него появятся артериальные и венозные язвы, а также пролежни или невропатические язвы вследствие диабета. Следовательно, человек оказался совершенно неподготовленным для таких типов хронических ран, и у него отсутствуют специфические механизмы для эффективного противостояния таким проблемам. Следует отметить, что большое значение имеют размер и глубина травмы. Так, неглубокие раны (например, тангенциальные биопсии), при которых в раневом ложе сохраняются придатки кожи (волосяные фолликулы, потовые железы и т.п.) способны заживать «изнутри», поскольку сохраняются связанные с этими кожными придатками кератиноциты. С другой стороны, в полнослойных ранах (хороший пример: пункционная биопсия) нельзя рассчитывать на миграцию и пролиферацию кератиноцитов с краев раны.
Неудивительно, что полнослойные раны ассоциируются с замедленным заживлением и более выраженным рубцеванием. Модели на животных, особенно с избыточной экспрессией или отсутствием некоторых генов, позволяют лучше понять роль некоторых белков и медиаторов. Нарушение заживления ран обнаруживают у мышей с комбинированным дефицитом молекул, играющих решающую роль при воспалении (Е- и Р-селектины) и у мышей с отсутствием плазминогена, uPA и tPA (нокаутных по двум генам), фактора роста фибробластов 2 (bFGF) или индуцируемого оксида азота. С другой стороны, нарушение или замедление заживления происходит в трансгенных мышах с избыточной экспрессией некоторых матричных металлопротеиназ (ММР1) и антисенса к CD44, рецептору гиалуроновой кислоты. Некоторые индуцированные мутации приводят к ускоренному заживлению, о чем сообщалось у мышей, нокаутных по Smad-3 или skin-1а. В будущем эти данные можно будет использовать для стимуляции процесса заживления у человека.
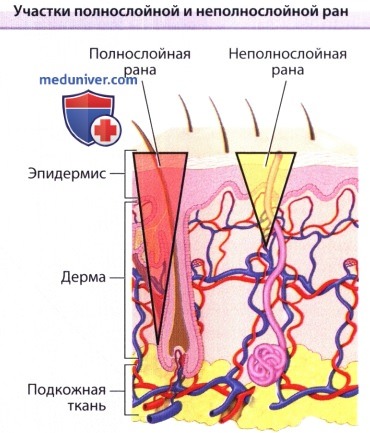
Распространение травмы ниже резервуара кератиноцитов в придатках кожи (полнослойная рана) не позволяет кератиноцитам «заселить» дефект с раневого ложа;
заживление осуществляется с краев раны и происходит более выраженное рубцевание.
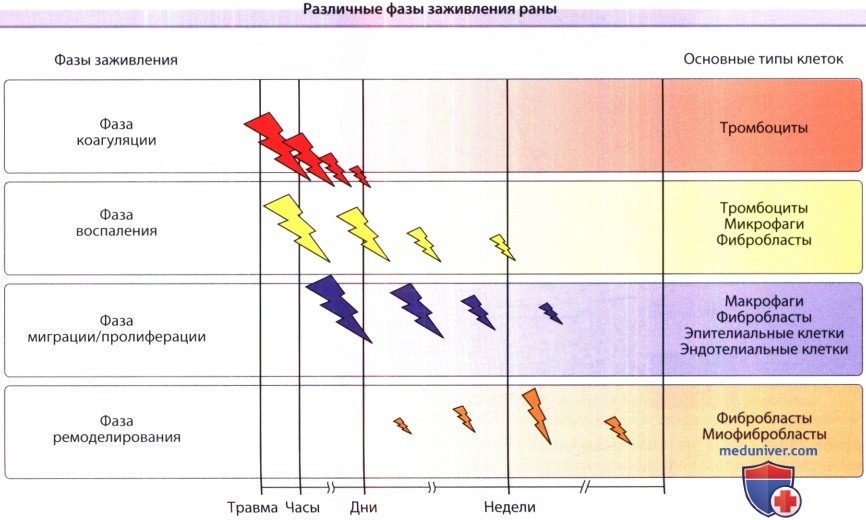
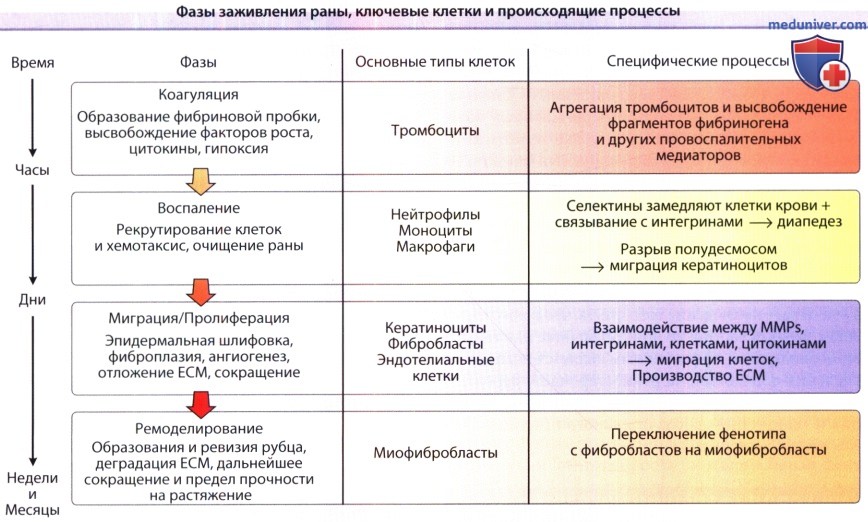
а) Фазы заживления раны. В целом, различают четыре фазы, которые характерны для процесса репарации кожи: (1) коагуляция, (2) фаза воспаления, (3) фаза пролиферации/миграции (формирование ткани) и (4) фаза ремоделирования. Фазы коагуляции и воспаления часто объединяют в одну, поскольку совпадение высвобождаемых в этих фазах медиаторов довольно значительное. На рисунке ниже эти фазы заживления представлены последовательно, в схематической форме, а на рисунке ниже представлены специфические процессы, которые происходят во время этих различных фаз. Далее мы обсудим эти фазы и определим основные компоненты и процессы, которые для них характерны.
Основными типами клеток, принимающих участие в заживлении ран, считаются тромбоциты, нейтрофилы, макрофаги, фибробласты, эндотелиальные и эпителиальные клетки. Все большее значение придается роли лимфоцитов, как прямой, так и косвенной. Однако следует отметить, что разбивка общего процесса заживления раны на эти, казалось бы, четко определенные фазы является искусственной, поскольку они в значительной мере накладываются друг на друга. Нельзя забывать также, что эти фазы и гипотеза об их участии в заживлении раны были предложены в ходе экспериментов на лабораторных животных; предполагается, что такие же процессы участвуют в репарации тканей человека.
1. Фаза воспаления и коагуляция в заживлении раны. Хотя мы представили эти две фазы как отдельные, степень их совпадения такова, что будет правильным обсуждать их в совокупности. Ранние фазы коагуляции и воспаления начинаются сразу после травмы. Разрыв кровеносных сосудов приводит к местному высвобождению клеток и элементов крови, что вызывает образование кровяных сгустков. В то время как кровяной сгусток в просвете сосуда обеспечивает гемостаз, сгусток в месте травмы действует как временный матрикс для миграции клеток, дальнейшего образования нового внеклеточного матрикса (ВКМ), и резервуара для цитокинов и факторов роста. Доминирующим компонентом в этой фазе первоначально является тромбоцит, который управляет свертыванием крови в свежей ране изнутри и извне. Тромбоциты высвобождают также ряд хемотактических факторов, которые привлекают другие тромбоциты, лейкоциты и фибробласты к месту травмы.
Лейкоциты задерживаются в кровотоке, благодаря экспрессии селектинов, которые в связи с интегринами доставляют белые воспалительные клетки в рану. У этих клеток несколько ролей, в том числе очистка раны от некротического материала и бактерий, а также выработка некоторых важных цитокинов. Примером служит производство воспалительными клетками и экспрессия в ранах фактора роста соединительной ткани. Через несколько первых дней нейтрофилы уничтожаются макрофагами.
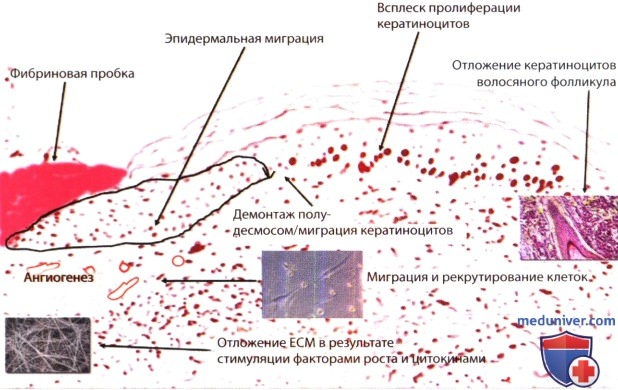
На рисунке ниже схематически, на примере тканевого среза, представлены процессы, происходящие после травмы. Фибриновая пробка, возникающая в результате травмы, обеспечивает временное закрытие раны и состоит из тромбоцитов, вкрапленных в сложное переплетение из преимущественно полимеризированного фибриногена (фибрина), фибронектина, витронектина и тромбоспондина. Перекрестное связывание фибрина фактором XIII также является важным, поскольку имеются данные о том, что фибрин в отсутствие перекрестного связывания нарушает функцию и, вероятно, миграцию кератиноцитов. По мере немедленного скопления тромбоциты высвобождают широкий спектр факторов роста, в том числе фактор роста тромбоцитов (PDFG) и трансформирующий фактор роста-β1 (TGF-β1). Фактически тромбоциты являются основным местом хранения изоформы TGF-β1. В окружающих острую рану тканях с характерной гипоксией, протеазы и низкий уровень pH способствуют активации этих факторов роста.
Основные медиаторы служат источниками других медиаторов посредством фрагментации или полимеризации. Классическим примером являются хемотактические фибринопептиды А и В, образующиеся после действия тромбина на фибриноген. Еще одним примером является образование брадикининов, а также С3а и С5а, которые активируются фактором Хагемана.
По мере дальнейшего действия воспалительного компонента ранней фазы, в течение 24-48 часов после травмы моноциты замещают нейтрофилы и становятся доминирующим типом лейкоцитов. Моноциты привлекаются к месту травмы некоторыми из тех хемоатрактантов, которые ответственны также за рекрутирование нейтрофилов, в частности калликреином, фибринопептидами и продуктами разложения фибрина. Другие, более специфические хемоаттрактанты принимают затем на себя обязанность рекрутировать моноциты, к ним относятся фрагменты коллагена, фибронектин, эластин и TGF-β1. Моноциты меняют свой фенотип на тканевые макрофаги и, в отличие от нейтрофилов, играют важную роль в продолжении процесса заживления раны. Макрофаги осуществляют фагоцитоз, убивают бактерии и устраняют клеточный «мусор». Они также высвобождают некоторые факторы роста, в том числе PDGF, FCF и TGF-β1, стимулируя таким образом миграцию и пролиферацию фибробластов, а также выработку и модуляцию внеклеточного матрикса. Макрофаг обычно считается главной клеткой в процессе заживления раны.
Однако это слишком упрощенное представление, поскольку важно учитывать, что задерживает или нарушает заживление не столько наличие или отсутствие воспаления и определенных клеток, сколько неадекватная воспалительная реакция. Имеются, например, данные о том, что заживление может происходить в отсутствие воспалительного инфильтрата. Кроме того, эксперименты на мышах, у которых конституционально экспрессирован хемотактический цитокин, интерферон-индуцируемый протеин 10, показывают, что интенсивный воспалительный инфильтрат может нарушить неоваскуляризацию и формирование соответствующей грануляционной ткани. Следовательно, истинная роль воспаления в репарации ткани, с экспериментальной точки зрения, представляется несколько противоречивой. Клинический подход учитывает наблюдение того факта, что в некоторых кожных ранах, в частности при пузырчатке или гангренозной пиодермии, эффективным является подавление воспаления с помощью кортикостероидов. Вероятно, в некоторых клинических ситуациях помогают модуляция и «коррекция» воспалительного ответа посредством кортикостероидов.
2. Фазы пролиферации/миграции и ремоделирования. Нa рисунке ниже представлены фибриновая пробка и некоторые процессы, происходящие в течение двух следующих фаз заживления: пролиферативной/миграционной фазы и фазы ремоделирования. Поскольку воспаление уже сыграло свою ведущую роль сразу после травмы, самым важным событием в заживлении кожной раны на данном этапе становится реэпителизация. Это решающее событие связано не только с одними керати-ноцитами, поскольку существует сильная взаимозависимость между перемещением кератиноцитов через временный фибриновый матрикс, привлечением фибробластов и эндотелиальных клеток и образованием внеклеточного матрикса. Матричные металлопротеиназы (MMPs) и другие ферменты (tPA и uРА) играют важную роль в движении клеток через структурные компоненты временного матрикса, а также в освобождении кератиноцитов на краях раны от прикрепляющих их полудесмосом и десмосом. Еще одной важной группой молекул, которые помогают руководить этими миграционными компонентами, являются интегрины.
Интегрины, состоящие как минимум из 24 αβ гетеродимеров (18α и 8β субъединиц), являются трансмембранными рецепторами клеточной поверхности, которые связывают ЕСМ с цитоскелетными структурами. Профиль интегринов в процессе репарации очень динамичен. Например, фибробласты дермы переключаются с субъединиц интегринов α2 на субъединицы α3 и α5. Еще одним примером служит тот факт, что эндотелиальные клетки не могут реагировать на ангиогенные стимулы без экспрессии интегрина αvβ5. Факторы роста некоторых полипептидов исключительно важны для ангиогенеза, в том числе фактор bFGF и фактор роста сосудистого эндотелия (VEGF). В таблице ниже приведены некоторые основные цитокины и факторы роста, важные для процесса репарации. Нужно учитывать, что такие таблицы очень упрощенно представляют сложные биологические свойства этих полипептидов. Отмечены только их основные эффекты, но следует иметь в виду, что функции факторов роста часто зависят от специфического контекста и не всегда одинаковы в каждой биологической ситуации.
Низкое давление кислорода является важным ранним стимулом для активации фибробластов и эндотелитальных клеток. Репликация и продолжительность жизни фибробластов возрастают при гипоксии, и низкое давление кислорода стимулирует клональную экспансию дермальных фибробластов, рассеянных единичными клетками. Более того, синтез ряда факторов роста в гипоксийных клетках усиливается. Макрофаги секретируют ангиогенное вещество, только будучи подверженными низкому кислородному давлению. Этот обратимый эффект наблюдался при давлении кислорода 15-20 мм рт.ст. Транскрипция TGF-β1 и синтез пептидов в культуре дермальных фибробластов человека возрастают под влиянием сходного уровня гипоксии. Кроме того, гипоксия стимулирует синтез эндотелина-1, PDGFβ-цепи и VEGF в эндотелиальных клетках. Представляется, что, как минимум, в некоторых случаях эффект состояния гипоксии опосредуется индуцируемым при гипоксии фактором-1, ДНК-связывающим комплексом, который содержит как минимум 2 белка суперсемейства bHLH-PAS (включающих основной домен «спираль петля спираль» и PAS-домен).
Важность полудесмосом и десмосом хорошо известна на примере многих дерматологических заболеваний, при которых нарушается общая целостность этих структур (например, при пузырчатке, буллезном пемфигоиде, буллезном эпидермолизе). Однако в условиях процесса заживления, когда должна произойти миграция кератиноцитов, возникает необходимость «разорвать» эти комплексные структуры, скрепляющие базальные кератиноциты с базальной мембраной и соседними кератиноцитами. Этот процесс «разрыва» такой же сложный, как и сама структура, и включает взаимодействия между матричными металлопротеиназами (ММР), интегринами, факторами роста и структурными белками. В нормальной фазе покоя ламинин-5 связан с интегрином α6β4, который связывает внутриклеточные филаменты кератинов с базальной мембраной. В большой мере благодаря взаимодействиям итегринов (в том числе в статусе фосфорилирования) с внеклеточным матриксом (ЕСМ) и рецепторами на поверхности кератиноцитов, происходят важные морфологические изменения (такие как образование ламеллиподий), необходимые для перемещения кратиноцитов.
При этом участвуют молекулярные GTP-азные переключения (Rho, Rac, CDc42). Частично в результате фосфорилирования интегрина α6β4, интегрин α3β1, способствует образованию ламеллиподий и перемещению кератиноцитов. Неоднократно указывалось на то, что миграция кератиноцитов является ключом к поверхностному ремоделированию раны и что фактически такое ремоделирование не зависит от пролиферации. В целом, следует добавить, что эпителиально-мезенхимальный переход (ЕМТ), важный также при раке, для адгезии эпителия и приобретения мезенхимальных признаков, лишает эпителиальные клетки способности мигрировать таким путем, который похож на эмбриональную стадию. Недавно этот процесс реконструировали in vitro, воздействуя на фактор некроза опухоли-α (ФНО-α), что привело к экспрессии виментина, FSP1 и ММР. ЕМТ, опосредуемый фактором ФНО-α, может быть результатом воздействия костных морфогенетических белков (BMP).
Кроме критической роли миграции, кератиноциты все-таки пролиферируют в первые часы после травмы и это, конечно, более заметно, если разрывы ли размер дефекта невозможно временно перекрыть только перемещением клеток, и он зависит от клеток, расположенных за его пределами. К концу первой недели после травмы процесс репарации значительно продвигается. Цитокины и факторы роста (эпидермальный фактор роста, PDFG, TGF-β, факторы FGF и VEGF), компоненты матрикса и ММР продолжают играть активную роль. Например, некоторые киназы (МАРК) активируются в базальных и надбазальных кератиноцитах посредством дальнейшего действия интегринов или высвобождения интерлейкина-1α. Приток ионов, в том числе кальция, и их поступление в клетку также имеют большое значение для общего процесса миграции кератиноцитов и ремоделирования поверхности кожи. Имеются данные о том, что кроме распространения ламеллиподий, надбазальные кератиноциты с краев раны могут «перепрыгивать» через базальные клетки вблизи раны. Однако такая система не может быть очень эффективной, тем более до такой степени, чтобы сработал механизм по типу «затягивания кисета» («purse-string») как при эмбриональном заживлении, с другими важными особенностями в накоплении матрикса и профиле факторов роста. В экспериментах с нокаутными мышами, в миграции кератиноцитов, ангиогенезе и процессах сокращения участвует ММР-13, в то время как ММР-9 играет важную роль в миграции кератиноцитов.
Ремоделирование внеклеточного матрикса (ЕСМ), а также перемещение клеток во многом зависит от ММР и сериновых протеаз. Очень важным компонентом этой зависимости от матричных металлопротеиназ (MMPs) является индуцируемая ими деградация ЕСМ и последующее воздействие селективных биоактивных сегментов ЕСМ, которые влияют на поведение клеток, в том числе миграцию и пролиферацию. Фаза ремоделирования начинается через 5-7 дней после травмы. Важную роль в миграции кератиноцитов играет стимуляция tPA и uРА, которая зависит от пересечений и взаимодействий между α3β1 кератиноцитами и коллагеном. Эти явления приводят к индукции ММР-1 (коллагеназы-1 или интерстициальной коллагеназы), важной для миграции кератиноцитов и эпителизации. ММР-9 играет важную роль в «разрыве» коллагенов типа IV и типа VII, являющихся важными компонентами базальной мембраны и якорных фибрилл, а также способствует воспалению и миграции нейтрофилов. ММР-10 (стромелизин) разрывает другие неколлагеновые компоненты ЕСМ и содействует миграции.
Были обнаружены другие медиаторы, в частности тимозин-β, стимулирующие ММР в ходе репарации раны. Важнейшую роль в процессе ремоделирования играет переключение фенотипа некоторых клеточных субпопуляций с фибробластов на миофибробласты. Следовательно, хотя начальный процесс заживления раны в значительной степени зависит от накопления матрикса, что, в свою очередь, облегчает миграцию клеток, возникает необходимость ослабления формирования ЕСМ и доведения его до уровня, который, как минимум, приближается к состоянию до травмы. Однако фаза ремоделирования представляет собой нечто большее, чем разложение избыточных макромолекул, образовавшихся в пролиферативной фазе заживления раны. Клетки в пределах раны возвращаются к стабильному фенотипу. Материал ЕМС изменяется (например, коллаген типа III меняется на коллаген типа I) и грануляционная ткань, которая была такой обильной на ранних фазах заживления раны, исчезает. В последние несколько лет стали уделять значительное внимание роли стволовых клеток фолликулярного и межфолликулярного эпидермиса в заживлении раны.
На основании данных, полученных на мышиных моделях, сообщалось о том, что, после травмы клетки из сумки волосяного фолликула привлекаются в эпидермис и мигрируют в центр раны. В последующих сериях исследований было показано, что волосяные фолликулы образуются de novo после ранения, и что эпителиальные клетки в ране приобретают фенотип стволовых клеток волосяного фолликула. Некоторые из этих явлений могут зависеть от Wnt-сигнализации.

- Рекомендуем далее ознакомиться со статьей "Внеклеточный матрикс при заживлении раны"
Редактор: Искандер Милевски. Дата публикации: 22.10.2019

