Механизм ативации эозинофил
Как уже обсуждалось выше, активировать эозинофилы способны различные медиаторы воспаления. Кроме цитокинов, ФНО-а, ГМ-КСФ, ИЛ-3 и ИЛ-5, к ним относятся компоненты комплемента СЗа и С5а, липидные медиаторы, лейкотриен С4, фактор активации тромбоцитов, а также лиганды IgA и IgG Fc рецепторов. CD11b/CD18 (Mac-1) -зависимая клеточная адгезия выступает в качестве критического компонента дегрануляции и синтеза активных форм кислорода, индуцированных ГМ-КСФ и фактором активации тромбоцитов.
Вероятно также, что это механизм in vitro, который начинается после контакта эозинофила со стромальными клетками и/или белками. Члены подсемейства хемокинов СС CCL5, CCL7 (МСР-3), CCL11, CCL13 (МСР-4), CCL24, которые связываются с хемокиновым рецептором CCR3, также потенциально могут активировать эозинофилы. В активированных эозинофилах происходит множество фенотипических изменений, включая редукцию гранул, вакуолизацию и увеличение количества цитоплазмы. Это ведет к снижению плотности клеток и делает их гиподенсивными. Число гиподенсивных клеток предопределяет тяжесть аллергического заболевания.
Клеточные маркеры, которые бы позволили точно дифференцировать гиподенсивные клетки от нормоденсивных, до настоящего момента еще не найдены, однако существует несколько маркеров на поверхности клеток, экспрессия которых увеличивается при переходе клеток в гиподенсивное состояние как in vitro, так и in vivo: аМ интегрин (CD11b), αХ интегрин (CD11c), FcγR111 (CD16),рецептор гиалоурановой кислоты (CD44), ICAM-1 (CD54), CD69 и HLA-DR.
После перехода эозинофилов в ткани и активации, там осуществляются многочисленные эффекты, которые были описаны выше. В тканях эозинофилы высвобождают содержимое гранул во внеклеточное пространство по одному из трех возможных механизмов: 1) частичная дегрануляция; 2) регулируемая секреция (также именуемая регулируемым экзоцитозом) и 3) цитолитическая дегрануляция.
При первом механизме (частичной дегрануляции) эозинофилы выборочно высвобождают содержимое специфических гранул, например, активация интефероном-у способствует мобилизации гранулярного CCL5 на поверхность эозинофила без индукции выделения катионных белков. При втором механизме (регулируемая секреция) формируется комплекс, состоящий из рецептора белка, связывающего фактор, чувствительный к растворимому N-этилмалеимиду (SNAREs), расположенному на везикулах (vSNAREs), b таргетных мембран (tSNAREs). Два типа SNAREs белков были дифференцированы в результате идентификации различных консервативных аминокислотных остатков—аргинина (R) или глутамина (Q). Человеческие эозинофилы экспрессируют на цитоплазматических секреторных везикулах R-SNARE, везикул-ассоциированные мембранные белки (VAMP)-2, в то время как на плазматической мембране они синтезируют Q-SNAREs, SNAP-23 и синтаксин-4.
VAMP-7 также играет ключевую роль в высвобождении медиаторов как нейтрофилов, так и эозинофилов.
Согласно современным взглядам, рецептор-индуцированная активация эозинофилов ведет к быстрой мобилизации цитоплазматических везикул на клеточную мембрану, что приводит к образованию SNARE комплекса (VAMP-2,—7/SNAP-23/criHTaKCHH-4) и высвобождению медиатора. Третий механизм (цитолитическая дегрануляция) наблюдается при многих воспалительных заболеваниях, включая такую кожную патологию, как атопических дерматит, а также эозинофильный эзофагит и поражения тканей при гиперэозинофильных синдромах. Данный механизм высвобождения содержимого гранул связан с разрывом органелл, хроматолизисом в ядре, потерей эозинофилами морфологического единства и внешнего вида. Следствием этого является интенсивное выделение гранул и их содержимого в ткани.
С учетом этого выглядит странным, что эозинофилы пациентов с атопическим дерматитом характеризуются повышенной выживаемостью и при этом осуществляют выраженную цитолитическую дегрануляцию в очагах кожных высыпаний. Очевидно, что предстоит еще многое узнать о биологии эозинофилов и их связи с заболеваниями человека.
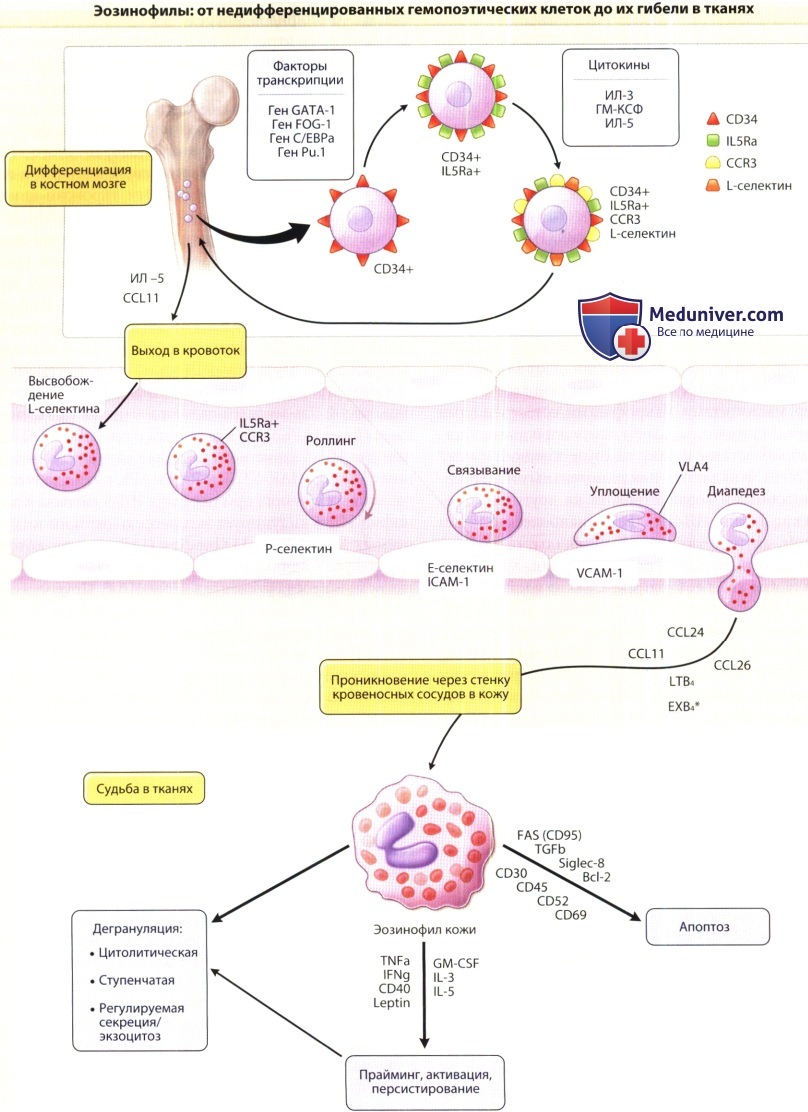
На рисунке представлен жизненный цикл эозинофилов от дифференцировки в костном мозге к трансвазальной миграции и гибели в тканях (приведены ключевые факторы, участвующие в этом процессе).
Фармакологические воздействия на активацию эозинофил
Эозинофил-ассоциированные заболевания — это патология, к которой, строго говоря, относятся лишь те заболевания, при которых количество эозинофилов или уровень белка их гранул (либо каких-либо других продуктов их обмена) коррелируют с активностью заболевания. Этот термин охватывает множество разнообразных заболеваний, включающих кожные, при которых прицельное воздействие на эозинофилы и/или их продукты является терапевтической целью. Многие доступные лекарственные средства (глюкокортикоиды, антагонисты кальциневрина, миелосупрессивные лекарства, ИНФ-а, ИНФ-у, антагонисты лейкотриенов и, вероятно, даже антигистаминные препараты) подавляют эозинофильное воспаление. Тем не менее, никакое из этих заболеваний не является полностью специфичным для эозинофилов.
Только в последние несколько лет были разработаны прицельные и селективные методики терапевтического воздействия на эозинофилы, а эти методы лечения в свою очередь определили открытия в области патогенеза заболеваний.
В ряду неселективных средств, редуцирующих количество эозинофилов, высоко эффективными являются глюкокортикоиды. Немедленное (в течении трех часов) снижение уровня циркулирующих эозинофилов, наблюдаемое после введения глюкокортикоидов, вероятно, происходит из-за секвестрации в экстрамедулярные органы (печень, селезенка, лимфатические узлы), что было установлено на грызунах. Глюкокоротикоиды влияют на проникновение эозинофилов в ткани с помощью четырех механизмов:
(1) секвестрация в лимфиойдные ткани,
(2) индукция апоптоза эозинофилов,
(3) редукция продукции эозинофилов костным мозгом, и
(4) изменения в продукции цитокинов. Хемокины очень важны для регулировки продукции эозинофилов.
Глюкокортикоиды подавляют выработку некоторых цитокинов, важных для индукции адгезии молекул в клетках эндотелия, включая ИЛ-1, ФНО-а, ИЛ-4, ИЛ-13, а также освобождение эозинофил-активирующих хемокинов, таких как CCL5, CCL7, CCL11. К сожалению, у некоторых пациентов развивается «резистентность к стероидам», и длительное применение этих средств ассоциировано с побочными явлениями, ограничивающими их применение.
Механизм развития резистентности к глюкокортикоидам до сих пор не ясен, но вероятно, частично может быть объяснен уменьшением количества глюкокортикостероидных рецепторов, полиморфизмом и изменениями транскрипции фактора активации белка-1 (АР-1). Пациенты, уже обнаружившие резистентность к глюкокортикостероидам или находящиеся в стации ее формирования, нуждаются в другой терапии. Интересно, что лидокаин и препараты сульфонилмочевины (например, глибурид) также ингибируют цитокининдуцированное выживание эозинофилов, имитируя эффекты глюкокортикостероидов, и за счет этого могут иметь клинический антиэозинофильный эффект.
Антагонисты кальция, такие как циклоспорин, такролимус и пимекромус, выраженно ингибируют выработку и высвобождение Т-клеточных цитокинов, в том числе тех, которые индуцируют развитие эозинофильного воспаления (ИЛ-4, ИЛ-5, ГМ-КСФ). Также они уменьшают экспрессию CCL5, CCL11, ИЛ-5, что ассоциировано с уменьшением концентрации эозинофилов в тканях, что было продемонстрировано при атопическом дерматите. Ингибиторы рецепторов рапомицина в молочной железе (mTOR), включающие сам рапомицин, оказывают прямой эффект на эозинофилы, уменьшая выработку белка гранул эозинофилов после активации ИЛ-5. Использование данных терапевтических агентов ограничено их побочными эффектами, включающими иммуносупрессию, а также их метаболическими эффектами, которые могут быть частично детерминированы генетически.
Некоторые миелосупрессивные лекарственные средства, в числе которых гидроксимочевина, сульфат винкристина, циклофосфамид, метотрексат, 6-тиогуанин, 2-хлордезоксиаденозин, а также комбинированная терапия цитарабином, пульс терапия хлорамбуцилом и этопозидом, могут быть эффективны при лечении эозинофил-ассоциированных заболеваний как сами по себе, так и в сочетании со стероидами, что позволяет снизить дозировки последних.Гидроксимочевина особенно эффективна для уменьшения количества циркулирующих эозинофилов.
В случаях миелопролиферативного гиперэозинофильного синдрома (хроническая эозинофильная лейкемия) с мутацией FIP1L1-PDGFRA, которая кодирует тирозинкиназу, иматиниб месилат (ингибитор тирозин-киназы) вызывает быструю, полную или близкую к полной ремиссию и соответственно одобрен для лечения хронической миелогенной лейкемии и гиперэозинофильного синдрома. Пациенты, которые имеют признаки миелопролиферативного гиперэозинофильного синдрома в отсутствие FIP1L1-PDGFRA, также могут отвечать на иматиниб.
Алемтузумаб — моноклональные антитела к CD52, которые используются для блокировки CD52+ лимфоцитов при лечении хронического В-клеточного лимфоцитарного лейкоза и Т-клеточной лимфомы. Эозинофилы (в отличие от нейтрофилов) также вырабатывают CD52, и алемтузумаб обнаружил эффективность при лечении пациентов рефрактерным гиперэозинофильным синдромом, включающим также анормальные Т-клетки, однако такое лечение сопровождалось серьёзными побочными эффектами (цитопения, инфузионные реакции, инфекционные осложнения), ограничивающими применение препарата.
Интерфероны, как интерферон-а, так и интерферон-у, могут быть эффективны при терапии эозинофил-ассоциированных болезней за счет ингибирования процесса дегрануляции эозинофилов и высвобождения провоспалительных медиаторов. Инттерферон-а может лучше переноситься, чем интерферон-у,и используется как средство, способное снизить терапевтические дозы стероидных препаратов, преимущественно у пациентов с лимфоцитарным вариантом гиперэозинофильного синдрома, но также может быть эффективным и при миелопролиферативном варианте гиперэозинофильного синдрома.
- Рекомендуем далее ознакомиться со статьей "История открытия и эпидемиология острого фебрильного нейтрофильного дерматоза (синдрома Свита)"
Оглавление темы "Эозинофилы при болезнях кожи.":- Происхождение и развитие эозинофилов
- Цитокины и сигнальные пути эозинофилов
- Cтруктура эозинофил и состав эозинофильных гранул
- Функции эозинофил и их роль в иммунитете
- Компоненты эозинофил и их функции
- Состав и компоненты кристаллов Шарко-Лейдена эозинофил
- Механизм миграции эозинофил в ткани
- Механизм ативации эозинофил

