Компоненты эозинофил и их функции
Эозинофилы содержат и продуцируют колоссальное количество веществ, которые участвуют в воспалении, деструкции и ремоделировании тканей. В числе выделяемых веществ хемоаттрактанты, колониестимулирующие факторы и эндотелий-активирующие цитокины. Кроме токсичных катионных белков из специфических гранул и окисляющих веществ, которые выделяются в ткань после активации, в число эозинофильных веществ входят и арахидоновые кислоты, гидролитические ферменты, нейропептиды, колониестимулирующие факторы и цитокины/хемокины, облегчающие поступление лейкоцитов в место воспаления.
Экспрессия молекул на поверхности клеток является важной для всех аспектов биологии эозинофилов от обеспечения роста и дифференцировки до проникновения в ткани и последующей деградации, а затем старения. Многочисленные мембранные факторы находятся на поверхности эозинофилов, тем самым опосредуя их прямые биологические эффекты.
а) Белки эозинофильных гранул. К числу наиболее агрессивных в отношении организма хозяина продуктов эозинофилов относятся катионные белки специфических гранул. Более того, белки гранул являются маркерами эозинофильной активности, так как сами эозинофилы часто теряют свою характерную морфологию за счет цитолиза в тканях. Знание биологических эффектов этих белков позволяет узнать больше об их роли в развитии болезней человека. Однажды оказавшись в тканях, белки гранул персистируют там в течение длительного времени: эозинофильная пероксидаза в течение одной недели, эозинофильный катионные белок в течение двух недель, эозинофильный нейротоксин две с половиной недели, а главный основный белок до шести недель. Была продемонстрирована способность каждого из этих трех белков вызывать повреждение как клеток ткани хозяина, таких как миоциты, эндотелий, нейроны, эпителий, гладкомышечные клетки, так и микробных клеток. Например, главный основный белок-1, эозинофильный катионный белок или эозинофильная пероксидаза способны при нанесении на эпителий дыхательных путей приматов вызывать цилиостазис, десквамацию и гиперреактивность гладкой мускулатуры дыхательного тракта, что имитирует патологические процессы при астме. Повреждение эндотелия при эозинофильной эндомиокардиальной болезни считается инициальным фактором кардиомиопатии при гиперэозинофилических синдромах.
Все четыре катионных белка гранул (эозинофильная пероксидаза, эозинофильный катионный белок, эозинофильный нейротоксин и главный основный белок-1) способствуют отеку при кожных заболеваниях за счет вазодилятационного эффекта, а также действия главного основного белка на тучные клетки и выделения гистамина базофилами. Белки эозинофильных гранул помимо тучных клеток и базофилов стимулируют многие другие клетки, например, нейтрофилы и тромбоциты. NERDS-синдром (от англ. Nodules, Eosinophilia, Rheumatism, Dermatitis, Swelling — узелки, эозинофилия, ревматизм, дерматит, отеки), эпизодический ангионевротический отек с эозинофилией — синдром Глейча (Gleich), крапивница и эозинофильный целлюлит/флегмона — синдром Уэлса (Wells) и реакция на укус насекомого являются примерами различной выраженности отека, обусловленного по меньшей мере отчасти этим механизмом. Введение в кожу белков эозинофильных гранул способствует формированию высыпаний, среди которых дозозависимые аллергические реакции на главный основный белок, а также изъязвления в ответ на эозинофильный катионный белок и эозинофильный нейротоксин. В присутствие эозинофилов и белков гранул эозинофилов замедляется заживление ран. Эозинофилы обладают прокоагулянтным действием за счет белков гранул. При гиперэозинофильных синдромах часто развиваются тромбозы вплоть до обструкции печеночных вен (синдром Бадда-Киари).
Тромбоз может быть обусловлен прямым повреждением эндотелия либо развивается вследствие способности главного основного белка и эозинофильного катионного белка нейтрализовать гепарин. Кроме того, главный основный белок является мощным агонистом тромбоцитов и фактором активации тромбоцитов, который после выделения из тромбоцитов вызывает их аггрегацию.
б) Главный основной белок:
1. Общие свойства. Главный основный белок составляет кристаллическое ядро специфических эозинофильных гранул. Он был назван так из-за того, что составляет около 55% массы белков эозинофильных гранул (у морских свинок). Он имеет высокую изоэлектрическую точку, около 11 pH. Известно, что этот белок синтезируется в виде двух гомологов — главного основного белка-1 и главного основного белка-2. Они кодируются различными участками хромосомы 11.
2. Эффекты главного основного белка на ткани. Главный основный белок-1 наносит прямые повреждения гельминтам и часто оказывает летальный эффект на клетки и ткани млекопитающих, например, вызывая отслоение бронхиального эпителия и убивая клетки опухоли. Главный основный белок-1 реализует свои эффекты посредством увеличения проницаемости мембран за счет изменения свойств липидного бислоя. Главный основный белок-1 и 2 в отличие от остальных белков гранул эозинофилов стимулируют выделение из базофилов гистамина и LTC4. Кроме того, эти два белка способны стимулировать нейтрофилы, усиливая выделение супероксидов, лизоцима и ИЛ-8. Главный основный белок и эозинофильная пероксидаза являются мощными агонистами тромбоцитов, способствуя выделению 5-гидрокситриптамина и облегчая образование тромбов.
3. Эозинофильная пероксидаза. Эозинофильная пероксидаза обладает выраженными основными свойствами, pH равен 10,8. Она расположена в матриксе специфических эозинофильных гранул и является ключевым участником создания высокоактивных форм окислов и свободных радикалов в активированных эозинофилах. Эозинофильная пероксидаза состоит из тяжелой и легкой цепей, закодированных в виде пропоследовательности. Ген этого фермента расположен на 17 хромосоме и соседствует с генами лактопероксидазы и миелопероксидазы, двух других членов семейства пероксидаз млекопитающих, которые обнаруживаются в железах слизистой оболочки и нейтрофилах соответственно. Хотя главный основный белок обладает наибольшей молярной концентрацией в гранулах эозинофилов, эозинофильная пероксидаза характеризуется наибольшим абсолютным весом, на нее приходится 25% массы эозинофильных специфических гранул. Эозинофильная пероксидаза катализирует окисление галагеноидов, псевдогалагеноидов и оксидов азота, чтобы сформировать высокореактивные соединения кислорода (гипогалоидные кислоты), высокоактивные продукты обмена азота (диоксид азота) и другие оксиданты, которые окисляют отдельные участки белков, что приводит к выраженному оксидативному стрессу и смерти клетки от апоптоза и некроза.
Эозинофильная пероксидаза убивает многочисленные виды микроорганизмов в присутствии перекиси водорода, которую генерируют эозинофилы и другие фагоциты, а также галогенидов. Комбинация этих веществ также способствует секреции тучных клеток.
Как было указано выше, и эозинофильная проксидаза, и главный основный белок вызывают дозонезависимое, нецитолитическое выделение 5-гидрокситриптамина из тромбоцитов. Связывание эозинофильной пероксидазы с нейтрофилами вызывает обратимое ингибирование ее активности, однако повышает агрегацию нейтрофилов и их адгезию к эндотелиальным клеткам. Эозинофильная пероксидаза связывается и с микробами, включая Staphylococcus aureus, что существенным образом повышает степень их фагоцитоза. Покрытые эозинофильной пероксидазой клетки опухоли подвержены спонтанному лизису под действием макрофагов.
в) Эозинофильный катионный белок и эозинофильный нейротоксин. Общие свойства. Эозинофильный катионный белок (или РНКазаЗ) и эозинофильный белок (РНКаза2) являются гомологичными белками с одинаковой последовательностью аминокислот от 37 до 55. Оба они закодированы на хромосоме 14. Эозинофильный катионный белок обладает нейротоксическим действием. Они оба играют роль в защите организма хозяина от ДНК-содержащих вирусов. При этом исследователи продолжают идентифицировать все новые их функции. Эозинофильный нейротоксин индуцирует миграцию и созревание дендритных клеток. Он также относится к эндогенным лигандам Toll-подобных рецепторов второго типа и активирует миелоидные дендритные клетки посредством сигнального пути миелоидного TLR2 фактора дифференциации 88 (Myd88).
В соответствии с его способностью выступать в качестве хемоаттрактанта и активатора дендритных клеток наряду с усилением антиген-специфического Th2-иммунного ответа, этот белок служит сигналом срочной активации иммунной системе преимущественно в отношении Th2 ответа.
г) Белок кристаллов Шарко-Лейдена. Характерные гексагональные бипирамидальные кристаллы были впервые описаны в 1853 году у пациента с лейкемией, а затем в 1872 году—в мокроте больного бронхиальной астмой. С тех пор кристаллы Шарко-Лейдена стали считаться характерным признаком эозинофилии. Они часто встречаются, весьма характерны для эозинофилии, однако не являются исключительным («уникальным») признаком эозинофилии. Их также можно обнаружить в меньших количествах в базофилах. Матричная РНК кристаллов Шарко-Лейдена и эозинофильного нейротоксина находятся в числе наиболее часто экспрессируемых матричных РНК в зрелых эозинофилах, находящихся в кровеносном русле. Это позволяет сделать вывод о том, что они синтезируются de novo.
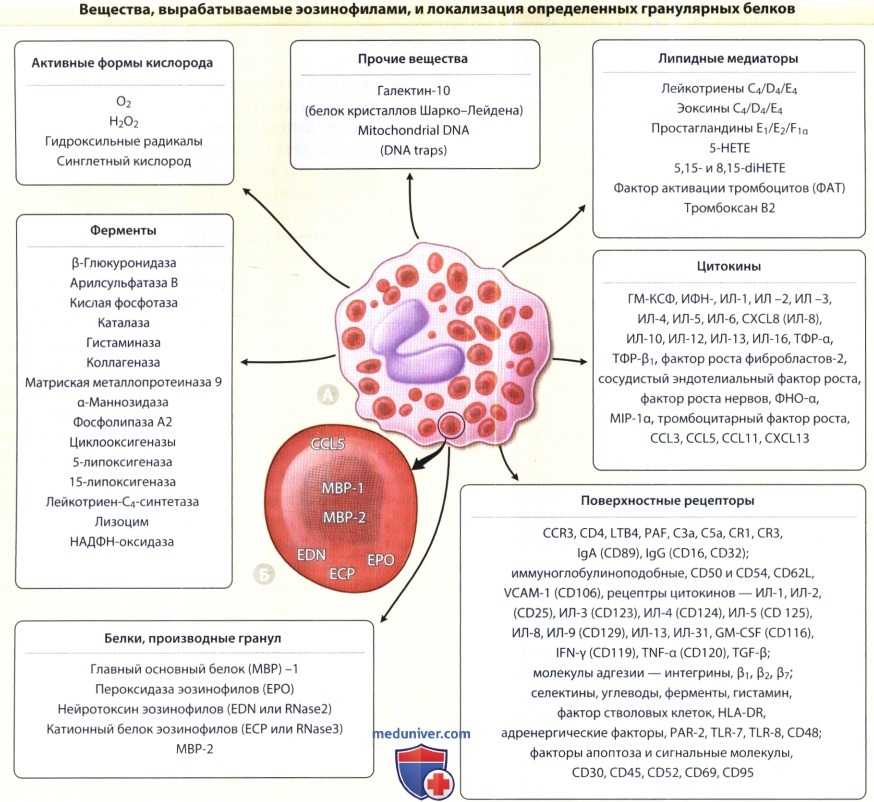
Эозинофилы вырабатывают множество веществ, среди которых цитотоксические белки гранул, играющие патогенетическую роль.
Характерные для эозинофилов гранулы крупнозернистые и, как следует из их названия, эозинофильные, т.е. окрашиваются эозином.
Определенные белки гранул располагаются в ядре и матриксе специфических цитоплазматических гранул.
А. Интактный эозинофил дермы с типичными гранулами и характерным двудольным ядром.
Б. Типичные специфические (вторичные) гранулы эозинофилов с электроноплотным кристаллическим ядром и прозрачным матриксом, что связано с характерной локализацией определенных гранулярных белков.
- Рекомендуем далее ознакомиться со статьей "Состав и компоненты кристаллов Шарко-Лейдена эозинофил"
Оглавление темы "Эозинофилы при болезнях кожи.":- Происхождение и развитие эозинофилов
- Цитокины и сигнальные пути эозинофилов
- Cтруктура эозинофил и состав эозинофильных гранул
- Функции эозинофил и их роль в иммунитете
- Компоненты эозинофил и их функции
- Состав и компоненты кристаллов Шарко-Лейдена эозинофил
- Механизм миграции эозинофил в ткани
- Механизм ативации эозинофил

