Схема развития нефротического синдрома
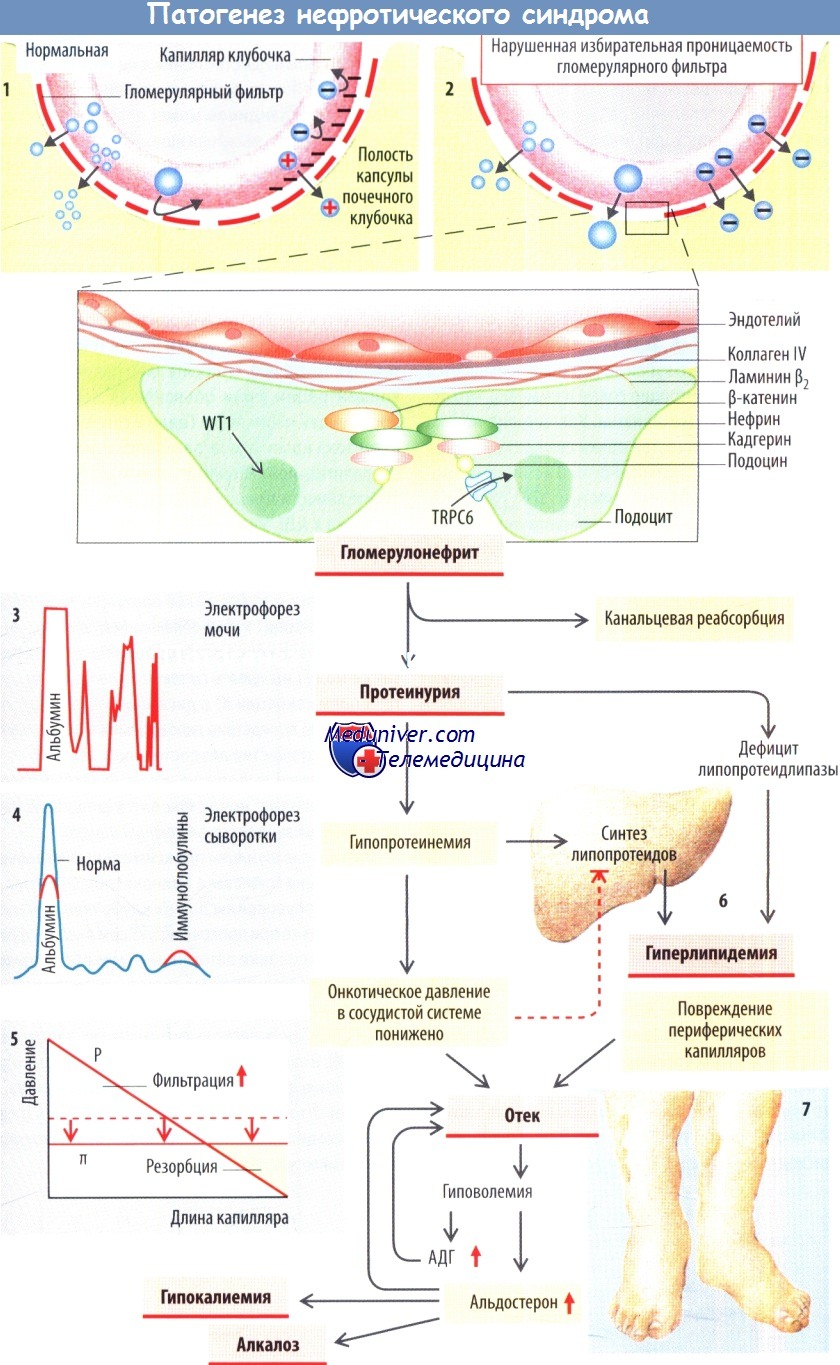
Гломерулярный фильтр (фенестрированный эндотелий, базальная мембрана, щелевидная диафрагма подоцитов) обладает избирательной проницаемостью, т. е. он предотвращает прохождение некоторых компонентов крови. Фильтруемость молекул через гломерулярный фильтр зависит от их размера, формы и заряда.
В норме макромолекулы диаметром более 4 нм не проходят через базальную мембрану и щелевидную диафрагму. Отрицательно заряженные макромолекулы (например, альбумины) отталкиваются отрицательным зарядом фенестри-рованного эндотелия. Матрикс базальной мембраны содержит коллаген типа IV За, 4а и 5а, а также пластину β2. Генетические дефекты коллагена типа IV За, 4а и 5а (синдром Альпорта и болезнь «тонкой базальной мембраны») и пластины β2 (синдром Пирсона) сопровождаются гломерулосклерозом.
Антитела к коллагену типа IV 3а образуются при синдроме Гудпасчера — аутоиммунном заболевании, поражающем базальную мембрану и приводящем помимо прочего к гломерулонефриту.
Подоциты соединены между собой нефрином — трансмембранным белком с крупным внеклеточным доменом. Нефрин связывает адаптерный белок CD2AP (CD2-ассоциированный протеин) и мембранный белок подоцин. Подоциты экспрессируют Са2+-транспортирующий катионный канал TRPC6 (транзиторный рецепторный потенциал канала) и белки цитоскелета а-актинин-4 и NMMHC-IIA (тяжелая цепь IIА немышечного миозина).
В регуляции экспрессии генов в подоцитах участвует WT1, который подавляет экспрессию нескольких факторов роста. Генетические дефекты нефрина (нефротический синдром финского типа), CD2AP, подоцина (аутосомно-рецессивный стероид-резистентный нефротический синдром), TRPC6, а-актинин-4, NMMHC-IIA или WT1 (синдром Дениса—Драша, синдром Фрейзера) могут приводить к гломерулонефриту. Генетические дефекты, сочетающиеся с синдромом дисплазии ногтей и надколенника, также служат причиной повреждения гломерулярного аппарата.
Гораздо чаще, чем при генетических дефектах, повреждение клубочков наблюдается при гломерулонефрите или системных заболеваниях, например гипертензии или сахарном диабете.
Если целостность клубочкового фильтра нарушается, белки плазмы и даже эритроциты могут проникать в полость капсулы Боумена, что приводит к протеинурии и гематурии. С помощью электрофореза было установлено, что поврежденный фильтр лучше всего пропускает небольшие отрицательнозаряженные альбумины.
Даже неповрежденный гломерулярный фильтр пропускает мелкие белки, которые затем реабсор-бируются в проксимальных канальцах. Ограниченная транспортная способность эпителия канальцев не справляется с большим количеством белков, прошедших через клубочковый фильтр, что приводит к протеинурии. Нарушение реабсорбции белков в проксимальном канальце сопровождается выведением умеренного количества белков, имеющих небольшой размер (канальцевая протеинурия).
Почечная потеря белка из-за повреждения гломерулярного аппарата вызывает гипопротеинемию. Данные электрофореза сыворотки свидетельствуют о том, что гипопротеинемия в значительной степени обусловлена потерей альбуминов. Снижение онкотического давления в сосудистой системе усиливает фильтрацию водной части плазмы на периферии. Фильтрация в периферических капиллярах облегчается за счет повреждения стенок капилляров, что может служить причиной воспалительных изменений.
В результате фильтрации белков в периферических капиллярах концентрация белка и онкотическое давление в интерстициальном пространстве растут, поэтому фильтрационное равновесие смещается в сторону интерстициального пространства. Если удаление белков с лимфой не компенсирует это состояние, возникаютотеки. Периферическая фильтрация повышает концентрацию крупных белков, которые не проходят через поврежденный гломерулярный фильтр (например, липопротеиды).
Состояние, при котором сочетаются протеинурия, гипопротеинемия и периферические отеки, называют нефротическим синдромом. Увеличение концентрации липопротеидов приводит к гиперлипидемии и гиперхолестеринемии. Гиперлипидемию усугубляет снижение активности липопротеидлипазы.
Гипопротеинемия способствует периферической фильтрации. Переход водной части плазмы в интерстициальное пространство приводит к гиповолемии, которая вызывает жажду, выброс АДГ и альдостерона (через ренин и ангиотензин). Увеличенное потребление жидкости, повышенная реабсорбция NaCI и воды создают все условия для сохранения отеков. Поскольку альдостерон стимулирует почечную экскрецию К+ и Н+, развивается гипокалиемия и алкалоз.
- Рекомендуем ознакомиться со следующей статьей "Схема развития пиелонефрита (интерстициального нефрита)"
Оглавление темы "Патогенез болезней в схемах":- Схема регуляции почечной экскреции и ее нарушения
- Схема развития нарушений почечного транспорта
- Схема нарушения концентрации мочи почками
- Схема развития поликистоза почек
- Схема развития гломерулонефрита
- Схема развития нефротического синдрома
- Схема развития пиелонефрита (интерстициального нефрита)
- Схема развития острой почечной недостаточности (ОПН)
- Схема развития хронической почечной недостаточности (ХПН)
- Схема повышения давления при болезни почек

