Опухолевые антигены и их характеристика
Антигены, вызывающие иммунный ответ, обнаружены во многих экспериментально индуцированных опухолях и в некоторых злокачественных новообразованиях человека. Первоначально их подразделяли на две категории в соответствии с особенностями экспрессии.
Первую категорию составляли опухолеспецифические антигены, присутствующие только в опухолевых клетках, во вторую группу вошли опухоль-ассоциированные антигены, расположенные как в клетках опухоли, так и в некоторых нормальных клетках. Эта классификация, однако, несовершенна. Как показали новые исследования, многие опухолеспецифические антигены присущи также некоторым нормальным клеткам. Современная классификация опухолевых антигенов основана на их молекулярной структуре и источнике.
Первые попытки изучения опухолевых антигенов основывались на продукции моноклональных опухолеспецифических антител и определении антигенов, которые распознаются этими антителами. Важным достижением в области иммунологии опухолей стало развитие методов идентификации опухолевых антигенов с помощью цитотоксических Т-лимфоцитов, поскольку они — главное звено в механизме противоопухолевой иммунной защиты.
Следует напомнить, что цитотоксические Т-лимфоциты распознают пептиды, образующиеся из цитоплазматических белков, которые связываются с молекулами МНС класса I.
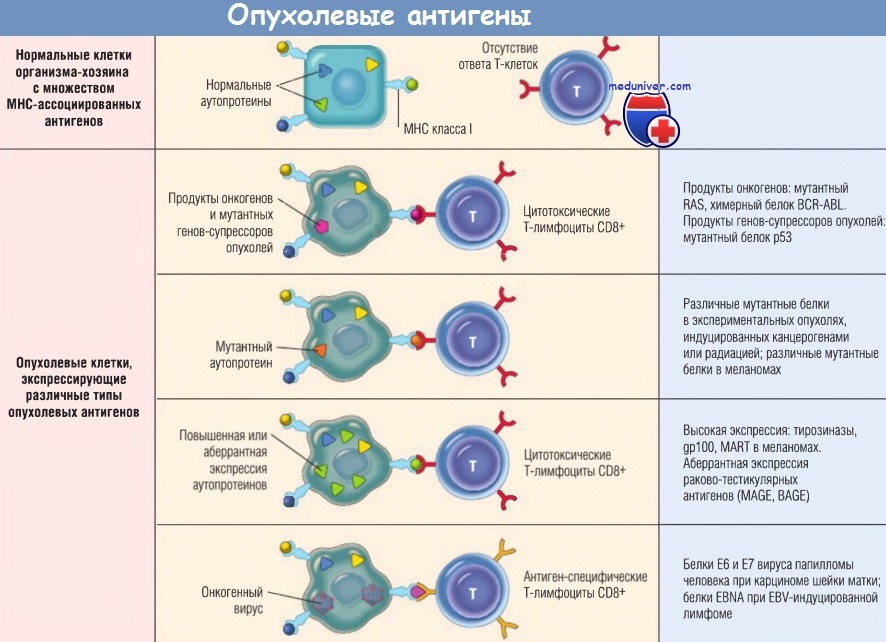
а) Продукты мутантных онкогенов и генов-супрессоров опухолей. Опухолевая трансформация клеток, как было показано ранее, происходит вследствие накопления генетических повреждений в протоонкогенах и генах-супрессорах опухолей. Мутантные белки одновременно являются антигенами, чужеродными для иммунной системы организма-хозяина, которые она распознает.
Дополнительно к указанным антигенам могут образовываться и другие из-за нестабильности генома опухолевой клетки и появления мутаций генов, продукты которых могут не иметь никакого отношения к трансформированному фенотипу и не обладать какой-либо функцией, но могут стать опухолевыми антигенами.
Продукты измененных протоонкогенов, генов-супрессоров опухолей и других мутантных генов, не связанных с трансформацией, синтезируются в цитоплазме опухолевых клеток и, как любой цитоплазматический белок, подвергаются обработке во время антигенного процессинга, а затем, представляя собой молекулы МНС класса I, могут распознаваться Т-клетками CD8+.
Кроме того, при фагоцитозе мертвых опухолевых клеток антигенпрезентирующими клетками эти белки также подвергаются обработке во время антигенного процессинга и, представляя собой молекулы МНС класса II, становятся доступными для распознавания и Т-клетками CD4+. Поскольку эти измененные белки не присутствуют в нормальных клетках, иммунологическая толерантность к ним отсутствует.
Некоторые пациенты со злокачественными опухолями имеют циркулирующие Т-клетки CD8+ и CD4+, которые распознают продукты мутантных онкогенов и генов-супрессоров опухолей, например белки RAS, р53 и BCR-ABL. В экспериментах на животных, иммунизированных мутантными белками RAS и р53, были получены цитотоксические Т-лимфоциты и произошло отторжение опухолей, экспрессирующих мутантные белки. Однако у большинства больных онкопротеины не являются основной мишенью опухолеспецифических цитотоксических Т-лимфоцитов.
EBV — вирус Эпштейна-Барр; МНС — главный комплекс гистосовместимости
б) Повышенная или аберрантная экспрессия клеточных белков. Опухолевые антигены могут представлять белки нормальных клеток, которые неправильно экспрессируются в клетках опухоли и вызывают иммунный ответ. В подгруппе меланом человека некоторые антигены опухоли — нормальные структурные белки — продуцируются в малом количестве в нормальных клетках, однако гиперэкспрессируются в клетках опухоли.
Например, тирозиназа — фермент, вовлеченный в биосинтез меланина, экспрессируемый только в нормальных меланоцитах и клетках меланомы. Т-клетки пациентов с меланомой распознают пептиды, производные тирозиназы, что увеличивает вероятность стимуляции подобного ответа против меланомы антитирозиназными вакцинами (в настоящее время проходят клинические испытания таких вакцин). Удивительно, но организм таких пациентов в состоянии ответить на нормальный аутоантиген.
Вероятно, тирозиназа производится в столь незначительном количестве (и в немногих клетках), что не распознается иммунной системой и не вызывает толерантность.
Другая группа — антигены рака яичка. Они закодированы генами, «молчащими» во всех тканях взрослого организма, за исключением яичек. Хотя белок присутствует в яичке, но он не представлен на поверхности клеток в антигенной форме, поскольку сперма не экспрессирует антигены молекул МНС класса I. Для практических целей важно, что эти антигены опухолеспецифические.
Прототипом данной группы считают семейство генов MAGE. Они относятся к опухолеспецифическим антигенам, но в то же время антигены MAGE не уникальны для опухолей. MAGE-1 экспрессируется в 37% меланом, а также в карциномах легкого, печени, желудка и пищевода. В других опухолях были обнаружены подобные антигены — GAGE, BAGE и RAGE.
в) Антигены опухоли, производные онкогенных вирусов. Как обсуждалось ранее, некоторые вирусы обусловливают развитие злокачественных новообразований, что неудивительно, ведь эти вирусы продуцируют белки, воспринимаемые иммунной системой как чужеродные. Наиболее сильными из этих антигенов являются белки латентных ДНК-вирусов, например HPV и EBV.
Существует множество доказательств, что цитотоксические Т-лимфоциты распознают антигены этих вирусов, а компетентная иммунная система контролирует опухоли, вызванные вирусом, путем распознавания и элиминации зараженных клеток. Концепция иммунного надзора в наибольшей мере применима для опухолей, вызванных ДНК-содержащими онко-генными вирусами. Действительно, вакцинация против антигенов HPV оказалась эффективной в профилактике цервикальных неоплазий у молодых женщин.
г) Онкофетальные антигены. Онкофетальные антигены являются белками, имеющими высокий уровень экспрессии в опухолевых клетках и нормальных развивающихся (фетальных) незрелых тканях. Полагают, что гены, их кодирующие, в зрелых тканях находятся в латентном состоянии и активируются при злокачественной трансформации. Онкофетальные антигены были идентифицированы с помощью антител, что имеет значение для диагностики опухолей.
С усовершенствованием диагностических методов стало очевидным, что экспрессия онкопротеинов во взрослом организме не ограничивается только опухолевой тканью. Количество этих белков возрастает при различных воспалениях как в пораженной ткани, так и в сыворотке крови, эти белки присутствуют даже в нормальных тканях (в небольших количествах). Не доказано, что онкофетальные белки являются активаторами и мишенями противоопухолевого иммунитета. Наиболее полно охарактеризованы 2 онкофетальных белка — карциноэмбриональный антиген и а-фетопротеин.
д) Измененные гликолипиды и гликопротеины клеточной поверхности. В большинстве экспериментальных опухолей и опухолей человека увеличивается экспрессия поверхностных гликопротеинов и гликолипидов нормальных или патологических форм, которые можно использовать в качестве диагностических маркеров и терапевтических мишеней. Эти измененные молекулы включают ганглиозиды, антигены группы крови и муцины. У животных были выявлены множество антител, способных распознавать группы углеводов пептидных центров этих молекул.
Несмотря на то что распознаваемые антителами эпитопы экспрессируются не только опухолями, на опухолевых клетках они присутствуют в больших количествах по сравнению с нормальными клетками. Этот класс антигенов — мишень при лечении злокачественных опухолей антителами.
Среди гликолипидов, экспрессирующихся в больших количествах на поверхности клеток меланомы, следует назвать ганглиозиды GM2, GD2 и GD3. Проходят клинические испытания антител анти-GМ2 и aнти-GD3 и вакцинация GD2 пациентов с меланомой. Муцины относятся к высокомолекулярным гликопротеинам, которые содержат кислород-связанные углеводные боковые цепи на центральном полипептиде.
В опухолях часто происходит нарушение работы ферментов, участвующих в синтезе этих углеводных цепей, что приводит к появлению опухолеспецифических эпитопов на углеводных боковых цепях или к патологическому покрытию пептидного ядра. В центре внимания диагностических и терапевтических исследований были несколько муцинов, в т. ч. СА-125 и СА-19-9 (экспрессируются при карциноме яичников), а также MUC-1 (выявляется в карциномах молочной железы). В отличие от многих других типов муцинов MUC-1 является интегральным мембранным белком, который в норме локализуется только на апикальной поверхности протокового эпителия молочной железы — в зоне, изолированной от иммунной системы.
В карциномах протоков молочной железы молекула экспрессируется неполярным способом и содержит новые, специфические для опухоли углеводный и пептидный эпитопы. Эти эпитопы вызывают образование как антител, так и сенсибилизированных Т-клеток у пациентов со злокачественными опухолями, поэтому такие эпитопы рассматривают в качестве кандидатов на создание противоопухолевых вакцин.
е) Антигены дифференцировки. Опухоли экспрессируют молекулы, которые обычно присутствуют на клетках данного происхождения. Эти молекулы называют антигенами дифференцировки, их наличие характерно для специфических клеточных линий или стадий дифференцировки различных типов клеток.
Антигены дифференцировки являются, как правило, нормальными аутоантигенами, поэтому не вызывают иммунного ответа, но они могут быть мишенями иммунотерапии и помогать в определении гистогенеза опухоли. Например, лимфомы диагностируют как В-клеточные опухоли при обнаружении поверхностных маркеров CD20, характерных для В-клеток. Антитела к этим молекулам также используют для иммунотерапии опухолей, правда, антитела убивают и нормальные В-клетки, но, поскольку сохраняются интактные КСК, в конце концов образуются новые В-клетки.
Идиотипические детерминанты поверхностных Ig строго специфичны для определенных клонов В-клеток и являются их маркерами, поэтому иммуноглобулиновый идиотип относится к высокоспецифическим антигенам В-клеточных лимфом и лейкемий.
- Рекомендуем ознакомиться со следующей статьей "Механизмы клеточного иммунитета против опухоли"
Оглавление темы "Канцерогенез":- Механизмы радиационного канцерогенеза
- Механизмы РНК-вирусного канцерогенеза
- Механизмы канцерогенеза ВПЧ (вируса папилломы человека)
- Механизмы канцерогенеза вируса Эпштейна-Барр (EBV)
- Механизмы канцерогенеза вирусов гепатита В и С
- Механизмы канцерогенеза H.pylori (Helicobacter pylori)
- Механизмы противоопухолевого иммунитета
- Опухолевые антигены и их характеристика
- Механизмы клеточного иммунитета против опухоли
- Механизмы ухода опухоли от иммунной защиты

