Типы мышц и клеточное строение мышечных волокон - с точки зрения физиологии человека
Оглавление статьи:- Мускулатура - высокоспециализированная сократимая ткань
- Схема организации и элементы поперечнополосатой мышцы
- Белки сократительного аппарата
- Коротко
- Список использованной литературы
P.S. Женщина 45 лет стала замечать у себя слабость верхних век и случаи нарушения зрения (двоилось изображение в глазах). Проблемы возникали в основном при эмоциональном стрессе и недостатке сна. Перед менструацией у нее появились затруднения при глотании и во время речи, а также при работе мимических мышц. После менструации эти симптомы практически исчезли, и женщина не стала обращаться к врачу.
Однако, когда через несколько месяцев слабость стала распространяться на различные скелетные мышцы и в конце концов на дыхательную мускулатуру, пациентка отправилась к врачу и узнала от него, что больна миастенией.
Речь в данном случае идет о прогрессирующей мышечной патологии, причина которой заложена в самой мышце, а не в нервной системе. Известно, что заболевание обусловлено образованием в организме аутоантител к собственным мышечным белкам, в данном случае к белкам, обеспечивающим нервно-мышечный контакт (никотиновым ацетилхолиновым рецепторам).
Вследствие резкого снижения числа активных рецепторов у страдающих этим заболеванием существенно нарушается сопряжение между возбуждением и сокращением. Для миастении характерны приступы мышечной слабости в течение нескольких часов, дней или недель; облегчение наступает в покое, а ухудшение — при возникновении инфекций, эмоциональной нагрузке, ярком свете, смене лекарственного препарата, гормональной перестройке (например, во время менструации).
При диагностике и лечении заболевания, как правило, используют средства, препятствующие разрушению медиатора ацетилхолина и усиливающие сократительную реакцию мышцы на нервный импульс.
а) Мускулатура - высокоспециализированная сократимая ткань. Мускулатура — это сократимая ткань, способная развивать силу и осуществлять движения. Существуют два типа поперечно-полосатой мускулатуры (скелетная и сердечная), а также гладкая мускулатура.
1. Сократительные клетки. Способность к сокращению (сократимость) — это свойство, присущее прежде всего мышечным клеткам. Правда, сейчас в организме насчитывается по меньшей мере еще пять типов сократительных клеток:
- перициты;
- миоэпителиальные клетки экзокринных желез;
- миофибробласты;
- эндотелиальные клетки;
- наружные волосковые клетки внутреннего уха.
Однако при всем многообразии видов специализации сократительной деятельности особое значение в этой статье на сайте отведено мышечным клеткам. Многие знакомые нам двигательные физиологические процессы, например локомоция, сокращения сердца или перистальтика пищеварительного тракта, обеспечиваются деятельностью мышц.
2. Типы мышц. Скелетная мускулатура представляет собой наиболее мощно развитую ткань в организме человека и составляет более 40% общей массы тела. Два типа — скелетные мышцы и полая мышца сердца (миокард;) известны как поперечно-полосатые мышцы, поскольку под световым микроскопом их сократительные компоненты имеют вид регулярно чередующихся светлых и темных полос (рис. 1). Мышцы третьего типа, выстилающие стенки внутренних органов и кровеносных сосудов, лишены поперечных полос, а также имеют иные структурные и функциональные особенности.
Это гладкая мускулатура, которая будет рассмотрена в отдельной статье на сайте (просим Вас пользоваться формой поиска по сайту выше).
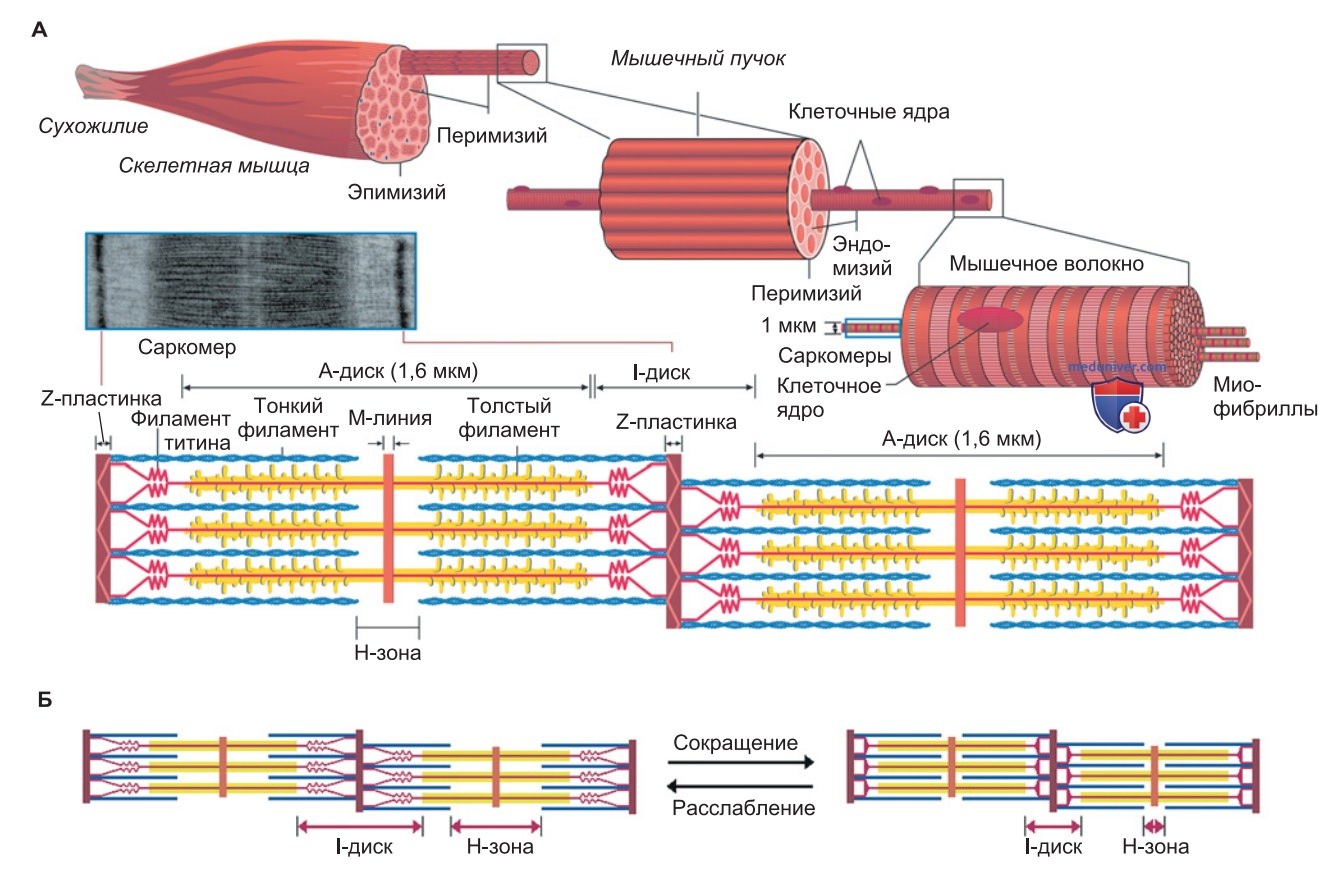
б) Схема организации и элементы поперечнополосатой мышцы. Скелетная мышца характеризуется иерархической многоуровневой организацией. Мышечные клетки (волокна) содержат сотни сократительных трубочек — миофибрилл, которые, в свою очередь, объединены в «блоки» (саркомеры) из «толстых» и «тонких» филаментов («нитей»), а также титиновых тяжей.
1. Структурная организация скелетной мышцы. Скелетная мышца состоит из многочисленных пучков мышечных волокон (диаметром 10-80 мкм) (рис. 1). Мышечное волокно — многоядерная клетка, которая формируется в процессе эмбрионального развития путем слияния одноядерных клеток — миобластов и затем уже не способна к делению (кардиомиоцит, напротив, является одноядерным!). Основу иерархической структуры скелетной мышцы составляют миофибриллы диаметром 1-2 мкм, расположенные параллельно продольной мышечной оси.
Эти тонкие цилиндрические элементы разделены поперечными Z-пластинками (Z-линиями) на сотни компартментов — саркомеров длиной по 2-2,5 мкм (рис. 1). Последовательные саркомеры образуют сократительный аппарат и в клетках сердечной мышцы; однако в кардиомиоцитах параллельный порядок миофибрилл не выдерживается так строго, как в волокнах скелетных мышц.
- Мышечная регенерация. При повреждениях скелетномышечной ткани активируются зрелые мышечные стволовые клетки — одноядерные веретеновидные сателлитные клетки (миосателлиты). Они образуются в результате слияния миобластов, оставшихся после завершения эмбриогенеза, и вновь дифференцируются, создавая многоядерные мышечные волокна. Таким образом, скелетная мышца, в отличие от сердечной, способна к частичной регенерации.
2. Строение саркомера. На рис. 1 представлена электронно-микроскопическая фотография саркомера, а также схематично изображены его структурные элементы. Среднюю часть каждого саркомера занимают несколько тысяч толстых филаментов (их основной компонент — миозин) длиной ~1,6 мкм и диаметром ~13—14 нм. На обоих концах саркомера толстые филаменты чередуются примерно с двумя тысячами тонких филаментов (основной компонент — актин), имеющих диаметр ~8 нм.
На поперечном разрезе видно, что в области перекрытия актиновых и миозиновых филаментов каждый толстый филамент окружен гексагональной решеткой из шести тонких филаментов. Что касается тонких филаментов, то они прикреплены к Z-пластинке, так же как титиновые тяжи, составляющие еще одну — третью систему филаментов в саркомере (рис. 1). Гигантские молекулы титина вблизи от Z-пластинки связаны с тонкими филаментами, затем в виде эластичной пружины соединяются с толстыми миозиновыми филаментами и вместе с ними тянутся до середины саркомера.
3. Поперечная исчерченность саркомеров. На продольном срезе через миофибриллу можно различить с помощью светового микроскопа пучки толстых филаментов. Благодаря свойству двойного лучепреломления (анизотропии) эти пучки в поляризованном свете имеют вид темных полос; отсюда их название — анизотропные диски или А-диски. Участки саркомера, не содержащие миозин, выглядят, напротив, как светлые полосы; это изотропные диски, или I-диски.
Регулярное чередование темных и светлых полос (дисков) в волокне скелетной мышцы (рис. 1) (в клетках миокарда эта особенность выражена менее явно) объясняется постоянством взаимного расположения А- и I-дисков в множестве миофибрилл, лежащих параллельно друг другу. В составе саркомера различаются и другие участки. Центральная часть А-диска, или Н-зона, в которой нет актиновых филаментов, выглядит более светлой по сравнению с соседними участками А-диска, где толстые и тонкие филаменты перекрывают друг друга.
В середине Н-зоны видна темная М-линия — сеть опорных белков, которая удерживает толстые филаменты вместе в виде пучка. Следовательно, роль М-линии аналогична функции, выполняемой Z-пластинкой по отношению к актиновым филаментам.
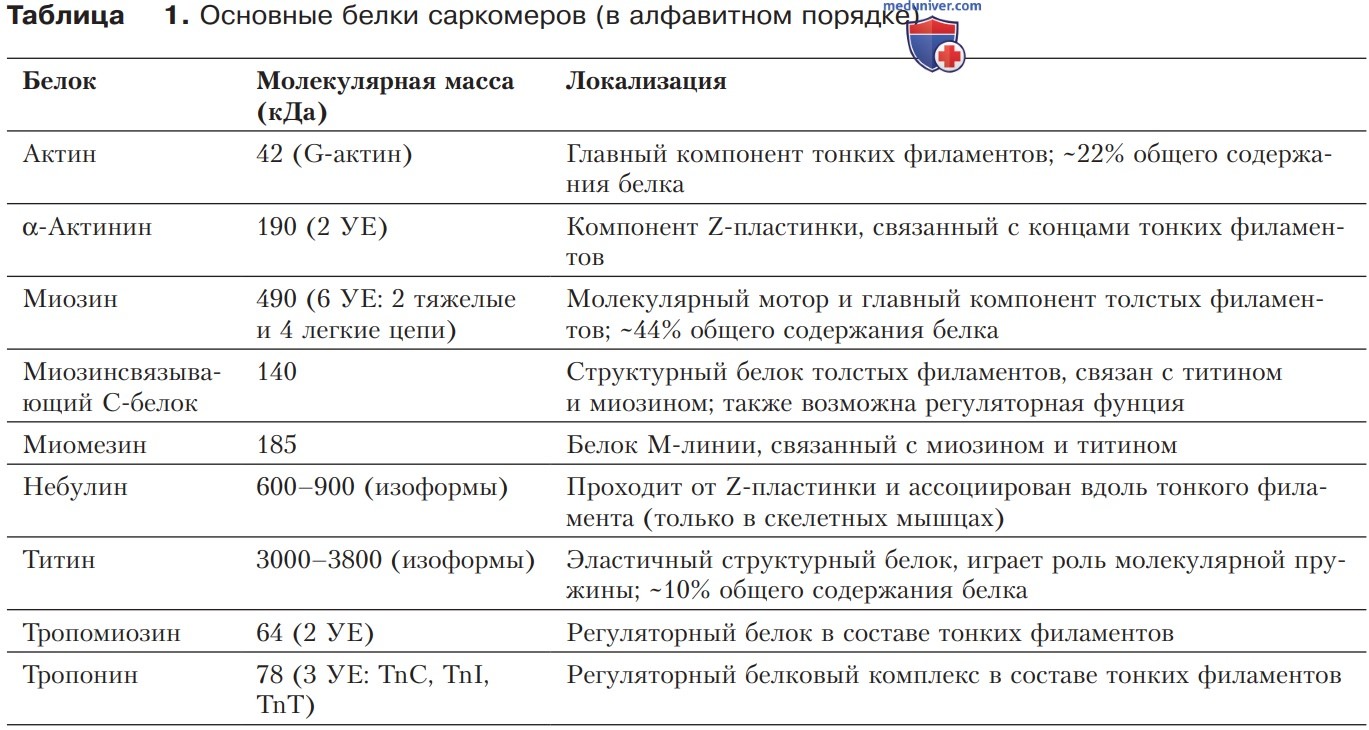
в) Белки сократительного аппарата. Наряду с миозином, актином и титином в саркомере много других белков, осуществляющих функции регуляции и опоры; нарушение работы какого-либо из этих белков вследствие мутации может привести к мышечной дисфункции (например, семейной гипертрофической кардиомиопатии).
1. Основные белки миофиламентов. Один грамм ткани скелетной мышцы содержит ~100 мг белка миозина (70 мг) и актина (30 мг), которые вместе с титином, третьим из самых распространенных мышечных белков, составляют около трех четвертей общей массы белка (табл. 1). Актин — это глобулярный белок (молекулярная масса 42 кДа), который в солевом растворе полимеризуется в фибриллярный актин (F-актин). В цитоплазме (в мышце она соответствует саркоплазме) F-актин имеет форму двойной спирали (рис. ниже).
Титин (коннектин), при его молекулярной массе 3000-3800 кДа, является в принципе самым крупным из известных белков. Его молекула на 90% состоит из модулей, подобно иммуноглобулину и фибронектину, а кроме того, содержит киназный домен.
- Молекулы титина разнообразны по величине. Так же как актин и миозин, титин встречается в изоформах, специфичных для мышечного типа. Изоформы титина существенно различаются по величине (на ~800 кДа), так что длина титинового элемента молекулы I-диска бывает разной. Эластичная титиновая область I-диска состоит из двух основных элементов: последовательности иммуноглобулиноподобных доменов и менее структурированной вставочной последовательности (PEVK-домен); длина этих двух элементов зависит от типа мышцы.
2. Миозин — молекулярный мотор. Мышечный миозин (миозин II) принадлежит к обширной группе механоферментов. Обладая АТФазной активностью, миозин расщепляет АТФ; в свою очередь, энергия гидролиза АТФ преобразуется в механическую работу — происходит сокращение мышцы. Миозин II (рис. 2) имеет молекулярную массу ~490 кДа и включает в себя две тяжелые пептидные цепи (по ~205 кДа каждая), а также две пары легких цепей ~20 кДа каждая (рис. 2). Стержневые части молекул, состоящие из легкого меромиозина, объединяются.
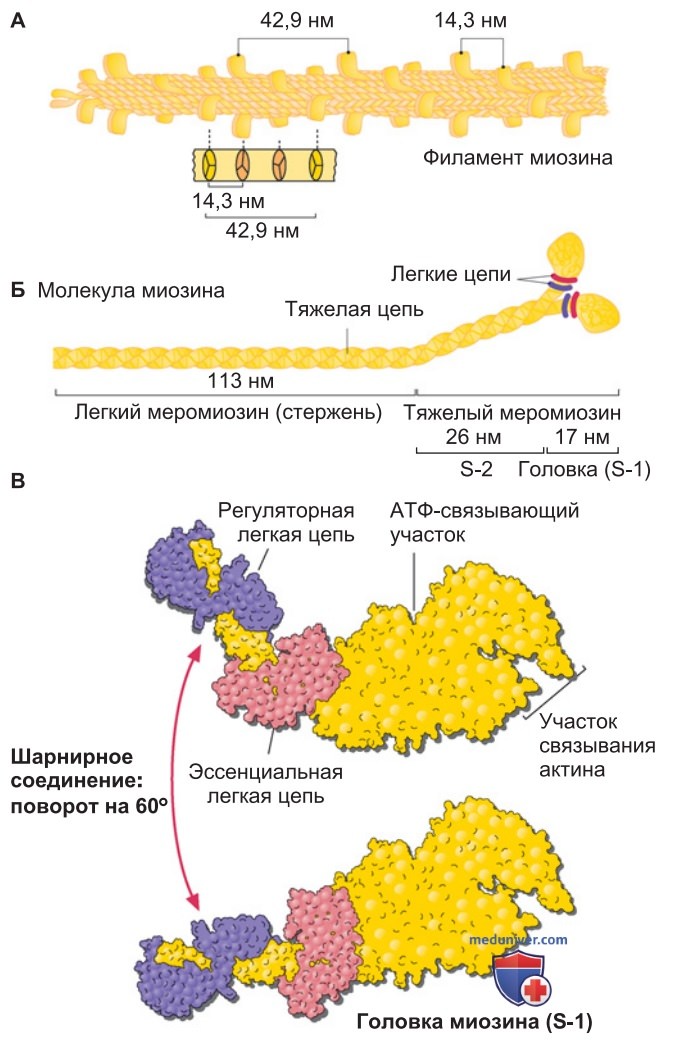
В итоге ~150 молекул миозина образуют единый филамент, от которого отходит вбок конечный участок («хвост»), состоящий из тяжелого меромиозина (рис. 2). На схеме саркомера можно видеть биполярную организацию молекул миозина, симметрично ориентированных относительно М-линии (рис. 1).
Каждая тяжелая цепь миозина заканчивается глобулярной головкой — субфрагментом S-1, где находятся сайты связывания актина, АТФ и двух легких пептидных цепей (рис. 2). Структура S-1 подробно изучена на атомарном уровне. Как показывает рентгенструктурный анализ, содержащая легкие цепи «шейка» («шарнирное соединение») может поворачиваться на 60° по отношению к головке, связанной с актиновым филаментом.
- Моторные белки. Миозины составляют суперсемейство моторных белков (минимум 18 классов). Об их функциональной значимости можно судить по тем последствиям (особые формы наследственной глухоты, альбинизм, затрудненное заживление ран), к которым приводят мутации в генах миозина. Наряду с миозинами существует целый ряд других молекулярных моторов. Они необходимы для множества двигательных процессов, объединяемых понятием «клеточная подвижность».
К наиболее известным моторным белкам относятся кинезины и динеины, которые перемещаются по микротрубочкам и обеспечивают транспорт везикул в нейронах, а также движение хромосом при делении клетки. Важная роль в дыхательной цепи принадлежит F1/F0-АТФазе (АТФ-синтазе), которая получила образное название вращающегося молекулярного мотора. Силу, развиваемую индивидуальным молекулярным мотором, можно непосредственно измерять с помощью высокочувствительных методов современной биофизики (например, нанобиомашиной «лазерный пинцет»).
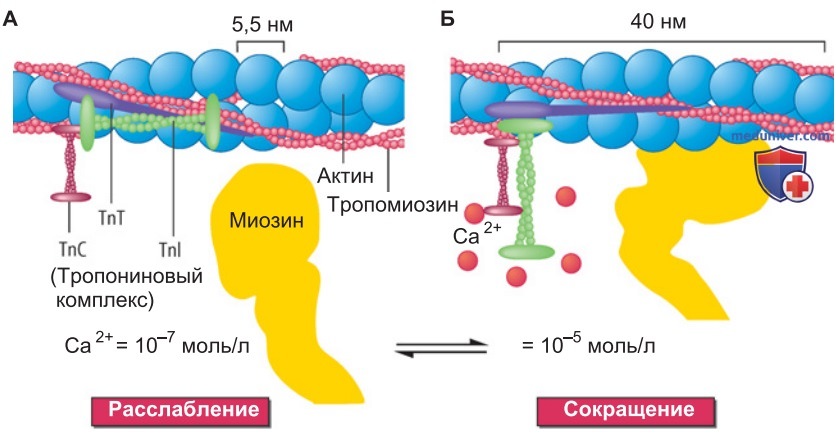
3. Многообразие саркомерных белков. Саркомер состоит из большого числа (свыше 30) различных белков; самые распространенные из них представлены в табл. 1. Эти белки регулируют мышечное сокращение (рис. выше), являются обязательными элементами цитоскелета, участвуют в распространении по клетке возникшего усилия.
4. «Заболевание саркомера». Патологические изменения функций саркомерных белков (например, в результате генной мутации) могут серьезно нарушить мышечную деятельность. Так, при гипертрофической кардиомиопатии, наследственном заболевании сердца у человека, практически всегда обнаруживаются мутации генов, кодирующих саркомерные белки. Чаще всего это мутации миозинсвязывающего белка С тяжелой цепи миозина. Реже встречаются мутации генов тропонина Т, тропонина I, тропомиозина и легких цепей миозина, а также актина и титина.
P.S. Миодистрофия Дюшенна-Беккера:
- Этиология и патогенез. Существуют прогрессирующие заболевания скелетных мышц, обусловленные дефектами дистрофина — находящегося на внутренней поверхности сарколеммы белка цитоскелета. Миодистрофия Дюшенна-Беккера характеризуется мутациями (а именно, делециями) в гене дистрофина. Заболевание, как правило, наследуется по рецессивному типу, сцепленному с Х-хромосомой. Миодистрофии Дюшенна-Беккера подвержены исключительно лица мужского пола.
Нарушение функции дистрофина обычно приводит к изменениям целостности мембраны мышечных волокон и дегенерации сократительных структур. В итоге мышечная ткань замещается соединительной тканью. При этом развиваются параличи скелетных мышц. С целью точной диагностики осуществляют анализ дистрофина в биоптатах скелетных мышц.
1. Типы мышц. Мышечная ткань состоит из специализированных сократительных клеток, развивающих силу. Различают поперечно-полосатые мышцы (скелетные и сердечная), а также гладкую мускулатуру внутренних органов и кровеносных сосудов.
2. Строение мышечных клеток. Сократительный аппарат поперечно-полосатых мышечных клеток образован лежащими параллельно друг другу миофибриллами, которые состоят из саркомеров. Вдоль миофибрилл видны чередующиеся темные А-диски и светлые I-диски.
Поперечная исчерченность мышц объясняется регулярной, почти кристаллической организацией саркомеров в виде перекрывающихся филаментов актина и миозина, скрепленных эластичными титиновыми тяжами.
Усилие развивается в результате взаимодействия саркомерных белков; основная доля общей массы белка сердечной и скелетной мышц приходится на молекулярные моторы (миозин и актин), а также титин.
Видео лекция гистология мышечной ткани (гладкой, поперечнополосатой, сердечной)
- Рекомендуем ознакомиться далее "Молекулярные механизмы сокращения поперечно-полосатых мышц - с точки зрения физиологии человека"
Редактор: Искандер Милевски. Дата публикации: 17.10.2024

