Активация сокращения поперечно-полосатой мышцы - с точки зрения физиологии человека
Оглавление статьи:- Мембранные системы мышечной клетки
- Электромеханическое сопряжение
- Коротко
- Список использованной литературы
а) Мембранные системы мышечной клетки. Ионные токи распространяются от сарколеммы вглубь мышечного волокна по мембранам трубкообразных углублений сарколеммы — системе поперечных трубочек (Т-системе), которая контактирует с мембранами саркоплазматического ретикулума (СР) — системы продольных трубочек, депонирующей внутриклеточный Са2+.
1. Ионные токи. Во время потенциала действия в плазматической мембране мышечной клетки (сарколемме) (рис. 1, слева) открываются потенциалзависимые натриевые каналы (Na+-каналы); в миокарде, кроме того, открываются Са2+-каналы (рис. 3).
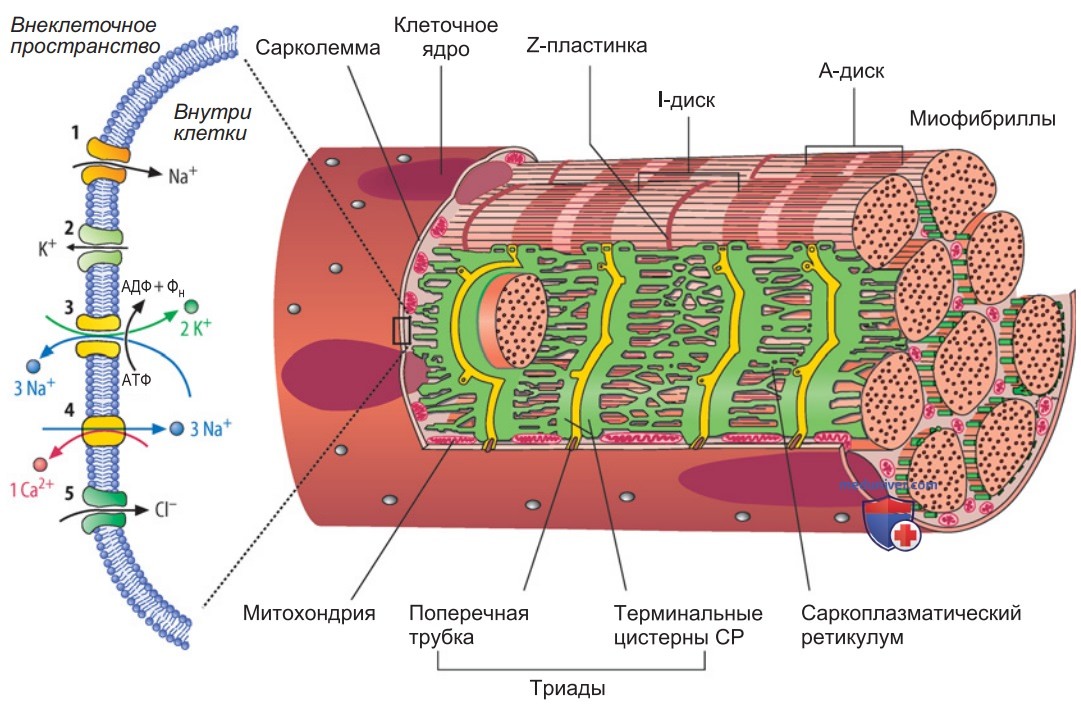
При реполяризации из клетки выходят ионы К+. Реполяризация клеток скелетных мышц ассоциируется также с входящими токами ионов хлора (Cl--токами), которые способствуют стабилизации мембранного потенциала при невозбужденном состоянии клетки. Потенциал покоя (-80 мВ) поддерживается благодаря работе натрий/калиевого насоса (Na+/K+-АТФазы), зависимого от АТФ.
В сердечной мышце действует Na+/Са2+-насос (Na+/Са2+-обменник), который выводит Са2+ из миоцитов во время расслабления миокарда. Отсюда понятно, почему частичное ингибирование Na+/К+-насоса и Na+/Са2+-обмена, например под действием сердечных гликозидов (уабаина, дигоксина, дигитоксина), усиливает сокращения миокарда.
P.S. Миотонические синдромы:
- Симптомы. При миотонии наблюдается повышенное напряжение скелетных мышц, обеспечивающих произвольные движения; расслабление мышц замедлено. Например, пациенты не могут сразу выпустить из руки сжимаемый предмет, несмотря на все свои старания.
- Этиология и патогенез. Миотонические синдромы обусловлены нарушениями функций клеточной мембраны скелетных мышц (например, дефектами ионных каналов); отмечается усиление следовых потенциалов. Существуют различные формы заболевания, возникающие в результате мутаций в тех или иных генах.
• Наиболее распространенная форма заболевания — миотоническая дистрофия. Дефекты сарколеммы ассоциируются с амплификацией (увеличением числа повторов) триплетов цитозин-тимин-гуанин (CTG-триплетов) в гене серин/треонинкиназы (локализованном в хромосоме 19q). Заболевание наследуется по аутосомно-доминантному типу. Встречается с частотой 5 случаев на 100 000 человек.
• Таким же типом наследования характеризуется миотония врожденная (myotonia congenita). Основа патологии — мутация в гене хлорного канала, которая ведет к уменьшению его проводимости и, следовательно, нарушает реполяризацию мышечной мембраны.
• Более редкая форма миотонии — парамиотония врожденная (paramyotonia congenita). Патология обусловлена мутацией в гене Na+-каналов сарколеммы.
2. Системы поперечных и продольных трубочек. На рис. 1 представлена схема участка волокна скелетной мышцы. Среди миофибрилл наряду с многочисленными митохондриями видны сильно разветвленные системы поперечных и продольных мембранных трубочек. Система поперечных трубочек (Т-система) образована многочисленными углублениями сарколеммы диаметром 50-80 нм, направленными внутрь, поперек мышечного волокна.
Система продольных трубочек (L-система, или саркоплазматический ретикулум — СР) параллельна миофибриллам и не сообщается с внешней средой. Мембраны терминальных пузырьков (цистерн) СР плотно прилегают к мембранам Т-системы; трубочка Т-систем вместе с мембранами цистерн СР составляют триаду (рис. 1).
3. Накопление кальция в СР. Саркоплазматический ретикулум выполняет важную функцию в качестве накопительной системы Са2+. Если СР не будет забирать эти ионы, обогащенные Са2+, мышечные волокна на длительное время останутся в укороченном состоянии. В мембранах СР содержится Са2+-АТФаза, которая активно транспортирует Са2+ из миоплазмы в L-систему.
Таким образом, когда мышца находится в состоянии покоя, внутриклеточная концентрация Са2+ снижена до ~10-7 моль/л.
б) Электромеханическое сопряжение. Электромеханическое сопряжение представляет собой последовательность процессов, в результате которых возбуждение плазматической мембраны мышечного волокна приводит к высвобождению Са2+ в саркоплазму и развитию силы.
1. Возбуждение мышечного волокна. При генерации потенциала действия в постсинаптической мембране (двигательной концевой пластинке) по волокну скелетной мышцы распространяется деполяризация со скоростью 3-5 м/с. В результате в саркоплазме повышается концентрация Са2+, что приводит к активации миофибрилл. После латентного периода (10-15 мс) возникает сократительная реакция скелетной мышцы, которая продолжается дольше, чем потенциал действия (рис. 2).
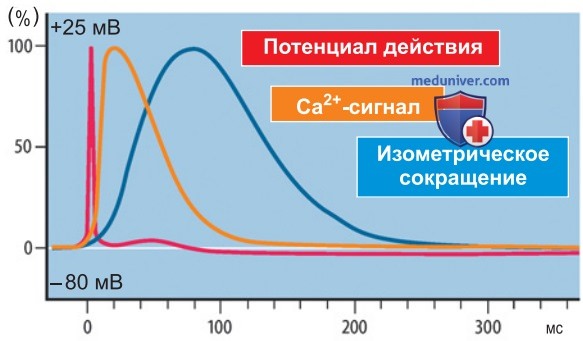
Продолжительность потенциала действия, высвобождения Са2+ и одиночного сокращения (сократительного ответа на одиночный стимул) отличается в мышцах разного типа. Мгновенная сократительная реакция на потенциал действия свойственна, например, быстрым глазным мышцам, тогда как для медленных мышечных волокон интервал времени от деполяризации до начала изометрического напряжения гораздо длиннее (рис. 2).
2. Завершение электромеханического сопряжения. Потенциал действия распространяется от сарколеммы по трубочкам Т-системы в глубину клетки (рис. 3). При деполяризации мембран Т-трубочек изменяется конформация Са2+-каналов дигидропиридинового типа (DHPR); Са2+-каналы этого типа, блокируемые дигидропиридинами, действуют как сенсоры сдвига электрического потенциала (отметим, что в скелетной мышце они обладают низкой Са2+-проводимостью, рис. 3).
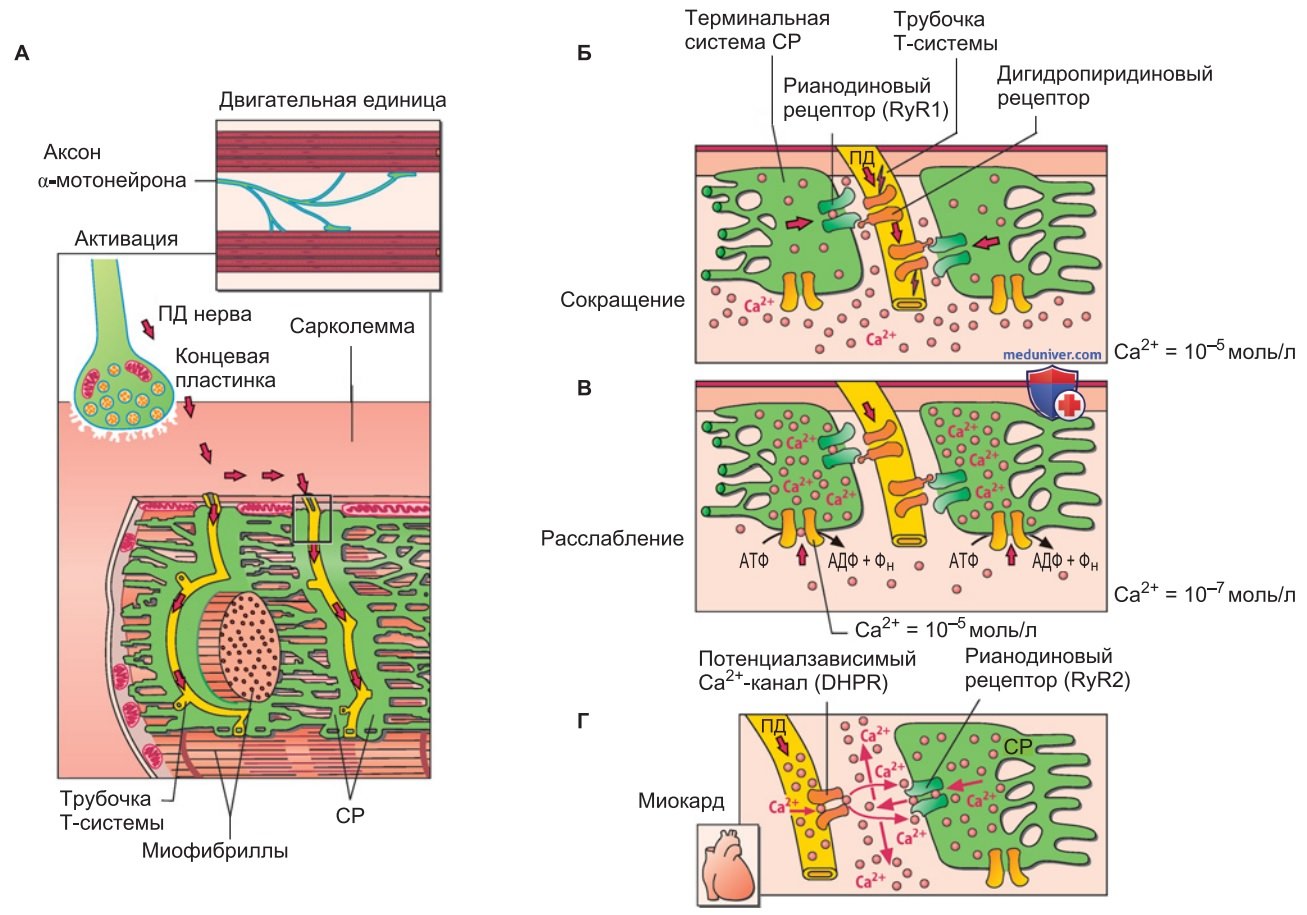
Вследствие подобных конформационных изменений в мембране СР открываются каналы рианодиновых рецепторов. Это характерные для скелетной мышцы Са2+-каналы типа RyR1, чувствительные к рианодину, которые находятся в непосредственном механическом контакте с каналами дигидропиридинового типа. При открывании каналов RyR1 в течение нескольких миллисекунд (рис. 2, «Са2+-сигнал») происходит повышение цитоплазматической концентрации Са2+ до ~10-5 моль/л (рис. 3).
Благодаря диффузии Са2+ в качестве вторичного посредника к тропонину С тонких миофиламентов активируются поперечные мостики и миофибриллы сокращаются.
3. Расслабление мышцы. Как только Са2+-насос перекачает Са2+ в СР, мышца расслабится (рис. 3). Если цитоплазматическая концентрация Са2+ снизится приблизительно до 10-7 моль/л, взаимодействие миозина с актином и активность АТФазы миозина блокируются, так что поперечные мостики отсоединяются от актина; развитие силы прекращается.
P.S. Злокачественная гипертермия:
- Общие сведения. Наряду с миастенией существует патология мышц, связанная с нарушением электромеханического сопряжения. Это злокачественная гипертермия — редкое фармако-генетическое заболевание, которое характеризуется развитием осложнений у больных при общем наркозе, преимущественно в случае использования ингаляционных анестетиков (например, галотана).
- Этиология и патогенез. Основу заболевания, наследуемого по аутосомно-рецессивному типу, составляет мутация в гене рецептора рианодинового типа в мембране СР. Некоторые анестетики вызывают у пациентов неконтролируемое повышение цитоплазматической концентрации Са2+ вследствие высвобождения этих ионов из СР. В результате возникают сильные спонтанные сокращения скелетных мышц, сопровождаемые значительным выделением тепла из-за повышенного уровня расщепления АТФ. Возможен быстрый летальный исход.
4. Электромеханическое сопряжение в сердечной мышце. В отличие от волокон скелетной мышцы, в клетки миокарда при каждом сокращении поступает Са2+ из внеклеточной среды (рис. 3). Во время потенциала действия в мембране трубочек Т-системы кардиомиоцита открываются потенциалзависимые Са2+-каналы L-типа, которые соответствуют дигидропиридиновым рецепторам.
После входа в клетку Са2+ диффундирует к находящимся поблизости Са2+-каналам типа RyR2 (рианодиновым рецепторам, характерным для миокарда), вызывая их открывание (рис. 3). Цитоплазматическая концентрация Са2+ повышается до 10-6 моль/л, и вскоре происходит сокращение. В данном случае речь идет о Са2+-индуцированном высвобождении ионов Са2+. Это явление в менее выраженной форме наблюдается и в клетках скелетной мышцы.
в) Коротко. Запуск сокращения. Во время потенциала действия и последующей реполяризации поперечно-полосатых мышечных волокон в плазматической мембране (сарколемме) регистрируются ионные токи, изучаемые в физиологии мембран. При потенциале действия открываются потенциалзависимые Na+-каналы, а в миокарде, кроме того, потенциалзависимые Са2+-каналы.
При реполяризации из клеток выходят К+-токи; для клеток скелетных мышц характерны также выходящие Cl--токи, которые способствуют стабилизации мембранного потенциала покоя. Поддержание потенциала покоя обеспечивается АТФ-зависимым Na+/К+-насосом (Na+/К+-АТФазой).
Мембрана мышечной клетки образует трубкообразные углубления — систему поперечных трубочек (Т-систему). Т-система соединяется с внутриклеточной мембранной системой продольных трубочек, аккумулирующей Са2+ (иначе говоря, с СР).
Электромеханическое сопряжение — это ряд событий. Потенциалы действия распространяются от плазматической мембраны по мембранам Т-системы внутрь мышечного волокна; из терминальных цистерн СР высвобождается Са2+; активируется рабочий цикл поперечных мостиков, т. е. происходит сокращение волокна. Когда АТФ-зависимый Са2+-насос вновь перекачает Са2+ в СР, активность поперечных мостиков прекращается — происходит расслабление мышцы.
Видео физиология мышц и мышечного сокращения - профессор, д.м.н. П.Е. Умрюхин
- Рекомендуем ознакомиться далее "Нейрорегуляция мышечной силы - с точки зрения физиологии человека"
Редактор: Искандер Милевски. Дата публикации: 17.10.2024

