Регуляция сокращений гладкой мускулатуры - с точки зрения физиологии человека
Оглавление статьи:- Сопряжение возбуждения и сокращения
- Активация сокращения
- Модуляция Са2+-чувствительности миофиламентов
- Модуляция Са2+-чувствительности миофиламентов
- Фармакомеханическое и электромеханическое сопряжение
- Расслабление гладкой мускулатуры
- Миогенное возбуждение
- Миогенный тонус и миогенные ритмы
- Механическая роль тонуса
- Коротко
- Список использованной литературы
а) Сопряжение возбуждения и сокращения. Тонус гладкой мускулатуры регулируется возбуждающими и тормозными сигналами, которые могут быть миогенными, механическими, нейрогенными или гуморальными. Интеграция влияния внеклеточных сигналов в клетке осуществляется сетью медиаторов (и вторичных посредников).
1. Регуляция мышечного тонуса. Тонус гладких мышц регулируется по-разному:
- пейсмекерными клетками (миогенный тонус) (см. далее);
- механическим растяжением (см. далее);
- медиаторами вегетативной (автономной) нервной системы;
- гормонами, циркулирующими в крови, и многочисленными тканевыми гормонами;
- локальными метаболитами, прежде всего в кровеносных сосудах;
- веществами, высвобождаемыми эндотелием.
Нейромедиаторы и гормоны связываются со специфическими рецепторами (которые различны для конкретных гладкомышечных клеток) и таким образом активируют внутриклеточные каскады передачи сигнала.
В зависимости от типа рецептора и внутриклеточных сигнальных каскадов, запускаемых при его активации, гормон или нейромедиатор может опосредовать эффект сокращения или расслабления (например, норадреналин способен вызывать сокращение при взаимодействии с α1-адренорецепто-рами, но обеспечивает расслабление, если связывается с β2-адренорецепторами).
2. Внутриклеточные сигнальные каскады. Так же как при возбуждении скелетных мышц, активация гладкой мышцы определяется повышением концентрации Са2+ в цитоплазме клетки.
Однако циклическая деятельность миозиновых поперечных мостиков и тонус гладкой мускулатуры могут регулироваться не только внутриклеточной концентрацией Са2+.
Тормозный либо активирующий характер поступающего входного сигнала значительно больше зависит от сети внутриклеточной передачи сигналов, состоящей из вторичных посредников, таких как Са2+, цАМФ, цГМФ, а также ряда протеинкиназ (например, Rho-киназы и протеинкиназы С).
Именно в этой сети внутриклеточной передачи происходит «вычисление» и «смысловая интеграция» различных исходных сигналов.
б) Активация сокращения. Активность поперечных мостиков миозина в гладких мышцах запускается в результате фосфорилирования легких цепей миозина; степень фосфорилирования регулируется Са2+-активированной киназой легких цепей миозина и фосфатазой миозина.
1. Фосфорилирование легких цепей миозина. Поскольку гладкие мышцы не содержат Са2+-связывающий белок тропонина, запуск рабочего цикла поперечных мостиков осуществляется не с помощью аллостерического механизма, а в результате ковалентной модификации, а именно Са2+-зависимого фосфорилирования регуляторных легких цепей миозина (рис. 1).
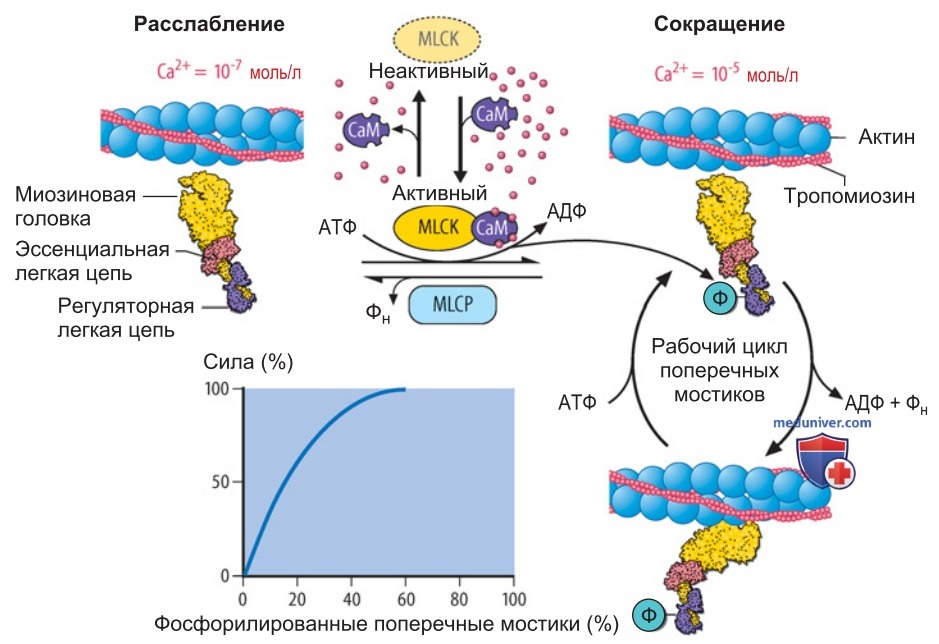
Фосфорилирование миозина регулируется двумя разнонаправленно действующими ферментами — Са2+-активируемой киназой легких цепей миозина MLCK (myosin light chain kinase) и специфической фосфатазой легких цепей миозина MLCP (myosin light chain phosphatase).
Последующее развитие напряжения гладкой мышцы (тонус) зависит от количества фосфорилированных глобулярных головок легких цепей миозина (рис. 1). При этом гладкая мышца часто остается в переходном состоянии механического напряжения и фосфорилирования, поскольку реакции фосфорилирования и дефосфорилирования находятся в динамическом равновесии (рис. 2).
Если преобладает активность MLCK, то возрастают количество фосфорилированного миозина и мышечный тонус; если же преобладает активность MLCP, то происходит дефосфорилирование миозина и мышечный тонус снижается, т. е. наступает расслабление.
2. Активация MLCK ионами Са2+. Если при возбуждении гладкой мышцы концентрация Са2+ в цитоплазме достигнет ~10-6 М, то Са2+ связывается с кальмодулином (4 моля Са2+/1 моль кальмодулина), вследствие чего изменяется конформация этого белка. Комплекс Са2+ — кальмодулин взаимодействует с MLCK (рис. 1).
Возникает активный комплекс Са2+ — кальмодулин — MLCK, который опосредует передачу фосфатной группы от АТФ регуляторным легким цепям миозина. Фосфорилированный миозин взаимодействует с актином; при расщеплении АТФ сформировавшиеся поперечные мостики совершают свой рабочий цикл подобно тому, как это происходит в скелетной мышце, только гораздо медленнее.
P.S. Тонические сокращения. При длительных тонических сокращениях скорость фосфорилирования миозина несколько снижается, но мышечный тонус может сохраняться, поскольку дефосфорилированные поперечные мостики теряют способность отсоединяться от актина. Одновременно резко уменьшается частота рабочих циклов поперечных мостиков, благодаря чему обеспечивается значительная экономия энергии.
Такое экономное состояние тонического сокращения получило название феномена «защелки» (latch). Механизм длительного закрепления поперечных мостиков пока не выяснен. Возможно, связывание дефосфорилированных поперечных мостиков с актином регулируют белки кальдесмон и/или кальпонин.
в) Модуляция Са2+-чувствительности миофиламентов. Активность фосфатазы легких цепей миозина (MLCP) и киназы легких цепей миозина (MLCK) регулируется различными сигнальными каскадами, не зависящими от Са2+. При этом модулируется чувствительность миофиламентов к Са2+.
1. Чувствительность к Са2+. При нейрогуморальной стимуляции гладкой мускулатуры дополнительно регулируется способность миофиламентов взаимодействовать с Са2+ (Са2+-чувствительность). Мерой Са2+-чувствительности служит концентрация Са2+, вызывающая сокращение, сила которого составляет 50% от максимальной силы.
При высокой Са2+-чувствительности сокращение такой силы наблюдается под влиянием гораздо более низкой концентрации Са2+, чем при низкой Са2+-чувствительности. Повышение Са2+-чувствительности является следствием более низкой активности MLCP, при которой возрастает количество фосфорилированного миозина.
В такой ситуации укорочение сократительных белков возникает при существенно более низкой миоплазматической концентрации Са2+, чем в условиях высокой активности MLCP. Следовательно, здесь можно говорить о сенситизации к Са2+. Напротив, повышение активности MLCP, опосредованное циклическими нуклеотидами, или подавление MLCK (например, через посредство СаМ-киназы II) сопровождается десенситизацией к Са2+.
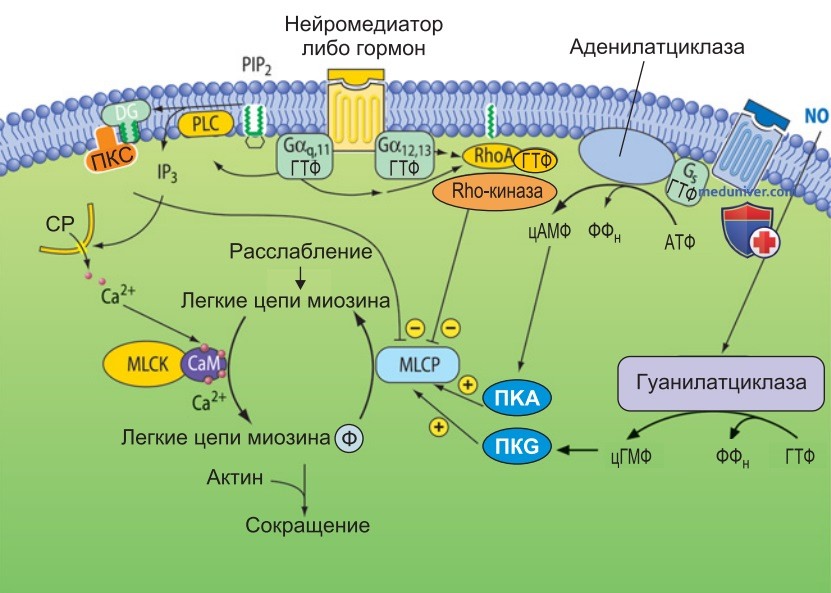
2. Сигнальные каскады, обеспечивающие сен-ситизацию к Са2+. Механизмы, ответственные за снижение активности MLCP, пока не вполне выяснены. По-видимому, активность MLCP подавляется протеинкиназой С и сигнальным каскадом Rhо/Rhо-киназы (рис. 2). Эти сигнальные каскады начинают действовать, когда медиаторы вегетативной нервной системы, а также циркулирующие или местные гормоны (ангиотензин II, вазопрессин, окситоцин, серотонин) путем связывания со специфичными белками клеточной мембраны активируют гетеротримерные G-белки семейств Gαq,11 или GaGα12,13.
Со своей стороны эти G-белки активируют фосфатазу С и/ или мономерную Rho-ГТФазу (рис. 2).
3. Фосфолипаза С расщепляет фосфолипид клеточной мембраны PIP2 на IP3 и диацилглицерол (DG). IP3 высвобождает Са2+ из саркоплазматического ретикулума, в то время как DG активирует протеинкиназу. Протеинкиназа С фосфорилирует CPI-17, который в качестве фосфопротеина тормозит MLCP.
Мономерная Rho-ГТФаза относится к суперсемейству Ras-подобных ГТФаз. Так же как другие гетеротримерные G-белки, Rho-ГТФаза совершает циклические переходы между ГДФ-связанным (неактивным) и ГТФ-связанным (активным) состояниями. Активный Rho, в свою очередь, активирует Rho-киназу, которая фосфорилирует регуляторную субъединицу MLPC, вследствие чего ее активность снижается.
В результате этих процессов нейрогуморальные агонисты вызывают сокращение гладких мышц не только посредством высвобождения Са2+ и активации MLCK, но и путем подавления активности MLCP.
4. Сигнальные каскады, обеспечивающие десенситизацию к Са2+. При активации сигнальных каскадов, инициирующих расслабление гладкой мускулатуры, в миоплазме может увеличиваться концентрация цАМФ (например, при стимуляции соответствующих рецепторов адреналином, простациклином или аденозином) либо концентрация цГМФ (эффект оксида азота). Циклические нуклеотиды активируют соответствующие протеин-киназы (протеинкиназу А или G) (рис. 2).
Как правило, в результате снижается, во-первых, мио-плазматическая концентрация Са2+ и, во-вторых, Са2+-чувствительность. Последний эффект основан на том, что цГМФ/ПКG и, вероятно, цАМФ/ПКА повышают активность MLCP. В итоге возрастает количество дефосфорилированного миозина и гладкая мышца расслабляется даже в случае высокой концентрации Са2+.
P.S. Каким образом циклические нуклеотиды повышают активность MLPC, пока не выяснено. С одной стороны, обсуждается возможность выключения пути Rho-Rho-киназы. С другой стороны, в экспериментах in vitro показано, что ПКА может снижать Са2+-чувствительность посредством торможения MLCK. Однако в свете новых научных данных вопрос о том, действует ли этот механизм в живом организме, кажется спорным.
Тем не менее он представляет интерес, поскольку с исторической точки зрения это первый пример регуляции Са2+-чувствительности. Торможение MLCK может также вызывать Са2+-активированная СаМ-киназа II; отсюда следует предположение, что Са2+ может лимитировать активацию MLCK.
P.S. Спастические сокращения коронарных сосудов:
- Симптомы. Спастические сокращения коронарных сосудов, особенно если они уже сужены вследствие атеросклероза, могут инициировать приступ стенокардии. Такой приступ характеризуется внезапными сильными загрудинными болями с иррадиацией в левую руку.
- Лечение. Используются сосудорасширяющие препараты: Са2+-антагонисты, снижающие миоплазматическую концентрацию Са2+, или нитраты, которые повышают содержание цГМФ. Появились сведения о возможности патологического повышения активности Rho-киназы. Проводятся клинические испытания терапевтического применения ингибиторов Rho-киназы.
г) Содержание Са2+ в гладкомышечных клетках. Концентрация Са2+ в миоплазме определяется ионными токами в саркоплазматическом ретикулуме и в клеточной мембране.
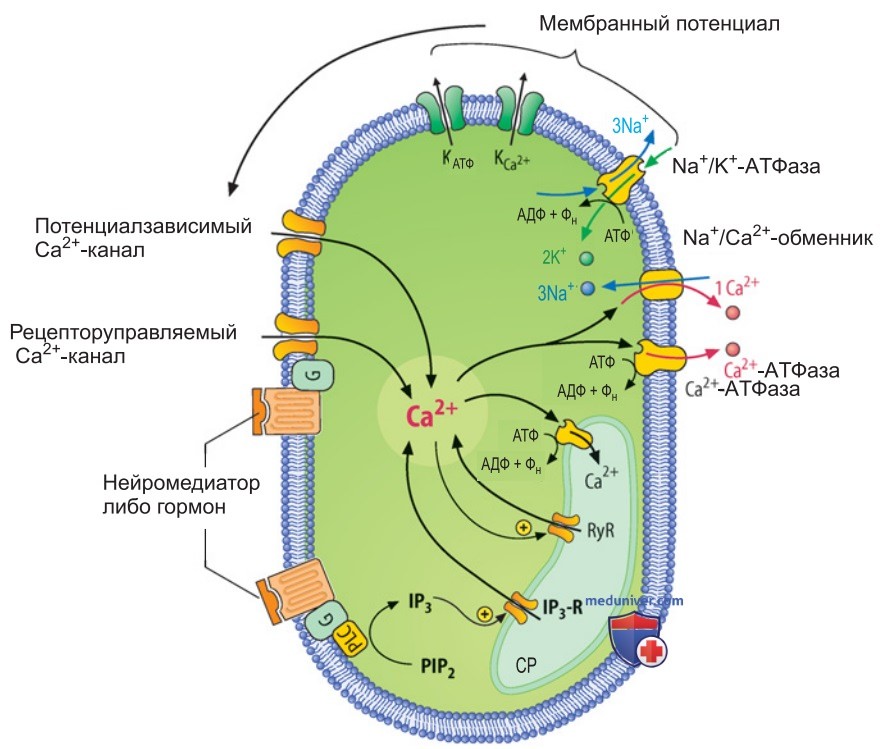
- Механизмы транспорта Са2+. Концентрацию Са2+ в миоплазме регулируют различные структуры. На рис. 3 представлены механизмы транспорта Са2+, которые обеспечивают повышение или снижение миоплазматической концентрации Са2+. Это Са2+-каналы клеточной мембраны и СР, Na+/Са2+-обмен, а также Са2+-насосы клеточной мембраны и СР, зависимые от энергии расщепления АТФ.
Опосредованно участвуют К+-каналы и Na+/K+-АТФаза. которые влияют на уровень мембранного потенциала и тем самым определяют открывание потенциалзависимых Са2+-каналов клеточной мембраны.
В расслабленной мышечной клетке (в состоянии покоя) концентрация Са2+ может достигать ~10-7 моль/л. При возбуждении гладкомышечной клетки концентрация Са2+ в миоплазме повышается до ~10-6 моль/л в результате его поступления из межклеточного пространства, а также высвобождения из СР. После латентного периода (длящегося ~300 мс) возникает реакция сокращения. Латентный период здесь более длительный, чем в скелетной мышце, так как активация рабочего цикла поперечных мостиков происходит медленнее, в несколько этапов.
д) Фармакомеханическое и электромеханическое сопряжение. Существует два механизма сопряжения возбуждения и сокращения: фармакомеханическое и электромеханическое. Отчасти они перекрывают друг друга.
1. Фармакомеханическое сопряжение. Такое сопряжение осуществляется фармацевтическими препаратами, нейромедиаторами или гормонами; первоначально они не оказывают влияние на мембранный потенциал или вызывают лишь очень небольшое его изменение. Однако в результате взаимодействия агониста с мембранными рецепторами открываются лигандуправляемые (рецепторактивируемые) Са2+-каналы клеточной мембраны и в миоплазму входит Са2+ из внеклеточного пространства.
Кроме того, образуется внутриклеточный медиатор (мессенджер) инозитолтрифосфат (IP3) (см. выше), который высвобождает Са2+ из СР (рис. 3).
P.S. В случае фармакомеханического сопряжения прирост миоплазматической концентрации Са2+, обеспечиваемый IP3, часто бывает кратковременным, а затем концентрация Са2+ падает до более низкого уровня. Однако мышечная сила удерживается на прежнем уровне либо уменьшается, но незначительно; при этом концентрация Са2+ не снижается благодаря процессам Са2+-сенситизации миофиламентов (см. выше).
2. Электромеханическое сопряжение. Движущей силой для повышения внутриклеточной концентрации Са2+ являются потенциалы действия либо продолжительная деполяризация плазматической мембраны (рис. 3). В результате воздействия этих факторов открываются потенциалзависимые Са2+-каналы, через которые ионы Са2+ входят из внеклеточного пространства в миоплазму.
Изменение мембранного потенциала имеет миогенную либо нейрогенную природу и может блокироваться антагонистами Са2+ (блокаторами Са2+-каналов) или агонистами K+ (соединениями, образующими селективные К+-каналы).
P.S. Гладкие мышцы различаются по электрической возбудимости. Например, гладкомышечные клетки кишечника и некоторых кровеносных сосудов обладают спонтанной активностью (пейсмекерные клетки), тогда как гладкие мышцы других органов вообще лишены электрической возбудимости.
3. Зависимость мембранного потенциала от К+-каналов. В гладкомышечных клетках резистивных (прекапиллярных) сосудов К+-каналы опосредуют регуляцию мембранного потенциала, составляющего от -40 до -60 мВ. При открывании К+-каналов клеточная мембрана гиперполяризуется; в результате закрываются потенциалзависимые Са2+-каналы и сосуды расширяются. Ингибирование активности К+-каналов, напротив, сопровождается деполяризацией мембраны, открыванием потенциалзависимых Са2+-каналов и сужением сосудов.
При сдвиге мембранного потенциала всего лишь на 3 мВ в сторону гиперполяризации или деполяризации вход Са2+ через потенциалзависимые Са2+-каналы уменьшается или увеличивается (соответственно) приблизительно в 2 раза. Таким образом даже небольшие изменения мембранного потенциала существенно влияют на диаметр сосудов и, следовательно, на кровообращение в органах и кровяное давление в организме.
P.S. Типы К+-каналов. Пока в гладкомышечных клетках обнаружено 4 типа К+-каналов. Два типа, КCa-каналы и КАТФ-каналы, открываются под влиянием агонистов, повышающих уровень цАМФ или цГМФ в миоплазме. КCa-каналы, которые также активируются при высокой внутриклеточной концентрации Са2+, вероятно, ограничивают спазм сосудов, вызываемый растяжением (эффект Бейлиса).
КАТФ-каналы участвуют в расширении резистивных сосудов, возникающем вследствие накопления продуктов метаболизма при интенсивной деятельности органов.
е) Расслабление гладкой мускулатуры. Гладкие мышцы расслабляются при дефосфорилировании миозина. Это происходит, когда прекращается электрическая или нейрогуморальная активность, а также когда агонисты тормозных рецепторов вызывают гиперполяризацию плазматической мембраны или повышают внутриклеточный уровень цАМФ либо цГМФ.
1. Дефосфорилирование миозина. Для расслабления гладкой мускулатуры должно произойти дефосфорилирование миозина. При снижении концентрации Са2+ в миоплазме комплекс Са2+-кальмодулин-MLCK диссоциирует на неактивные компоненты. Под действием фосфатазы миозина дефосфорилируются регуляторные легкие цепи миозина. Рабочий цикл поперечных мостиков прекращается.
Концентрация Са2+ в миоплазме всегда падает при прекращении возбуждающей либо нейрогуморальной активности, гиперполяризации клеточной мембраны под влиянием агонистов тормозных рецепторов, а также удалении Са2+ из миоплазмы посредством транспортных процессов (рис. 3).
2. Циклические нуклеотиды. Гормоны и нейромедиаторы, которые через посредство Gαs- белка активируют фермент аденилатциклазу или высвобождают оксид азота (NO) из эндотелия и некоторых вегетативных нервов, вызывают расслабление гладких мышц. Поскольку одновременно в миоплазме повышается концентрация циклических нуклеотидов цАМФ или цГМФ, это явление называют активным расслаблением. Оба циклических нуклеотида обеспечивают дефосфорилирование миозина и расслабление гладкой мускулатуры в результате Са2+-десенситизации.
Вместе с тем эти нуклеотиды снижают концентрацию Са2+ в миоплазме путем воздействия на различные мишени — К+-каналы, а также Са2+-насосы саркоплазматического ретикулума, активность которых возрастает благодаря фосфорилированию регуляторного белка фосфоламбана.
ж) Миогенное возбуждение. Многие гладкомышечные клетки проявляют спонтанную активность; миогенное возбуждение, генерируемое пейсмекерными клетками, передается через щелевые контакты (нексусы) на другие гладкомышечные клетки.
1. Потенциалы пейсмекерных клеток. Потенциалы действия возникают в гладкомышечных клетках унитарного типа аналогично тому, как генерируется миогенная активность в пейсмекерных клетках миокарда. Эти клетки отличаются от других мышечных клеток не структурой, а электрофизиологическими характеристиками. Потенциалы пейсмекерных клеток (препотенциалы) деполяризуют мембрану до порогового уровня, тем самым вызывая потенциалы действия (спайки), которые распространяются по гладкой мускулатуре благодаря Са2+-каналам, а не Na+-каналам.
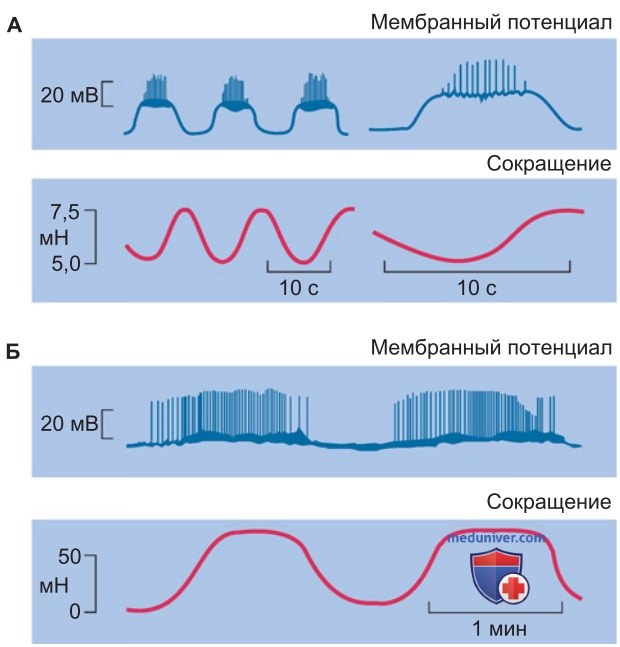
В результате входящих Са2+-токов мембрана сначала деполяризуется, а затем в течение нескольких миллисекунд реполяризуется до 20 мВ. За реполяризацией следует препотенциал, который вновь вызывает разряд потенциалов действия (рис. 4). Препараты-антагонисты Са2+ (например, нифедипин) могут блокировать Са2+-каналы L-типа, обеспечивающие эти потенциалы действия, и таким образом подавлять сокращения.
2. Щелевые контакты. Через низкоомные щелевые контакты, или нексусы (gap junctions), деполяризация может электротонически распространяться от возбужденной клетки к соседней. Когда в результате местного тока, поступающего через щелевой контакт, деполяризация мембраны соседней клетки достигнет порогового уровня, в ней возникнет потенциал действия (импульс), который может вызвать возбуждение других электротонически сопряженных мышечных клеток.
з) Миогенный тонус и миогенные ритмы. Импульсный разряд вызывает сокращение гладких мышц, его интенсивность зависит от частоты потенциалов действия и ритмически флуктуирует; миогенный мышечный тонус модулируется вегетативной (автономной) нервной системой.
1. Миогенный тонус. Разряды потенциалов действия вызывают сокращение (миогенный тонус), который можно сравнить с тетанусом (рис. 4). Интенсивность сокращения зависит от частоты потенциалов действия. Спонтанная активность пейсмекерных клеток модулируется вегетативной нервной системой. В кишечнике ацетилхолин повышает частоту потенциалов действия, в то время как под влиянием адреналина и норадреналина частота снижается, поскольку эти вещества гиперполяризуют клеточную мембрану. Таким образом нейромедиаторы ацетилхолин и норадреналин модулируют миогенный тонус мускулатуры кишечника.
2. Ритмические колебания тонуса. Благодаря спонтанным изменениям активности пейсмекерных клеток периодически возникают ритмические колебания миогенного тонуса. Продолжающаяся в течение нескольких секунд или минут деполяризация мембраны пейсмекерных клеток (медленная волна) прекращается, когда ее амплитуда достигнет порога активации потенциалзависимых Са2+-каналов. В результате генерируется импульсный разряд («кальциевые спайки»), который приводит к сокращению. Далее следует пауза, пока очередной разряд потенциалов действия не вызовет следующее сокращение (рис. 4).
3. Органоспецифичные базальные ритмы. Механизм возникновения миогенных ритмов не вполне ясен. Они ассоциируются с конкретной функцией органов: ритмические изменения кровяного давления (частота 6/мин), перистальтика желудка (3/мин) и сегментарные сокращения тонкого кишечника (12/мин в двенадцатиперстной кишке).
P.S. Синдром раздраженного кишечника. К наиболее распространенным патологиям желудочно-кишечного тракта относится синдром раздраженного кишечника, при котором нарушается его сократительная способность. Вероятно, в ее основе лежит дисфункция клеток водителя ритма кишечника, обеспечивающих миогенный тонус.
и) Механическая роль тонуса. При механическом растяжении некоторых гладких мышц может происходить активное повышение их тонуса; другие гладкие мышцы при растяжении ведут себя пассивно, т. е. после первоначального повышения за счет эластичности мышц напряжение снова снижается.
1. Механическое растяжение. При усиливающемся растяжении спонтанно активных мышц возрастает деполяризация пейсмекерных клеток и, следовательно, повышается частота потенциалов действия. Как говорилось выше, при более высокой частоте импульсного разряда сокращение усиливается. Сокращение, активируемое растяжением (эффект Бейлиса), играет важную роль в местной саморегуляции артериол.
2. Снятие напряжения. Другие гладкие мышцы ведут себя при растяжении пассивно, как пластичные или вязкоэластичные тела: мышечное напряжение в начале возрастает, затем при сохранении постоянной длины мышцы вновь снижается (снятие напряжения), вначале быстро, затем все медленнее. Благодаря свойству пластичности гладкая мышца может быть полностью расслаблена как в укороченном, так и в растянутом состоянии. Например, пластическая упругость мочевого пузыря при его заполнении препятствует чрезмерному повышению внутреннего давления.
к) Коротко. Регуляция сокращения гладкой мускулатуры. Тонус гладкой мускулатуры обусловлен следующими факторами: поступающими от пейсмекерных клеток потенциалами действия (электромеханическим сопряжением); медиаторами вегетативной нервной системы; циркулирующими гормонами, а также многочисленными тканевыми гормонами с их специфическими мембранными рецепторами (фармакомеханическим сопряжением); механическим растяжением.
При активации сокращения гладких мышц ионы Са2+ входят в миоплазму через потенциалзависимые или лигандуправляемые Са2+-каналы клеточной мембраны и Са2+-каналы СР. Ионы Са2+ связываются с кальмодулином; комплекс Са2+-кальмодулин активирует киназу легких цепей миозина, которая фосфорилирует легкие цепи миозина; гладкая мышца сокращается. Наряду с этими процессами при нейрогуморальной активации, происходящей посредством ПКС и Rho-киназы, а также ингибирования MLCP, повышается чувствительность к Са2+.
При расслаблении гладких мышц легкие цепи миозина дефосфорилируются и ионы Са2+ удаляются из миоплазмы путем обмена Na+/Ca2+, а также благодаря Са2+-насосам клеточной мембраны и СР. Расслабление мышцы может происходить за счет агонистов, которые повышают в мышечных клетках уровень цАМФ либо цГМФ. В результате падает миоплазматическая концентрация Са2+ и снижается чувствительность к Са2+.
Видео лекция гистология мышечной ткани (гладкой, поперечнополосатой, сердечной)
- Вернуться в раздел "Физиологии человека"
Редактор: Искандер Милевски. Дата публикации: 17.10.2024

