Молекулярные механизмы сокращения поперечно-полосатых мышц - с точки зрения физиологии человека
Оглавление статьи:- Модель скользящих нитей
- Молекулярный механизм сокращения
- Регуляция взаимодействия актина и миозина
- Коротко
- Список использованной литературы
а) Модель скользящих нитей. Мышца сокращается в результате выдвижения пучков тонких и толстых филаментов относительно друг друга (по принципу телескопического — «шарикового» механизма); при удлинении мышечного волокна титиновая нить растягивается.
1. Сокращение саркомеров. Сокращение мышцы происходит благодаря изменению длины многочисленных саркомеров, которые последовательно друг за другом включены в миофибриллы (рис. ниже). Во время сокращения саркомера тонкие филаменты втягиваются между миозиновыми филаментами по направлению к М-линии (модель скользящих нитей).
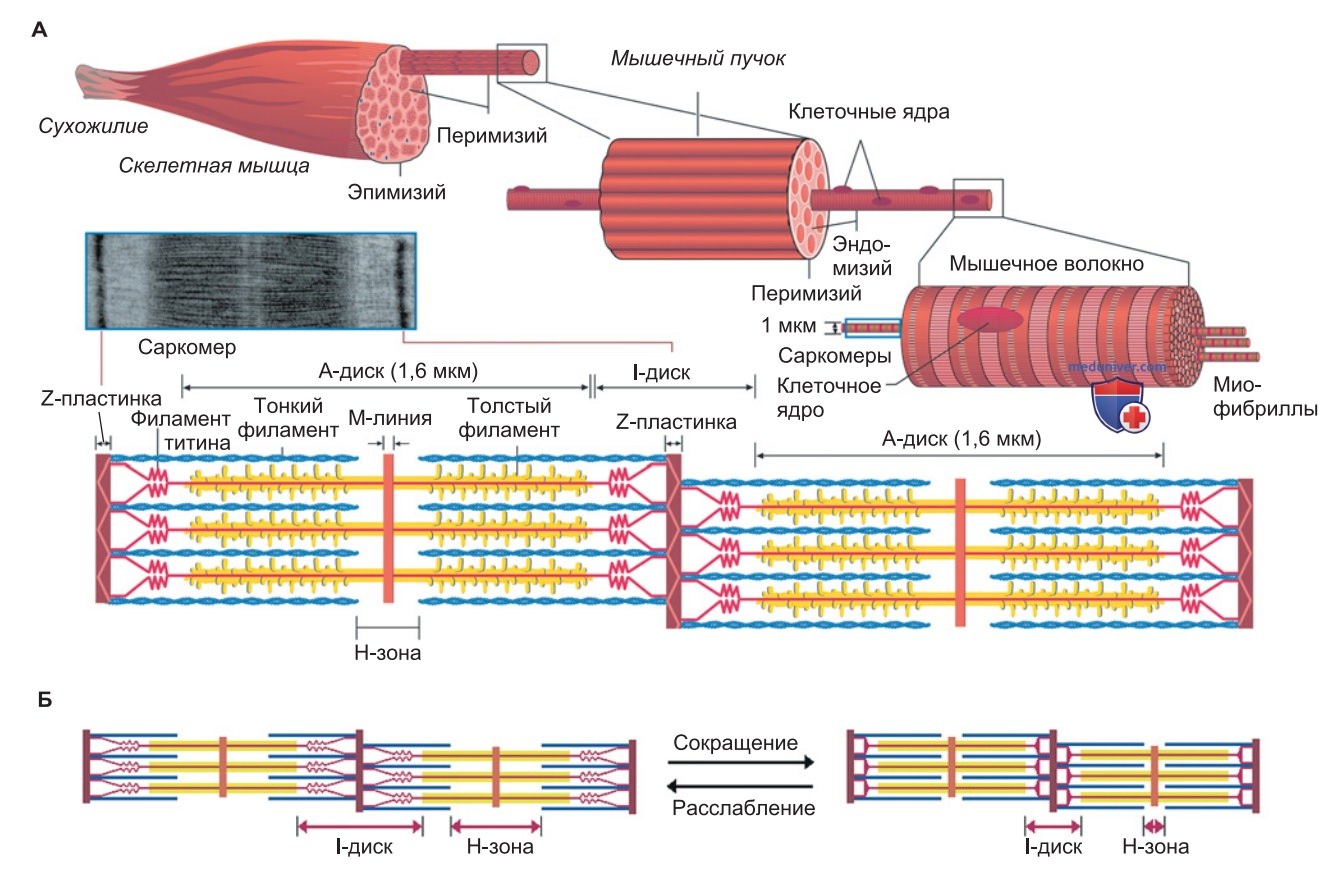
Важно отметить, что при этом длина самих филаментов, толстых и тонких, не изменяется. Наблюдение за саркомером через микроскоп позволяет утверждать, что при его сокращении длина А-дисков остается постоянной (1,6 мкм), в то время как длина I-дисков и Н-зон уменьшается.
2. Растяжение саркомеров. Длина актиновых и миозиновых филаментов не изменяется и при растяжении миофибрилл. Чем больше тонкие филаменты выдвигаются из пучка толстых филаментов, тем значительнее уменьшается степень перекрывания филаментов; следовательно, I-диск и Н-зона расширяются (рис. выше).
Сцепление между толстыми и тонкими филаментами обеспечивают прежде всего титиновые тяжи, от которых зависит и эластичность мышцы. Растяжение титинового волокна создает пассивную силу, на долю которой приходится часть пассивного натяжения мышцы.
б) Молекулярный механизм сокращения. Сила, развиваемая при сокращении, возникает в результате циклического связывания миозиновых головок с актином, во время высвобождения энергии расщепления АТФ.
1. Функциональная роль поперечных мостиков. В процессе сокращения мышцы каждая миозиновая головка может прикрепляться (наподобие «поперечного мостика») к ближайшему актиновому филаменту. Процесс связывания и освобождения поперечного мостика имеет циклический характер и снабжается энергией, которую обеспечивает расщепление молекулы АТФ, соединенной с миозиновой головкой.
По-видимому, в каждом рабочем цикле поперечного мостика распадается одна молекула АТФ. Запуск рабочего цикла поперечного мостика, осуществляемый с участием донора энергии АТФ, схематично представлен на рис. 1.
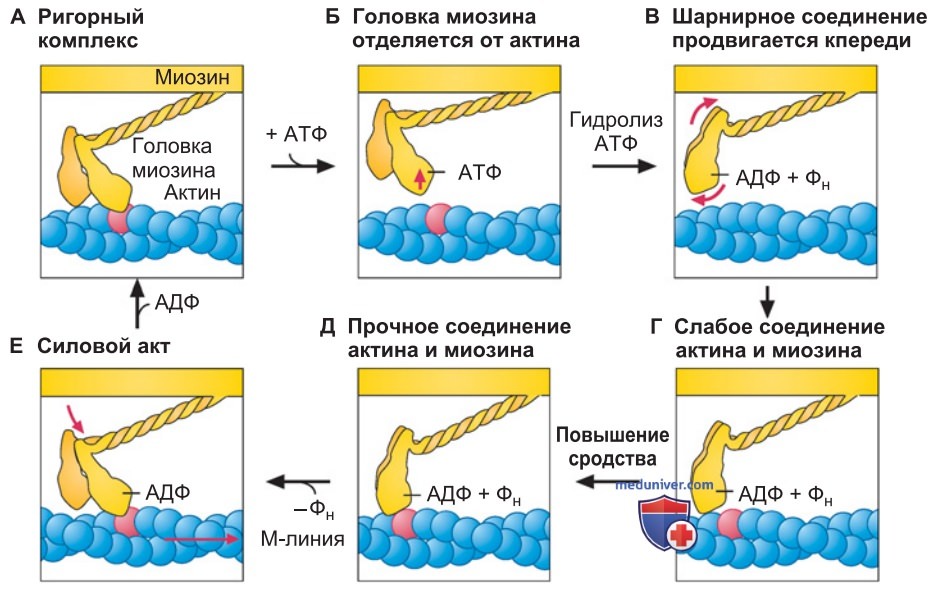
2. Цикл поперечных мостиков. Считается, что после завершения рабочего цикла поперечного мостика молекула АТФ (в виде комплекса Mg-АТФ) остается прикрепленной к миозиновой головке (рис. 1). После этого миозиновая головка отсоединяется от актина (рис. 1). АТФ расщепляется до АДФ и фосфата (Фн), однако эти продукты остаются на короткое время связанными с каталитическим центром (рис. 1).
Гидролиз АТФ и сдвиг шарнирного соединения кпереди составляют необходимое условие подготовки к новому акту связывания миозиновой головки с актином. Поначалу миозин связывается с актином с низким сродством (рис. 1), затем сродство комплекса актин—миозин повышается (рис. 1) и происходит отщепление Фн.
Генерируется силовой акт, во время которого шарнирное соединение субфрагмента S-1 поворачивается и прикрепленный актиновый филамент «шагает» на 5-10 нм в направлении М-линии (рис. 1). При этом генерируется сила до ~4 пН (пиконьютонов). После отделения АДФ система возвращается к исходному состоянию и цикл поперечных мостиков может быть повторен.
3. Трупное окоченение. Если содержание АТФ в мышечной клетке падает до нуля (после наступления смерти), поперечные мостики не отсоединяются, а остаются прикрепленными; возникает «ригидный комплекс» (рис. 1). Такое прочное, необратимое сцепление филаментов актина и миозина (пока не произойдет автолиз) свойственно трупному окоченению — rigor mortis. Способность АТФ ослаблять либо замедлять развитие жесткости соединения получила название «размягчающее действие АТФ».
P.S. Частота циклов и активации АТФазы миозина. Рабочие циклы поперечных мостиков повторяются от ~10 до 100 раз в секунду в соответствии с частотой активации АТФазы миозина (частотой расщепления АТФ в единицу времени). В поперечно-полосатых мышцах присутствуют по крайней мере семь изоформ тяжелых цепей миозина, различающихся прежде всего АТФазной активностью. При более высокой активности возрастает число поперечных мостиков, активирующихся в единицу времени, а также мышечная сила и скорость укорочения мышцы.
Таким образом, между частотой расщепления АТФ и скоростью укорочения мышцы существует корреляция.
4. Преобразование деятельности поперечных мостиков в макроскопическое движение. При однократной активации поперечных мостиков саркомер укорачивается только два раза по 10 нм, т. е. на ~1% своей длины. Саркомер способен очень быстро укорачиваться на 0,4 мкм, т. е. на 20% от своей длины. Это возможно благодаря многократным последовательным гребковым движениям поперечных мостиков, причем каждый раз в новом месте вдоль актинового филамента.
В результате актиновые филаменты левой и правой половины саркомера подтягиваются навстречу друг к другу по направлению к М-линии (благодаря биполярному расположению миозиновых молекул; рис. выше).
Реализация этого механизма в тысячах саркомеров приводит к тому, что повторяющаяся активность поперечных мостиков (которая обычно не бывает синхронной) преобразуется в макроскопическое движение. Возникающее усилие распространяется к Z-пластинкам и периферическим частям клетки, а в конечном итоге — к сухожилиям и скелету.
5. Цикл поперечных мостиков при развитии силы без сокращения мышцы. При изометрическом сокращении длина мышцы не изменяется, несмотря на то что генерируется сила и совершается цикл поперечных мостиков. В этой ситуации миозиновые головки остаются постоянно прикрепленными к одним и тем же связывающим сайтам актиновых филаментов. Предполагается, что благодаря амортизационным свойствам последовательно соединенных эластичных филаментов накапливается механическая энергия в субфрагменте S-2.
в) Регуляция взаимодействия актина и миозина. Тропонин и тропомиозин регулируют активность поперечных мостиков посредством изменений концентрации ионов Са2+: при снижении [Са2+] взаимодействие актина и миозина ингибируется, при повышении активируется.
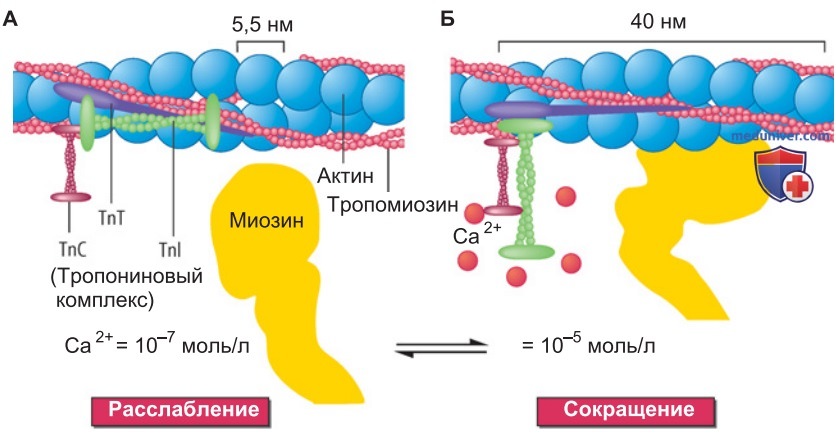
1. Роль ионов Са2+. Цикл поперечных мостиков не может продолжаться непрерывно даже при наличии достаточного количества АТФ; иначе мышцы все время находились бы в состоянии сокращения. Следовательно, изменения концентрации Са2+ в саркоплазме регулируют циклическую деятельность поперечных мостиков в миофибриллах. При очень низких значениях [Са2+] (порядка 10-7 моль/л) регуляторные белки тропонин и тропомиозин, которые находятся в тонком филаменте (рис. 2), ингибируют генерацию силового акта («рабочего хода») поперечных мостиков; в первую очередь это относится к слабо прикрепленным миозиновым головкам.
Только после того, как прикрепление всех миозиновых головок ослабевает или они отсоединяются, происходит расслабление мышцы; она теряет силу и упругость. В том случае, когда [Са2+] повышается до 10-6-10-5 моль/л, миозиновые мостики прикрепляются к актину и развивают силу.
2. Тропонин функционирует как «кальциевый переключатель». Механизм активирующего действия Са2+ легче понять при рассмотрении структуры тонких филаментов (рис. 2). Филамент длиной ~1 мкм состоит из двух актиновых мономеров (толщиной по 5,5 нм), спирально переплетенных наподобие двух ниток бус; каждый виток спирали включает в себя две нити по семь «бусин». На актиновом филаменте через регулярные промежутки по ~40 нм располагаются комплексы из трех субъединиц тропонина (TnC, TnI, TnT).
Актиновую спираль обвивает тропомиозин в виде скрученного двойного тяжа, проходящего в желобке спирали между двумя мономерами актина.
При очень низком значении концентрации Са2+ комплекс TnI и TnT вместе с тропомиозином выполняет функцию ингибирования цикла поперечных мостиков (рис. 2). Повышение концентрации Са2+ в 10-100 раз сопровождается очень прочным связыванием Са2+ с TnC (рис. 2). Происходит изомеризация субъединицы TnI; это, в свою очередь, изменяет конформацию субъединицы TnT, связывающей тропомиозин.
В результате двойные тяжи тропомиозина опускаются в желобки спирали, образованной мономерами актина; для миозиновых головок открывается доступ к сайтам связывания с актином. Теперь регуляторные белки тонких филаментов находятся в позиции, способствующей быстрому образованию поперечных мостиков. В случае продолжающегося расщепления АТФ рабочий цикл поперечных мостиков повторяется. Происходит активация мышцы.
Описанный процесс обратим. При снижении [Са2+] в цитозоле до ~10-7 моль/л рабочий цикл поперечных мостиков снова блокируется. И хотя при участии энергии АТФ поперечные мостики отсоединились от актина, они не могут снова переключиться, т. е. сделать гребковое движение. Мышца находится в расслабленном состоянии.
1. Механизм сокращения. При сокращении мышцы тонкие филаменты втягиваются в промежутки между толстыми филаментами, двигаясь по направлению к середине саркомера, причем длина филаментов не изменяется (модель скользящих нитей). В процессе взаимодействия миозиновых головок с актиновыми филаментами (рабочий цикл поперечных мостиков) генерируется усилие. Если мышцу растянуть, то филаменты снова выдвигаются (по аналогии с тем, как выдвигается труба телескопа!), а молекулы титина растягиваются.
2. Молекулярные основы. Активное развитие силы саркомеров обеспечивается благодаря молекулярному мотору — белку миозину II, обладающему свойствами АТФазы, а также наличию АТФ в качестве источника энергии. Для отсоединения поперечных мостиков между актином и миозином требуется связь АТФ с миозиновой головкой (такая связь препятствует трупному окоченению).
Взаимодействие актина и миозина регулируется концентрацией Са2+. При низкой концентрации Са2+ (10-7 моль/ л) в саркоплазме расслабленной мышцы регуляторные белки тропонин и тропомиозин ингибируют рабочий цикл поперечных мостиков. При высокой концентрации (10-6-10-5 моль/л) Са2+ прочно связывается с тропонином С; изменяется конформация комплекса тропонин-тропомиозин и активируются поперечные мостики.
Видео физиология мышц и мышечного сокращения - профессор, д.м.н. П.Е. Умрюхин
- Рекомендуем ознакомиться далее "Активация сокращения поперечно-полосатой мышцы - с точки зрения физиологии человека"
Редактор: Искандер Милевски. Дата публикации: 17.10.2024

