Этапы развития рака кожи вызванного ультрафиолетовым облучением
Опухоли кожи возникают на фоне ее повреждения солнечным светом. Для предотвращения повреждения солнцем кожа реагирует на острую и хроническую экспозицию УФО множеством стрессовых реакций.
а) Клеточные реакции на ультрафиолет:
1. Апоптоз. Передача сигналов, индуцированная УФ, приводит к образованию клеток солнечного ожога—базальных и супрабазальных кератиноцитов с плотными, пикнотическими ядрами и интенсивно эозинофильной цитоплазмой. Эти апоптотические морфологические характеристики сопровождаются формированием патогномоничных разрывов двух цепочек ДНК и расщеплением каспазы 3. УФО-индуцированный апоптоз требует наличия сигналов как от поврежденной ДНК, так и из цитоплазмы: фотопродукты ДНК в активных генах запускают р53 и его регулятор Mdm2, но апоптоз также требует JNK и частично блокируется антиоксидантами.
Хотя требуется ФНО-а, инъекция ФНО-а не приводит к образованию клеток солнечного ожога, поэтому УФ-индуцированная передача сигналов из цитоплазмы недостаточна. В фибробластах, кератиноцитах или меланоцитах с нормальным р53, облученных физиологическими дозами УФВ или УФС, апоптоз происходит скорее по внутреннему митохондриальному пути, чем по пути рецептор смерти/каспаза 8.
Кроме того, апоптоз предотвращает развитие рака путем удаления поврежденных УФО клеток, что называется «клеточным исправлением ошибок». У мышей с нарушением апоптоза вследствие дефекта р53 или Fas-лиганда, либо в результате избыточной экспрессии антиапоптотического протеина сюрвайвина (Survivin) мутации накапливаются с повышенной скоростью. В случае сюрвайвина увеличивается частота развития плоскоклеточного рака кожи (ПКР).
Гиперплазия эпидермиса, развивающаяся через несколько дней после экспозиции ультрафиолетового облучения (УФО), может возместить клетки, потерянные в результате апоптоза, или может удалить дополнительные поврежденные или мутантные клетки путем десквамации. Сигналом, включающим гиперплазию, являются фотопродукты ДНК и рецептор эпидермального фактора роста. УФА ингибирует УФВ-индуцированный апоптоз, следовательно, УФА может усиливать канцерогенез, препятствуя элиминации поврежденных ультрафиолетом клеток.
Фибробласты дермы играют ключевую роль в поддержании соответствующих реакций на УФО в эпидермальных кератиноцитах. Для адекватной индукции биологического старения кератиноцитов после УФО необходим инсулиноподобный фактор роста 1(IGF-1), который секретируется нормальными фибробластами человека. Индуцированное ультрафиолетом биологическое старение защищает кератиноциты от распространения индуцированных УФ-облучением мутаций.
В коже пожилых людей понижена экспрессия IGF-1 в дерме, и старые кератиноциты пролиферируют при наличии поврежденной ультрафиолетом ДНК, что, возможно, приводит к усилению канцерогенного потенциала в коже пожилых людей.
2. Популяции стволовых клеток. В коже человека, подвергающейся хроническому воздействию УФВ, клоны с мутантным р53 обнаруживаются в обоих сайтах стволовых клеток: в волосяном фолликуле, балдж-область которого обеспечивает развитие фолликула и временно участвует в заживлении ран, и в межфолликулярном эпидермисе, поддерживающем гомеостаз в эпидермисе, который также может участвовать в формировании фолликулов. Считается, что ПКР возникает из межфолликулярного эпидермиса, тогда как данные гистологических исследований и тип экспрессии РТСН указывают на то, что базальноклеточный рак кожи (БКР) возникает в фолликулах.
Передача сигналов по пути «hedgehog» посредством РТСН является ключевым фактором для поддержания популяции стволовых клеток в коже и для регуляции развития волосяного фолликула и сальной железы. В коже человека или мыши, подверженной хроническому УФ-облучению, содержатся разреженные базальные клетки с необычно высоким уровнем ДНК-фотопродуктов. Промотер опухоли ТРА (12-О-тетрадеканоилфорбол 13-ацетат), который индуцирует пролиферацию стволовых клеток, вызывает исчезновение этих клеток и замещение их кластерами кератиноцитов с мутацией р53.
Это поведение напоминает таковое у стволовых клеток, которые находятся в покое и плохо восстанавливаются по крайней мере по родительской цепочке ДНК, до получения команды на начало деления. Способствующий иммортализации фермент теломераза обычно присутствует только в базальном слое эпидермиса, но его содержание повышается в коже, подверженной инсоляции, в предраковых высыпаниях на коже и ткани рака.
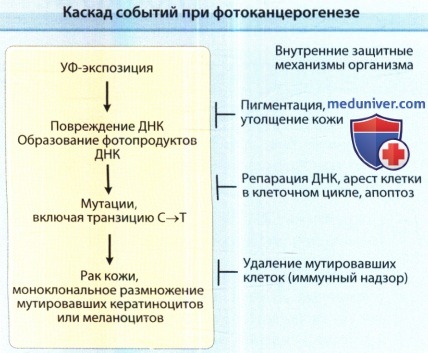
Воздействие ультрафиолетового (УФ) света вызывает характерное повреждение ДНК, а именно образование циклобутан пиримидина и 6,4-пиримидин-пиримидон фотопродуктов.
Они часто приводят к формированию мутаций с заменой одного основания или тандема оснований (С—>Т, СС->ТТ), которые характерны для ультрафиолетового облучения и поэтому называются мутациями, вызванными УФ-облучением.
При достаточном накоплении числа инактивирующих мутаций в ключевых генах (гены, подавляющие рост опухоли) отдельные клетки могут подвергаться злокачественной трансформации,
клонально размножаться и приводить к образованию злокачественных опухолей кожи.
Различные собственные защитные механизмы противостоят этой цепочке изменений.
3. Клональная экспансия мутантных клеток. Одна мутантная клетка должна клонально размножиться для достижения клинически значимого размера. Что менее очевидно, клональная экспансия содействует множественным генетическим ударным механизмам развития рака. Физиологические дозы УФО вызывают мутации с частотой примерно 10-4/ген за каждое деление клетки. Специфические мутации, необходимые для активации онкогена, наблюдаются реже. Спонтанные мутации, отражающие ошибки репликации ДНК или повреждение ДНК, сформировавшиеся в результате температуры тела, встречаются также редко, с частотой порядка 10-5.
Вероятность мутации пяти генов, таких как онкоген и два аллеля двух определенных супрессорных генов, в лучшем случае составляет 10-20.
Учитывая ожидаемую заболеваемость раком кожи в Австралии, которая составляет 60%, только на основании повреждения генетического материала в одной клетке, такая цифра была бы невозможной. Напротив, клональная экспансия увеличивает число мишеней для формирования следующей мутации в 1000 раз.
Клональная экспансия стволовых клеток обычно ограничивается компартментом стволовых клеток. Солнечный свет является ключевым двигателем клональной экспансии за пределы этой области. Клоны клеток с мутацией р53 в коже человека крупнее в участках, подвергающихся хронической инсоляции. У мышей, клоны с мутантным р53 перестают расти и регрессируют после окончания УФВ-воздействия, что указывает на экспансию клона вследствие индуцированного УФ-облучением физиологического явления, а не в результате необратимой мутации.
Одно из этих физиологических событий представляет собой индуцированный УФ апоптоз. При возникновении мутации р53 механизм клеточного исправления ошибок дает обратную реакцию: последующие эпизоды экспозиции УФО элиминируют поврежденные нормальные клетки, но сохраняют резистентные к апоптозу мутантные клетки. Резистентный к апоптозу мутант больше не ограничивается компартментом своих стволовых клеток и колонизирует чувствительный к апоптозу соседний компартмент. Повторение этого процесса приводит к квантовой клональной экспансии. Очаги АК также часто регрессируют после прекращения облучеия, но плоскоклеточные карциномы не регрессируют, следовательно, инвазивные опухоли не нуждаются больше в промоутере.
Таким образом, апоптоз оказывает различное воздействие на этапы прогрессии рака кожи: он препятствует первоначальному возникновению новых мутаций р53, облегчает экспансию мутантных по р53 клонов и папиллом (посредством гибели способных к апоптозу клеток, соседних с мутантными клонами) и подавляет мутации, которые трансформируют папиллому в плоскоклеточный рак кожи (ПКР).
б) Межклеточные взаимодействия при развитии рака кожи. Межклеточные взаимодействия предотвращают ненадлежащую пролиферацию патологических клеток. В экспериментах с аутотрансплантатами человека базалиомы, перенесенные из места их возникновения, регрессировали — это указывает на необходимость наличия патологически измененной дермы для персистирования опухоли. Дермальные фибробласты подавляют трансформированные кератиноциты путем сектреции трансформирующего фактора ростаф, индуцирующего дифференциацию в плоскоклеточный эпителий. Нормальные кератиноциты также подавляют своих трансформировавшихся соседей, а УФО влияет на эти сигналы. Нормальные кератиноциты человека элиминируют прилежащие мутировавшие кератиноциты (с мутацией по р53 и HRAS) путем индукции «ареста» клеточного цикла и дифференциации.
Физиологические дозы УФВ вызывают апоптоз и дифференциацию в нормальных клетках, но не в трансформировавшихся кератиноцитах, что позволяет последним клонально размножаться. Другие межклеточные сигналы опосредуются интегринами — мембранными рецепторами к белкам внеклеточного матрикса, таким как коллаген (α2β1, интегрин), ламинин (α3β1) и фибронектин (α5β1). В кератиноцитах интегрины, связанные с таким лигандом, обеспечивают сигнал «не дифференцироваться» посредством пути МАРК, подавляя апоптоз кератиноцитов и обеспечивая поддержание пула стволовых клеток. В опухолях функция рецепторов к интегрину часто нарушена.
Облучение УФВ подавляет субъединицу β1 интегрина. УФА подавляет взаимодействие белка коннексина 43 через щелевой контакт (нексус), аналогично действию промотера опухоли ТРА.
Пролиферация меланоцитов обычно регулируется кератиноцитами через рецепторы межклеточной адгезии, такие как Е-кадгерин, Р-кадгерин и десмоглеины; эти рецепторы утрачиваются при вертикальной фазе роста меланомы. УФО стимулирует секрецию кератиноцитами эдотеина-1, который подавляет Е-кадгерин меланоцитов и стимулирует их N-кадгерин. Это переключение Е-кадгерина на N-кадгерин перенаправляет взаимодействие меланоцитов и кератиноцитов на фибробласты и меланоциты.
Эндотелин также подавляет α6 субъединицу интегрина, стимулирует αvβ3, и α2β1 интегрины, которые закрепляют меланоциты на дермальном коллагене и ассоциируются с вертикальной фазой роста меланомы, подавляют взаимодействие через щелевидные контакты путем фосфорилирования коннексина 43 и активируют металлопротеиназы, связанные с инвазией в базальную мембрану.
в) Иммунный надзор как причина рака кожи. У людей основным доказательством участия иммунного надзора в предотвращении развития УФО-индуцированного рака кожи явились опубликованные данные о 10-20-кратном увеличении частоты развития актинического кератоза и ПКР на участках кожи, ранее подверженных действию солнечного света, у реципиентов трансплантатов, получающих хроническую иммуносупрессивную терапию для предотвращения отторжения трансплантата. В одном австралийском исследовании 27% летальных исходов в когорте пациентов с трансплантацией сердца были вызваны раком кожи. Это увеличение начинается через несколько месяцев или лет после начала иммуносупрессии, при этом АК и ПКР обычно отличаются агрессивным течением.
Частота развития меланомы также повышается. Имеется целый ряд доказательств значительной роли иммунного надзора. Циклоспорин усиливает рост опухоли in vitro и у мышей с иммунодефицитом в отсутствие подавления иммунной системы. Азатиоприн приобретает свойства мутагена, если за его приемом следует облучение-УФА. Следовательно, он может действовать не только посредством иммуносупрессии. У пациентов с ВИЧ отмечается умеренное увеличение частоты развития ИКР, но развитие этих опухолей на закрытых участках тела связано с вирусом папилломы человека (ВПЧ). Нередко рак кожи развивается у пациентов с лейкозом или лимфомой. Трудно интерпретировать тот факт, что эти пациенты часто принимали циклофосфамид, известный своими мутагенными свойствами. В большинстве опубликованных сообщений данные о контрольной группе или о пациентах отсутствуют, однако восьмикратное увеличение при хроническом лимфоцитарном лейкозе кажется валидным.
Карцинома клеток Меркеля, частично вызванная вирусом и УФ, может обладать истинной чувствительностью к функции иммунной системы. Ее частота возрастает в десять раз не только у реципиентов трансплантатов цельных органов, но и у пациентов с ВИЧ (в 13 раз) и при хронической лимфоцитарной лейкемии (более чем в 30 раз) (см. главу 120). Вероятность метас-тазирования и летального исхода при всех типах иммуносупрессии у пациентов также увеличивается. Очень большое значение имеет тщательное наблюдение пациентов с повышенным риском развития рака кожи независимо от причины иммуносупрессии, так как, даже у больных с иммуносупрессией при раннем выявлении, опухоли излечимы.
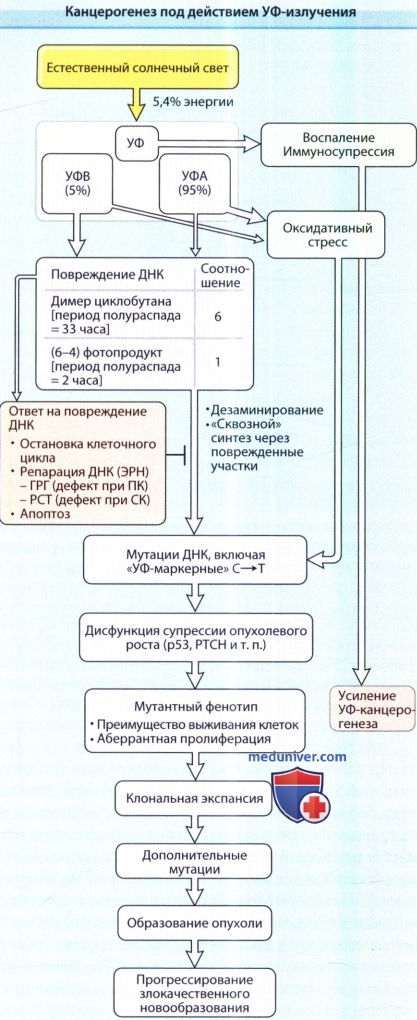
УФ-излучение вызывает два основных типа повреждений ДНК на дипиримидиновых сайтах: образование циклобутан-пиримидиновых димеров (ЦПД) и пиримидин-пиримидон-(6-4)-фотопродукты [(6—4)ППФ].
Приводимое соотношение этих продуктов для искуственного света составляет 6 ЦПД на 1 (6-4) ППФ].
На УФВ приходится только около 5% УФ-изличения (0,3% всей земной солнечной энергии), однако именно этим диапазоном обусловлено большинство УФ-индуцированных повреждений ДНК.
Клетки отвечают на УФ-индуцированное повреждение ДНК активацией сигнальных путей повреждения ДНК и остановкой клеточного цикла.
Повреждения ДНК коррегируются с помощью эксцизионной репарации нуклеотидов (ЭРН),
в которую включены также пути глобальной репарации генома (ГРГ), дефект которого наблюдается при пигментной ксеродерме (ПК),
и путь репарации, сопряженной с транскрипцией (РСТ), дефект которого наблюдается при синдроме Коккейна (СК).
Несмотря на дефект репарации ДНК при СК не отмечено повышение заболеваемости индуцированным УФ раком кожи, по-видимому, благодаря повышенной внутриклеточной аккумуляции р53 и апоптозу.
(6-4)ППФ быстро репарируются с помощью ЭРН. Нерепарируемые повреждения ДНК приводят к мутациям за счет дезаминирования или ошибочного «сквозного» синтеза через поврежденные участки.
Нерепарированные содержащие цитозин ЦПД относятся к характерным для УФ воздействия мутациям: переход С=>Т.
Мутации в генах, ответственных за канцерогенез, создают мутантные фенотипы, в т. ч. резистентные к апоптозу.
Клональная экспансия мутантных клеток повышает вероятность возникновения дополнительных мутаций и развития опухолей.
- Рекомендуем далее ознакомиться со статьей "Наследственные факторы риска рака кожи от ультрафиолета"
Оглавление темы "Патогенез рака кожи.":- Общие принципы развития рака кожи (патогенез)
- Механизм развития базальноклеточного рака кожи (патогенез базальноклеточной карциномы)
- Механизм развития плоскоклеточного рака кожи (патогенез плоскоклеточной карциномы)
- Врожденные и внешние факторы влияющие на прогноз рака кожи (модификаторы канцерогенеза)
- Новые молекулярные мишени рака кожи используемые для их лечения
- Ультрафиолетовое облучение солнца и солярия как причина рака кожи
- Повреждение ДНК и мутации под действием ультрафиолета как причина рака кожи
- Этапы развития рака кожи вызванного ультрафиолетовым облучением
- Наследственные факторы риска рака кожи от ультрафиолета
- Меры профилактики рака кожи от ультрафиолета (солнца, солярия)

