Повреждение ДНК и мутации под действием ультрафиолета как причина рака кожи
а) Повреждение ДНК, вызванное ультрафиолетом и репарация. Фотопродукты ДНК. Первый молекулярный этап в канцерогенезе, вызванном солнечным светом, развивается при индукции фотонами образования фотопродуктов ДНК. УФВ и УФС абсорбируются двойной связью по 5-6 концу пиримидинов (тимина и цитозина), что позволяет открыть эту связь. Это создает две одинарные связи (5-5 и 6-6), которые приводят к образованию циклобутан-пиримидинового димера. Чаще всего образуются ТТ циклобутановые димеры, но также возможно образование ТЦ и ЦЦ циклобутановых димеров.
Одинарная связь между 6 атомом одного пиримидина и внециклической группой другого образует пиримидин-пиримидоновый (6-4) фотопродукт ((6-4) ПП). Самый частый фотопродукт (6-4) ПП — это ТЦ. Оба фотопродукта искажают спираль ДНК и распознаются ферментами репарации ДНК. (6-4) ПП — фотопродукты сильнее искажают спираль ДНК и, следовательно, распознаются и подвергаются репарации быстрее, чем ЦП-димеры. Периоды полураспада циклобутановых димеров ТТ и фотопродуктов (6-4) ПП в коже человека составляют 33 и 2 часа соответственно.
УФВ индуцирует в коже человека 500 фотоочагов на 106 нормальных оснований на каждый Дж/см2.
Хотя УФА в солнечном свете в 20 раз больше, чем УФВ, требуется почти 1000-кратное увеличение доз этого излучения, чтобы проявились некоторые его биологические эффекты, такие как повреждение ДНК. Минимальные эритемные дозы (МЭД) для II фототипа кожи при 300 нм (УФБ) и 360 нм (УФА) составляют 25 мДж/см2 и 32000 мДж/см2 соответственно. УФА индуцирует образование Т-содержащих циклобутановых димеров и меньшее число окисленных пуринов и пиримидинов, а также разрывов одной цепи.
УФА вызывает образование этих изменений непрямым путем, посредством фотосенсибилизации. УФА также эффективно вызывает фотоизомеризацию образованных под действием УФВ фотопродуктов с формированием трудно поддающихся репарации и высоко мутагенных изомеров Дьюара.
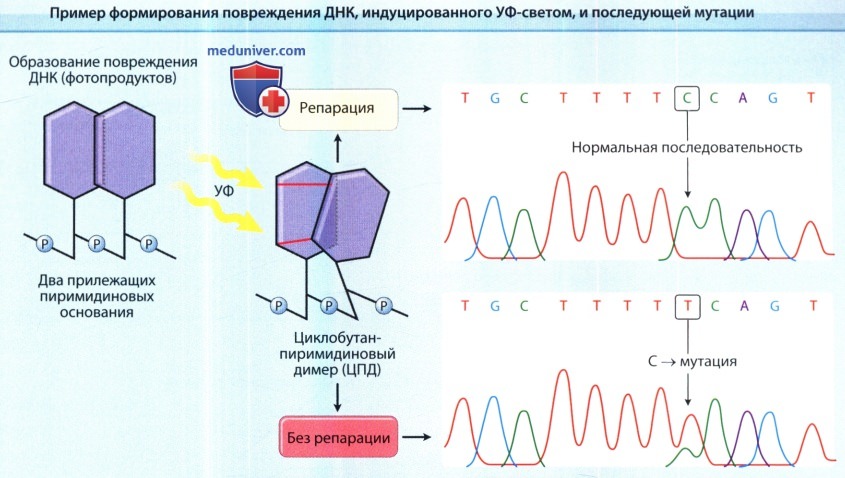
При прямом возбуждении молекулы ДНК УФ светом прилежащие пиримидиновые основания (цитозин или тимидин) могут формировать ковалентные связи между собой, что приводит к образованию пиримидиновых димеров.
В приведенном на рисунке примере два ковалентных соединения образуют трициклическое циклобутановое кольцо между двумя пиримидинами.
Следовательно, этот тип повреждения, вызванного УФ-светом, называется циклобутан-пиримидиновым димером, и является часто встречающимся типом фотопродуктов ДНК.
Система репарации ДНК с удалением нуклеотида ликвидирует это повреждение, и тем самым восстанавливает нормальную последовательность ДНК (верхний график).
Если повреждение не восстанавливается, этот тип фотопродукта ДНК может вызывать формирование типичной мутации с заменой одного основания С->Т (нижний график).
Вероятнее всего она формируется при репликации поврежденной ДНК и неправильном встраивании аденина напротив содержащего цитозин фотопродукта.
Пример такой вызванной УФ-облучением мутации приведен в правой части рисунка.
Следует отметить, что мутация расположена в пределах последовательности из семи пиримидинов, что нередко наблюдается при формировании мутаций, вызванных УФ-облучением.
б) Мутации, вызванные ультрафиолетовым облучением (УФ-облучением). Поврежденная УФ-облучением ДНК содержит характерные «опознавательные» мутации, которые легко распознаются спустя десятилетия после инсоляции. Эти мутации использовались для ответа на многие вопросы о происхождении рака. Циклобутановый димер или (4-6) фотопродукт может приводить к формированию мутации двумя путями. Когда поврежденный участок копируется при репликации ДНК, ДНК полимераза может прочитать поврежденный цитозин как тимидин и вставить аденин напротив него.
При следующей репликации полимераза правильно вставляет тимидин напротив аденина, и в результате происходит замещение Ц=>Т. Хотя ТТ циклобутановый пиримидиновый димер наиболее изучен и является самым часто образуемым фотопродуктом, тимидин не является мутагенным, так как ген XPV кодирует специальную полимеразу (Pol eta), присоединяюшую аденин напротив циклобутанового димера, содержащего Т. Однако мутация может возникать, так как циклобутановые димеры усиливают деаминирование их цитозины до ура-цила (или 5-метилцитозин до тимидина), что приводит к замене Ц=>Т; ошибки в работе полимеразы при этом отсутствуют.
Деаминация цитозинов в урацил в фотоочагах усиливается в транскрибируемой цепи, что, вероятно, опосредуется постоянной задержкой транскрипционного комплекса у фотоочага. В каждом случае мутации Ц=>Т возникают только в участках, на которых цитозин расположен рядом с тимидином или еще одним цитозином, так как УФ-фотопродукты присоединяют прилежащие пиримидины. При мутации двух прилежащих цитозинов формируется замена ЦЦ=>ТТ. Характерный тип мутации Ц=>Т, где Ц расположен рядом с другим пиримидином, в том числе ЦЦ=>ТТ, уникален для УФ-облучения и называется опознавательной УФ-мутацией.
Мутации, характерные для УФО, представляют собой инструмент, позволяющий по выявленной в опухоли мутации определить канцероген. Почти все экспериментально спровоцированные УФВ и УФС мутации расположены в области двух прилегающих пиримидинов, и около двух третей мутаций характерны для УФО. Оставшаяся треть, обычно замены Ц=>А и Т=>Ц или одна или две вставки или делеции, также вызваны УФО, но, возможно, возникают в результате действия реактивного кислорода, образовавшегося при фотосенсибилизации.
Трансверсия G=>Т (гуанин-тимин) может быть вызвана инкорпорацией противоположного аденину 8-гидрокси-2'-диоксигуанозина (80HdG; также обозначаемого как 8-оксо-7,8-дигидро-2'-диоксигуанозин [8-oxo-dG]), распространенного оксидативного очага в ДНК, уровень которого в эпидермисе остается высоким даже спустя 7 дней после воздействия УФ-облучения. Так как такое окисление вызывается многими канцерогенами, по этим мутациям нельзя определить, были ли они вызваны УФВ, УФА, табачным дымом или внутриклеточным окислительным фосфорилированием. Список опухолей, несущих классические мутации, характерные для воздействия УФО, также включает некоторые опухоли, содержащие эти вызванные УФО окислительные мутации.
УФА, наоборот, лишь слабо индуцирует мутации, характерные для УФВ, путем фотосенсибилизации, но также приводит к генерации мутаций по типу окисления и замен Т=>Г. Последние редко встречаются при воздействии УФВ или других канцерогенов, поэтому было предложено считать их характерным признаком УФА, хотя механизм индукции мутаций T=>G остается неясным.
Хотя (6-4)ПП быстро подвергаются репарации, но являются мутагенными, если репарации не происходит. Склонные к ошибкам ДНК-полимеразы добавляют гуанин напротив тимина в (6-4) ПП, что приводит к мутации Т=>С.

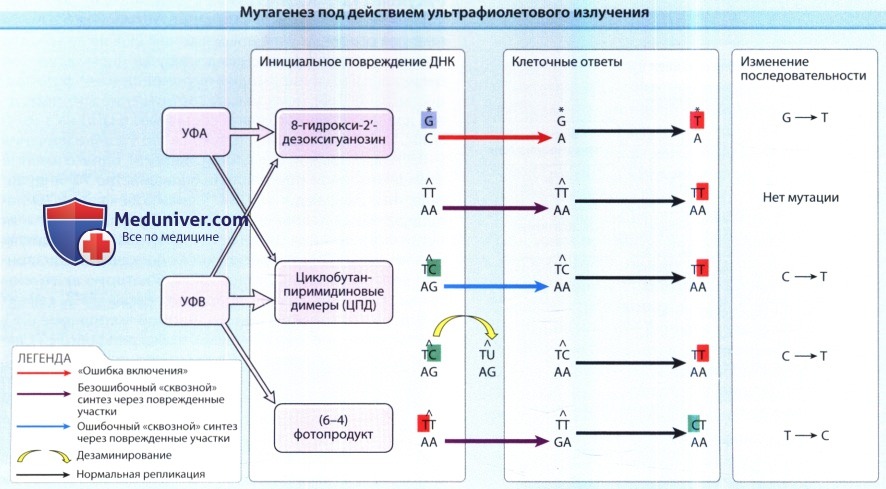
Циклобутан-пиримидиновые димеры (ЦПД) представляют собой наиболее типичные повреждения ДНК при УФ-индуцированном мутагенезе и являются непосредственным результатом воздействия УФВ.
Тимин-циклобутановые димеры являются наиболее встречающимися, но не относятся к мутагенным,
поскольку в их случаях происходит безошибочный «сквозной» синтез через поврежденные участки — напротив тиминовых димеров вставляются «правильные» адениновые основания.
Цитозин в составе ЦПД является мутагенным: при ошибочном «сквозном» синтезе через поврежденные участки напротив цитозина ошибочно вставляется аденин, либо при дезаминировании цитозин превращается в урацил.
Это приводит к «УФ-маркерным» мутациям— переходу С=>Т.
Образованный под действием УФВ (6-4)фотопродукт и вызванное оксидативным стрессом за счет УФА образование 8-гирокси-2'-дезоксигуанозин также мутагенны, но это происходит относительно реже.
в) Р53 и рак кожи. Было установлено, что при образовании мутаций, характерных для УФО, р53 играет ключевую роль в предотвращении развития базальноклеточного рака кожи (БКР) и плоскоклеточного рака кожи (ПКР), но не меланомы. Белок р53 является фактором транскрипции, контролирующим гены, участвующие в клеточном цикле, апоптозе и репарации ДНК; он также действует непосредственно на белки апоптоза. Мутация гена р53 обнаруживается примерно в половине опухолей человека, он назван геном-супрессором развития опухоли, так как рак возникает скорее в результате потери его нормальной функции, чем в результате приобретения патологических функций, как это происходит с онкогенами. В США эта мутация выявляется более чем у 90% пациентов с ПКР и у 75% больных актиническим кератозом (АК).
Хотя почти во всех базалиомах обнаруживается избыточная экспрессия белка р53, лишь половина опухолей содержат мутацию р53. Каждая мутация изменяет аминокислоту, это указывает на ее селекцию и вклад в развитие опухоли, а не на роль простого индикатора воздействия солнечного света. Такие мутации р53 чаще всего встречаются в 9 «горячих точках» (наиболее часто используемых участках) в важных функциональных областях белка. По сравнению со злокачественными опухолями внутренних органов, некоторые «горячие точки» рака кожи переместили ряд нуклеотидов таким образом, что они располагаются на участках прилегающих пиримидинов.
Некоторые участки могут являться «горячими точками» из-за замедленной репарации в этих местах. Другие «горячие точки» кожи, как и «горячие точки» рака внутренних органов, расположены в сайтах 5-метил-CG, где температура тела медленно деаминирует 5-метилцитозин в тимин; УФО ускоряет этот процесс.
Мутации при актиническом кератозе (АК) указывают на то, что эти дисплазии являются клональными; у пациентов с множественными АК выявляются разные мутации в разных очагах поражения. Сходство мутаций АК и ПКР поддерживает идею о том, что АК может прогрессировать в ПКР. В очагах ПКР оксидативных мутаций больше чем в очагах АК, что указывает на участие оксидативного стресса в прогрессии АК в ПКР. Агрессивные опухоли кожи у пациентов, подвергшихся солнечному свету и действию химических веществ, содержат множественные несвязанные мутации р53, как если бы различные опухоли возникли бы в патологически измененном участке и затем слились.
Опухоли при пигментной ксеродерме содержат очень частые мутации ЦЦ=>ТТ, возможно, из-за замедления репарации, которое дает больше времени для деаминирования цитозина. Мутации по двум основаниям также наблюдаются при плоскоклеточном раке конъюнктивы, опухоли, ассоциированной с вирусом иммунодефицита человека (ВИЧ), развивающейся в местах с высокой инсоляцией. Солнцезащитные препараты снижают количество мутаций, характерных для УФО. Напротив, базальноклеточный рак кожи (БКР) и плоскоклеточный рак кожи (ПКР), вызванные мышьяком, содержат нехарактерные для УФО мутации; мутации в БКР на закрытых участках тела напоминают таковые, наблюдаемые при окислительном повреждении.117,118 Опознавательные УФ-мутации в р53 могут наблюдаться также при карциноме клеток Меркеля.
Солнечный свет вызывает мутации р53 достаточно рано. Обычно в коже открытых участков тела содержится около 60000 клонов кератиноцитов, несущих мутацию р53, размером от трех до 3000 клеток. При окрашивании гематоксилин-эозином эти клетки с мутантным р53 выглядят абсолютно нормально. Раннее появление мутаций р53 делает возможным отслеживание развития опухоли. При микродиссекции образований, содержащих актинический кератоз (АК), карциному in situ и ПКР, обнаруживается, что каждая стадия содержит одну и ту же мутацию р53.
Хотя эти результаты показывают, что каждая стадия возникла из одного и того же первоначального образования, они не демонстрируют, что эти стадии происходят друг из друга. Чтобы показать происхождение опухоли, необходимо обнаружить дополнительные мутации, возникающие при наследовании. В материале, полученном при микродиссекции БКР, определяется одна мутация р53 во всей ткани опухоли, и различные вторичные мутации в разных участках опухоли. При мутации обеих аллелей р53 клетка приобретает склонность к анеуплоидии, что увеличивает вероятность формирования мутаторного фенотипа.
г) Сигнальный путь HEDGEHOG и рак кожи. У большинства спорадических базалиом имеются инактивирующие мутации в гене-супрессоре опухолевого роста РТСН, который является частью сигнального пути «hedgehog»; в остальных выявляются активирующие мутации в мишени этого сигнального пути-SMO. Сигнальный путь «hedgehog», по-видимому, является «стражем» канцерогенеза в базальных клетках, что делает необходимым формирование мутации в нем на ранних стадиях развития: в БКР выявляются мутации РТСН, как и во всех гистологических подтипах; ни в одной базалиоме не формируется потеря на других хромосомах без поражения РТСН; во врожденном образовании, которое может трансфомироваться в базалиому, в невусе сальных желез, в 40% случаев определяется потеря аллеля РТСН.
В спорадических базалиомах около трех четвертей мутаций РТСН имеют черты индуцированных УФ (или мутации, характерные для УФ, или ожидаемые индуцированные УФ окислительные мутации), а остальные 15% относятся к вставкам или делециям оснований, часто прилежащих к Ц=>Т в дипиримидиновом участке. Базалиома у пациентов с пигментной ксеродермой содержит мутации РТСН и SMO, похожие на индуцированные УФ, с избыточным формированием мутаций ЦЦ=>ТТ. Около 20% мутаций в спорадических базалиомах не похожи на индуцированные УФ и напоминают мутации зародышевой линии, обнаруживающиеся у пациентов с синдромом базальноклеточных невусов — делеции или инсерции участков, содержащих более двух пар оснований.
Эти данные могут иметь отношение к клиническим данным, согласно которым одна треть БКР развивается на участках кожи, не подвергающихся хронической инсоляции, а также к корреляции между развитием БКР на коже туловища и дефектами в системе нейтрализации радикалов с участием глютатиона. Мутации РТСН обнаруживают тенденцию к кодированию стоп-кодонов или сдвигов рамки, которые полностью инактивируют белок. При наследственных базалиомах почти все опухоли возникают после потери нормального аллеля. Эта потеря аллеля, по-видимому, связана с воздействием солнечного света, так как опухоли при синдроме невоидных базальноклеточных карцином (СНБК, синдроме Горлина) чаще всего возникают на открытых участках тела и редко развиваются у темнокожих. УФВ редко вызывает этот тип крупных генетических перестроек, и, таким образом, по аналогии с чувствительностью к рентгеновским лучам пациентов с СНБК, может иметь большое значение реактивный кислород, фотосенсибилизированный УФА.
д) Опухоли, связанные с действием псоралена и ультрафиолета А. В клетках, подвергшихся лечению псораленом, УФА формирует аддукты в последовательностях ТА, ТГ или ТТ, а также поперечные сшивки между двумя цепочками ДНК в этих участках. У человека в индуцированных ПУВА кератозах, ПКР и БКР около четверти мутаций в р53 или HRAS сходны с мутациями, вызванными псораленом, на Т, ТА, ТГ или ТТ; эта доля увеличивается при повышении дозы ПУВА. Однако большинство мутаций относятся к мутациям, характерным для УФО. Мутации, маркерные для УФО, могут возникнуть при воздействии УФА при ПУВА-терапии или УФВ окружающей среды.
е) Мутации при меланоме. Несмотря на корреляцию между меланомой и солнечным светом и на присутствие в меланоме опознавательных УФВ-мутаций, гены с опознавательными для развития меланомы УФ-мутациями не являются преобладающими. При семейной и спорадической меланомах часто выявляется мутация в области локуса CDKN2A или его делеция. Два его разных протеина, INK4A (также известный как р16) и ARF, подавляют прогрессию клеточного цикла посредством RB и р53 соответственно. INK4A подавляет инактивацию CDK4/6 протеина ретинобластомы, RB. ARF подавляет опосредованную MDM2 деградацию р53. Мутации в CDKN2A наблюдаются примерно в 25-40% случаев семейной меланомы. При спорадической меланоме потеря аллеля CDKN2A встречается чаще, чем редкие инактивирующие мутации INK4A или инактивация INK4A метилированием промотера. Роль солнечного света в развитии этих генетических изменений неизвестна.
Мутации онкогена обнаруживаются в сигнальном пути протеинкиназы, активированной митогеном RAS-BRAF-MEK-ERK (МАРК, ПКАМ). Этот сигнальный каскад обычно активируется при стимуляции фактора роста, и его последовательное фосфорилирование регулирует пролиферацию и дифференциацию клетки. Активирующие мутации в сигнальном пути ПКАМ отменяют необходимость присутствия фактора роста. Мутации RAS присутствуют в 10-20% меланом, что коррелирует с экспозицией УФО. Наиболее распространенная в меланомах мутация RAF, точечная мутация BRAFV600Е, переводит киназу в конституционально активное состояние и усиливает активацию ERK. Эта мутация выявляется примерно в 80% приобретенных меланоцитарных невусов, что указывает на потенциально раннее участие BRAF в развитии меланомы. Мутация V600E не похожа на индуцированную УФО и ассоциирована с интермиттирующей инсоляцией.
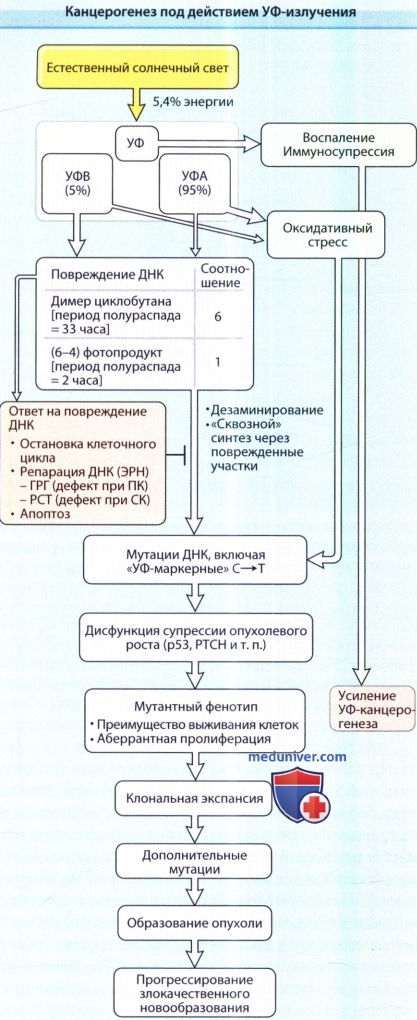
УФ-излучение вызывает два основных типа повреждений ДНК на дипиримидиновых сайтах: образование циклобутан-пиримидиновых димеров (ЦПД) и пиримидин-пиримидон-(6-4)-фотопродукты [(6—4)ППФ].
Приводимое соотношение этих продуктов для искуственного света составляет 6 ЦПД на 1 (6-4) ППФ].
На УФВ приходится только около 5% УФ-изличения (0,3% всей земной солнечной энергии), однако именно этим диапазоном обусловлено большинство УФ-индуцированных повреждений ДНК.
Клетки отвечают на УФ-индуцированное повреждение ДНК активацией сигнальных путей повреждения ДНК и остановкой клеточного цикла.
Повреждения ДНК коррегируются с помощью эксцизионной репарации нуклеотидов (ЭРН),
в которую включены также пути глобальной репарации генома (ГРГ), дефект которого наблюдается при пигментной ксеродерме (ПК),
и путь репарации, сопряженной с транскрипцией (РСТ), дефект которого наблюдается при синдроме Коккейна (СК).
Несмотря на дефект репарации ДНК при СК не отмечено повышение заболеваемости индуцированным УФ раком кожи, по-видимому, благодаря повышенной внутриклеточной аккумуляции р53 и апоптозу.
(6-4)ППФ быстро репарируются с помощью ЭРН. Нерепарируемые повреждения ДНК приводят к мутациям за счет дезаминирования или ошибочного «сквозного» синтеза через поврежденные участки.
Нерепарированные содержащие цитозин ЦПД относятся к характерным для УФ воздействия мутациям: переход С=>Т.
Мутации в генах, ответственных за канцерогенез, создают мутантные фенотипы, в т. ч. резистентные к апоптозу.
Клональная экспансия мутантных клеток повышает вероятность возникновения дополнительных мутаций и развития опухолей.
- Рекомендуем далее ознакомиться со статьей "Этапы развития рака кожи вызванного ультрафиолетовым облучением"
Оглавление темы "Патогенез рака кожи.":- Общие принципы развития рака кожи (патогенез)
- Механизм развития базальноклеточного рака кожи (патогенез базальноклеточной карциномы)
- Механизм развития плоскоклеточного рака кожи (патогенез плоскоклеточной карциномы)
- Врожденные и внешние факторы влияющие на прогноз рака кожи (модификаторы канцерогенеза)
- Новые молекулярные мишени рака кожи используемые для их лечения
- Ультрафиолетовое облучение солнца и солярия как причина рака кожи
- Повреждение ДНК и мутации под действием ультрафиолета как причина рака кожи
- Этапы развития рака кожи вызванного ультрафиолетовым облучением
- Наследственные факторы риска рака кожи от ультрафиолета
- Меры профилактики рака кожи от ультрафиолета (солнца, солярия)

