Механизмы воздействия фотохимиотерапии при болезнях кожи
Фотохимио- и фотодинамическая терапия - краткий обзор:
- Фотохимиотерапия [псорален и ультрафиолет А (ПУВА)] успешно применяется > 30 лет. Ее эффективность существенно повлияла на дерматологическую терапию в целом, так как ПУВА-терапия является методом лечения целого ряда заболеваний, помимо псориаза и витилиго.
- Для повышения эффективности и уменьшения количества сеансов ПУВА-терапию можно комбинировать с местным лечением и некоторыми системными препаратами (ретиноидами, метотрексатом и, возможно, биопрепаратами).
- Наиболее важные побочные эффекты ПУВА — риск развития плоскоклеточного рака и возможный риск меланомы. Таких рисков не обнаружено при применении ПУВА-ванн.
- Экстракорпоральная фототерапия (ЭКФТ) внедрена в 1980-х годах для паллиативного лечения эритродермической формы кожной Т-клеточной лимфомы.
- ЭКФТ играет большую роль в лечении болезни «трансплантат против хозяина» после аллогенной трансплантации костного мозга, поскольку позволяет прогрессивно уменьшать и даже прекратить одновременную иммуносупрессивную терапию без возрастания активности болезни.
- Серьезных побочных действий при проведении ЭКФТ не зарегистрировано.
- Фотодинамическая терапия (ФДТ) опухолей кожи началась с внедрения местной фотосенсибилизации посредством прекурсора порфирина (5-аминолевулиновой кислоты), что позволяет длительно избегать генерализованной фоточувствительности.
- Современный опыт применения ФДТ для лечения рака кожи/предраковых состояний указывает, что она способна излечивать актинические кератозы, болезнь Боуэна, поверхностную и узловатую базальноклеточную карциному, а также ранние стадии плоскоклеточных карцином.
- Единственный значимый побочный эффект местной ФДТ — жгучая боль во время и сразу после облучения. ФДТ не обладает ни мутагенным, ни канцерогенным потенциалом.
Фотохимиотерапия псораленами заключается в комбинированном применении системных или местных псораленов (Р) с облучением ультрафиолетом A (UVA), отсюда происходит ее название — PUVA-терапия (ПУВА-терапия). Псоралены представляют собой фототоксические вещества, которые проникают в клетки и поглощают белки, индуцируя при этом фотохимические реакции, изменяющие функции клеточных компонентов. Это взаимодействие приводит к благоприятному терапевтическому эффекту, возникающему после многократных контролируемых фототоксических реакций.
Псоралены могут назначаться внутрь или применяться местно на коже в форме растворов, кремов или ванн. Этот вид терапии в настоящее время используется для лечения некоторых распространенных и редких кожных заболеваний.
а) История. В 1970-е годы было показано, что прием внутрь 8-метоксипсоралена (8-МОР) и последующее облучение искусственным УФА является высокоэффективной терапией псориаза. Псораленовые ванны (погружение в водный раствор псоралена) и последующее воздействие УФА, впервые внедренное в Скадинавии, также применяется во многих европейских медицинских центрах. Эффективность любого из вариантов ПУВА-терапии была повсеместно подтверждена различными исследованиями и существенно повлияла на дерматологическую терапию в целом как метод лечения многих других заболеваний помимо псориаза.
Значительному прогрессу в фототерапии содействовало появление в середине 1980-х годов флуоресцентных ламп, изучавших узкополосный УФБ с длиной волны 311-313 нм. Этот узкополосный спектр несколько менее эффективен в лечении псориаза или грибовидного микоза. Однако благодаря большей простоте в применении и, возможно, большей безопасности, чем ПУВА-терапия, этот метод сейчас чаще применяется во многих центрах фототерапии. Узкополосная УФБ-фототерапия оказывает благоприятное действие при ряде других дерматозов, которые ранее лечили методом ПУВА. Тем не менее, ПУВА-терапия все еще остается основным направлением в лечении плохо поддающихся терапии заболеваний.

б) Принципы фотохимотерапии. Цель ПУВА-терапии— индуцировать ремиссию кожных заболеваний путем многократных контролируемых фототоксических реакций. Эти реакции происходят только тогда, когда псоралены активируются под воздействием УФА. Согласно пенетрационным характеристикам УФА-облучения, поглощение фотонов ограничено кожей. Однако имеются данные о том, что ПУВА может оказывать системное воздействие через циркуляцию лимфоцитов, которые подверглись ее воздействию при прохождении через кожу. Клинически ПУВА-индуцированные фототоксические реакции характеризуются отсроченным появлением эритемы и воспаления, напоминающих солнечный ожог.
1. Псоралены. Для ПУВА-терапии применяются три псоралена. Метоксален или 8-МОР, наиболее широко используемый и единственный доступный в США псорален, получают из семян растения Amni majus. Бергаптен или 5-МОР и триоксален (ТМР) или 4,5’, 8-триметилпсорален доступны в европейских и других странах.
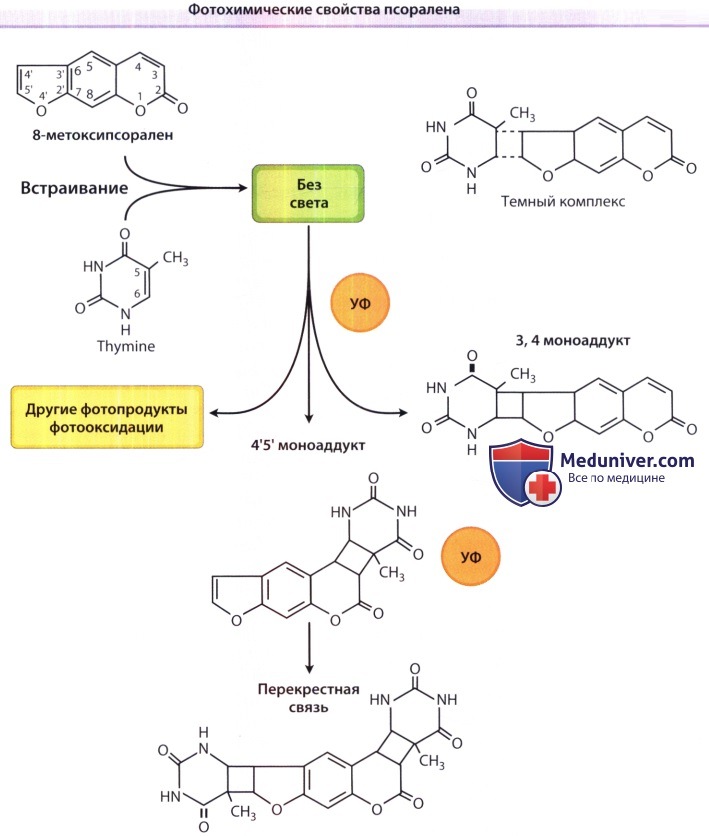
2. Фотохимические свойства псоралена. В отсутствие УФ-облучения псоралены встраиваются между противолежащими парами оснований в двойной спирали ДНК. Поглощение фотонов в диапазоне УФА приводит к образованию дополнительного 3,4- или 4,5-циклобутанового продукта (аддукта) с пиримидиновыми основаниями нативной ДНК. На первом этапе этой фотохимической реакции образуется монофункциональный аддукт с тимином или цитозином. Некоторые псоралены, в том числе 8-МОР, ТМР и 5-МОР, могут поглощать второй фотон, и эта реакция приводит к образованию бифункционального аддукта с 5,6 двойной связью пиримидинового основания противолежащей цепи, образуя, таким образом, перекрестную связь между цепями двойной спирали.
Встраивание псораленов в эпидермальную ДНК подавляет как синтез ДНК, так и деление клетки, и этот механизм первоначально считался терапевтическим при псориазе. Однако перекрестное связывание не является предпосылкой для терапевтического эффекта, и успех ПУВА-терапии при других кожных заболеваниях вряд ли вызван именно этой молекулярной реакцией. Псоралены реагируют также с белками РНК и другими клеточными компонентами и косвенно модифицируют белки и липиды через реакции, опосредуемые синглетным кислородом или генерированием свободных радикалов. Возможно, эти механизмы способствуют эффекту ПУВА-терапии при заболеваниях, не являющихся гиперпролиферативными по природе.
Образование моно- и бифункциональных фотоаддуктов в ДНК приводит к непосредственной блокаде синтеза ДНК. Перекрестные связи между цепями считаются основной причиной фотосенсибилизации кожи линейными псораленами, такими как 8-МОР. Избыточное производство этих циклобутановых аддуктов приводит к гибели клетки. Мутация и канцерогенез кожи также развиваются вследствие фотоконъюгации псоралена с ДНК, поскольку репарационный процесс в клетках, выживающих после такого повреждения ДНК, нередко протекает с ошибками.
При реакциях типа II реактивные виды кислорода (O2, O2 или ОН) индуцируют окисление липидов клеточной липопротеиновой мембраны и деструкцию мембраносвязанного цитохрома Р450. Повреждающие мембрану процессы активируют путь метаболизма арахидоновой кислоты, что приводит к увеличению продуктов вторичного окисления, которые способствуют усиленному синтезу эйкозанои-дов. Кроме того, реактивные виды кислорода могут непосредственно повреждать ДНК, генерируя разрывы в ДНК-цепи.
3. Механизмы фототерапии. Гипотезы о механизме действия фототерапии при псориазе базируются на основании известного процесса фотоконъюгации псораленов с ДНК с последующей супрессией митоза, синтеза ДНК и клеточной пролиферации, что должно нормализовать повышенную скорость пролиферации при псориазе. Однако ПУВА изменяет также экспрессию цитокинов и цитокиновых рецепторов, а также подавляющую регуляцию некоторых лимфоцитов и функций антиген-презентирующих клеток, влияет на экспрессию молекул адгезии и уменьшает количество клеток Лангерганса в эпидермисе. Кроме того, ПУВА воздействует на иммунные эффекторные клетки, такие как лимфоциты или полиморфно-ядерные лейкоциты.
Поскольку имеются данные о том, что псориаз изначально вызывается иммуноцитами, которые являются производными крови, можно предположить, что ПУВА-терапия может влиять на иммунную функцию, оказывая прямое фототоксическое действие на лимфоциты в кожных инфильтратах. Этому предположению соответствует наблюдение эффективного ответа на ПУВА-терапию некоторых других заболеваний, которые не носят гиперпролиферативного характера, но опосредуются иммунной системой. ПУВА способна реверсировать патологически измененную модель дифференцировки кератиноцитов и уменьшить количество пролиферирующих эпидермальных клеток. Инфильтрирующие лимфоциты интенсивно подавляются ПУВА-терапией с вариабельным эффектом для разных Т-клеточных субпопуляций.
В ответ на ПУВА-терапию, апоптозу с гораздо большей вероятностью подвергаются лимфоциты, чем кератиноциты, чем объясняется высокая эффективность ПУВА при кожной Т-клеточной лимфоме (КТКЛ), а также при воспалительных заболеваниях кожи. Хотя о путях и механизмах фотосенсибилизации псораленами известно много, взаимодействия псораленов и их сравнительный вклад в разрешение специфического заболевания окончательно не выяснены.
Псоралены стимулируют также меланогенез, что включает фотоконъюгацию псораленов с ДНК в меланоцитах, митоз и последующую пролиферацию меланоцитов, усиленное образование и меланизацию меланосом, интенсивную передачу меланосом в кератиноциты и активацию и усиленный синтез тирозина, который частично опосредуется стимуляцией активности сАМР.
4. Фармакокинетика. Важными этапами в период между приемом препарата внутрь и его доставкой к месту действия являются абсорбция, эффект первого прохода, транспортировка через кровь и распределение в тканях. Скорость поглощения псоралена из кишечника зависит в основном от физических характеристик препарата и содержания жира в принимаемой одновременно пище. Жидкие препараты 8-МОР и 5-МОР быстрее достигают более высоких уровней в плазме, чем кристаллические формулы. Кроме того, максимальные уровни в плазме при приеме жидких препаратов достигаются через примерно одинаковые по времени интервалы у всех пациентов, в то время как при приеме кристаллических препаратов эти интервалы сильно варьируют.
Перед тем как достигнуть кожи через кровообращение, псоралены метаболизируются во время прохождения через печень. Уровни МОР-8, назначаемого перорально в различных дозах, демонстрируют сильную нелинейность, что указывает на насыщаемый эффект первого прохода. Непредсказуемые фармакокинетические свойства объясняются, вероятно, вариабельностью интестинальной абсорбции, эффекта первого прохода, распределения по телу в ходе циркуляции крови, метаболизма и элиминации лекарства как у разных индивидуумов, так и у одного и того же пациента.
Индивидуальные сывороточные уровни МОР-8 у одного и того же индивидуума довольно хорошо соответствуют реактивности кожи, причем пик фототоксичности для кожи совпадает с пиковыми уровнями препарата в плазме. Однако фототоксические реакции на ПУВА сильно отличаются у разных индивидуумов. Следовательно, измерение уровней псоралена в сыворотке является инструментом исследования, но не используется для мониторинга клинической терапии.
Фармакокинетика 8-МОР после местного применения зависит от способа его аппликации. При местном применении МОР-8 в форме 0,15% эмульсии или раствора, уровни препарата в плазме сравнимы с уровнями при его пероральном приеме, если при этом обрабатываются большие поверхности тела. В отличие от этого, уровни препарата в плазме после ПУВА-терапии с применением ванн, когда задействована практически вся поверхность тела, очень низкие. Псоралены, поступающие с водой во время приема ванны, легко поглощаются кожей, но быстро выводятся, не накапливаясь в ней.
5. Ультрафиолетовое излучение диапазона А. Источниками УФА, которые обычно применяются для ПУВА терапии, являются флюоресцентные лампы или металлгалидные лампы высокого давления. Пик эмиссии типичной флуоресцентной лампы для ПУВА-терапии составляет 352 нм, при этом примерно 0,5% излучается в диапазоне УФБ. Дозы УФА определяются в Дж/см2 и измеряются фотометром с максимальной чувствительностью в диапазоне 350-360 нм. Хотя в спектре антипсориатической активности и фототоксической эритемы пик достигается при 352 нм, световые волны большей длины оказались такими же эффективными в лечении псориаза, если их доставлять в адекватной для получения равного эритемогенного ответа дозе.
6. Эффект фоточувствительности при фотохимиотерапии. ПУВА-терапия вызывает воспалительный ответ, который проявляется в форме запаздывающей фототоксичекой эритемы, пропорциональной дозе как лекарства, так и УФА, а также индивидуальной чувствительности к фототоксическим реакциям. Изменения дозы 8-МОР для разных индивидуумов в пределах узкого, но клинически значимого диапазона в значительной степени изменяют порог ПУВА-эритемы, но не скорость нарастания ее интенсивности при повышении дозы УФА. Важно отметить, что время возникновения ПУВА-эритемы отличается от времени развития эритемы при солнечном ожоге вследствие УФБ, которая появляется через 4-6 часов и достигает пика через 12-24 часа после воздействия УФБ.
ПУВА-эритема появляется не раньше чем через 12-36 часов и достигает пика через 72-96 часов, или даже позже. Следовательно, ежедневные сеансы ПУВА могут привести к неожиданно тяжелой отсроченной кумулятивной фототоксичности. Дозозависимая кривая ПУВА-эритемы более пологая, чем УФБ-эритемы (примерно в два раза), и эта разница сохранятся даже в точке максимальной эритемы. Тяжелые реакции на ПУВА-терапию могут привести к образованию пузырей и поверхностному некрозу кожи. За передозировкой УФА часто следуют отек, сильный зуд и иногда ощущение жжения на пораженном участке, возможно, в результате повреждения поверхностных нервных окончаний. Эритема пока является единственным доступным параметром, который позволяет оценить интенсивность ПУВА-реакции, таким образом, она является важным критерием регулировки дозы.
Вторым важным эффектом ПУВА является пигментация. Она может развиваться без клинически видимой эритемы, особенно при применении 5-МОР или ТМР. Это особенно важно при лечении витилиго и для профилактической терапии некоторых фотодерматозов. На непораженной коже ПУВА-пигментация достигает максимума примерно через семь дней после сеанса терапии и может сохраняться от нескольких недель, до нескольких месяцев. Так же как и при пигментации вследствие инсоляции, способность индивидуума к загару предопределена генетически, но дозозависимая кривая в этом случае более крутая. Несколько сеансов ПУВА приводят к гораздо более интенсивному загару, чем многократное воздействие солнечного излучения.
б) Протоколы лечения:
1. Местная терапия. Применение 8-МОЗ в форме кремов, мазей или лосьонов с последующим УФА-облучением эффективно приводит к ремиссии при псориазе, но имеет ряд недостатков. Неравномерное распределение на поверхности кожи вызывает непредсказуемые реакции фототоксической эритемы и ведет к возникновению участков косметически неприемлемой гиперпигментации. Кроме того, если очаги многочисленные, местная терапия становится трудоемкой и занимает много времени, а лечение не предупреждает развитие новых активных очагов на ранее непораженных и не получавших лечения участках. Поэтому местная ПУВА-терапия в форме кремов, мазей и лосьонов используется сейчас только в случаях ограниченного бляшечного псориаза и ладонно-подошвенной формы заболевания.
2. Фотохимиотерапия с применением ванн. Доставка псораленов посредством принятия ванны обеспечивает равномерное распределение лекарства по поверхности кожи, очень низкие уровни псоралена в плазме и быструю элиминацию свободных псораленов с кожи. Доставка МОР-8 посредством водной ванны устраняет побочные эффекты со стороны желудочно-кишечного тракта и возможное вредное фототоксическое воздействие на глаза, поскольку системная фотосенсибилизация отсутствует. Воспроизводимость уровней псоралена в коже высокая, а фоточувствительность длится не более двух часов. Повышенной частоты нежелательных фототоксических реакций можно избежать при более низкой стартовой дозе [50% от минимальной фототоксической дозы (МФД)] и более тщательной дозиметрии в начальной фазе лечения.
Первоначально ПУВА-терапия с применением ванн проводилась с ТМР, но теперь применяются также 8-МОР и 5-МОР. Этот вид терапии состоит в приме 15-20-минутной ванны с погружением всего тела в раствор 8-МОР концентрацией 0,5-5,0 мг препарата на литр воды. Облучение проводится сразу же, поскольку фоточувствительность уменьшается довольно быстро. ТМР обладает более высокой фототоксичностью после местного применения и назначается в более низких концентрациях, чем 8-МОР. При тестировании на МФД для терапии с применением ванн следует учесть тот факт, что при этом виде ПУВА-терапии порог фототоксичности уменьшается на ранней стадии лечения, в отличие от системной ПУВА. Стандарты для ПУВА-терапии с применением полных ванн и частичных погружений, а также для других видов местной ПУВА-терапии опубликованы Британской Группой Фотодерматологии и основаны, где это было возможным, на результатах контролируемых исследований, а в иных случаях — на консенсусе.
3. Системное лечение. При системной ПУВА-терапии, 8-МОР назначается перорально (0,6-0,8 мг/кг веса тела) за 1-3 часа до облучения, в зависимости от характеристик абсорбции для конкретного препарата. Жидкие препараты поглощаются быстрее и дают более высокие и более воспроизводимые сывороточные концентрации, чем микрокристаллические формы. Обычная дозировка для МОР-5 составляет 1,2-1,8 мг/кг веса тела.
Начальные дозы УФА определяются либо в зависимости от типа кожи пациента, либо от теста на МФД. МФД определяется как минимальная доза УФА, которая вызывает едва ощутимую, но четко определяемую эритему при воздействии на испытуемые участки кожи постоянно возрастающими дозами УФА. Считывание эритемы производят через 72 часа после теста, за этот период времени реакция фототоксичности псоралена обычно достигает своего пика. Тест на МФД необходимо проводить на раннее не подвергавшейся воздействию коже (например, на ягодицах). Хотя тест на МФД занимает больше времени, чем фототипирование кожи, он позволяет применять более точные и более высокие дозы УФА на начальной стадии лечения. В таблице ниже приведены дозировки, рекомендуемые для системной ПУВА-терапии и ПУВА-терапии с применением ванн.
Для разрешения реагирующих на ПУВА-терапию заболеваний необходимы многократные сеансы, с постепенным приращением дозы по мере развития пигментации. Более низкие дозы довольно часто не дают эффекта, за исключением тех заболеваний, при которых желаемой целью является индукция пигментации. В случае большинства дерматозов, поддающихся лечению ПУВА-терапией, частоту сеансов уменьшают после удовлетворительного разрешения заболевания, и последняя доза УФА применяется как поддерживающая, если планируется поддерживающая терапия. Длительность фазы поддерживающей терапии и частота сеансов зависят от конкретного заболевания и его склонности к рецидивам.

- Рекомендуем далее ознакомиться со статьей "Фотохимиотерапия при псориазе"
Редактор: Искандер Милевски. Дата публикации: 21.9.2019

