Особенности скрининга вируса папилломы. Требования к скринингу вируса папилломы
За последнее время описаны методы ПЦР с использованием консервативных («консенсусных») праймеров, специфичных в отношении генов Е1 и L1 HPV. Поскольку секвенированные геномы HPV гомологичны не более чем по 12 последовательным нуклеотидам, для обеспечения эффективной амплификации широкого спектра HPV необходимо «адаптировать» либо праймеры, либо методику проведения ПЦР.
К числу таких «адаптации» относятся: допустимость определенного несоответствия между праймерами и ДНК-мишенью, т. е. снижение жесткости условий отжига; использование вырожденных праймеров (смеси олигонуклеотидов, различающихся по некоторым позициям), что обеспечивает их комплементарность ДНК HFV 6, 11, 16, 18 и 33; использование праймеров, содержащих в некоторых позициях остатки инозина. «Консенсусная» ПЦР с использованием праймеров MY 09/11, описанная в работе, была успешно применена для анализа клинических образцов.
Однако сравнение результатов амплификации HPV 16 с использованием GP 5/6 с результатами, полученными в рамках исходного протокола для MY 09/11, когда проводится 30 циклов ПЦР и используется консервативный олигонуклеотидный зонд, показало, что в последнем случае чувствительность метода по крайней мере в 10 раз ниже. Возможно, это обусловлено различиями в числе циклов амплификации (40 циклов против 30) и в размерах используемых зондов (смесь полноразмерных продуктов амплификации и консервативный олигонуклеотидный зонд).
Недавно метод с использованием праймеров MY 09/11 был модифицирован: увеличено число циклов амплификации и использована смесь ГЩР-продуктов, полученных путем амплификации нескольких клонированных и неизвестных последовательностей ДНК HPV. Однако мы отдаем предпочтение ПЦР с использованием GP 5/6, поскольку при этом в результате амплификации получаются более короткие последовательности (150 п.н. против 450 п.н.), которые больше подходят для анализа неочищенных клеточных суспензий. Чтобы можно было получать согласованные результаты о преобладании в мазках HPV того или иного типа, желательно наладить между лабораториями, использующими для выявления HPV стандартный ПЦР-метод, обмен соскобами.
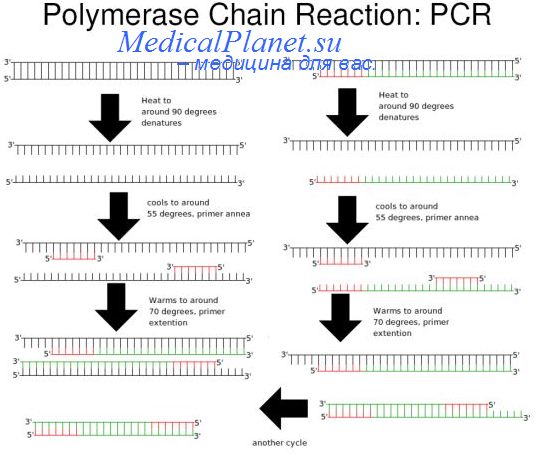
Основной недостаток метода ПЦР, являющийся оборотной стороной его достоинства, — высокая чувствительность. При минимальном загрязнении мазков в клиниках или лабораториях посторонними ДНК, клонированными плазмидами или ПЦР-продуктами может быть получен ложноположительный результат. Чтобы предотвратить получение такого результата вследствие того, что в препарате присутствует плазмида с клонированной в ней ДНК HPV (pHPV), используют «корректирующие» праймеры, фланкирующие сайты, по которым клонирован HPV.
Это позволяет обнаруживать специфические HPV-последовательности в клиническом материале даже на фоне pHPV. На наш взгляд, наиболее серьезный источник загрязнения — это сами продукты амплификации, что заставило нас готовить препараты и растворы для ПЦР и проводить электрофорез в трех изолированных комнатах. Необходимо также на всех этапах пользоваться одноразовыми пробирками и пипетками со съемными наконечниками. При проведении ПЦР непосредственно на клиническом материале предварительная обработка образцов сводится к минимуму. Учитывая это и все сказанное выше, имеет смысл проводить прямую GP/TS-ПЦР, обеспечивающую минимальный риск загрязнения образцов.
Как показали эпидемиологические исследования, частота обнаружения разных типов HPV в образцах сильно зависит от используемого метода выявления вируса, от состава обследуемых групп пациенток и т. д. Для определения встречаемости HPV в мазках вполне подходит метод GP/TS-ПЦР. Ван ден Брюль и др. использовали его для обследования двух групп пациенток:
1) женщины 30—35 лет без симптомов какого-либо заболевания, живущие в регионе, для которого характерна низкая частота заболеваемости раком шейки матки, и проходящие каждые три года соответствующее обследование;
2) женщины 16—60 лет, обратившиеся в клинику по поводу различных гинекологических нарушений, связанных или не связанных с патологией шейки матки.
Данные по встречаемости HPV, полученные при независимом цитологическом исследовании мазков и выявлении HPV методом ПЦР, сильно различались. Результаты исследования нормальных в цитологическом отношении соскобов, взятых у женщин без каких-либо симптомов (A-I; 3,5%), у пациенток без видимой патологии шейки матки (В-И; 9%) и у пациенток с патологией шейки матки (С-Н; 21,5%). Встречаемость HPV 16 и 18 в этих группах составила 0,9% (А), 2,5% (В) и 12% (С) соответственно. У женщин из второй группы 78% мазков содержали HPV 16 и 18, что было связано с интраэпителиальной неоплазией шейки матки 1—3 степени.
Отсюда следует, что женщинам, в мазках которых при отсутствии цитологических аномалий обнаружены онкогенные типы HPV, необходимо наблюдаться в клинике. Такая практика введена в нашей больнице, В мазках со слабой и сильной дисплазией и в мазках от пациенток с подозрением на рак in situ из обеих групп суммарная встречаемость HPV всех типов составила 70, 84 и 100% соответственно. Во всех случаях плоскоклеточной карциномы шейки матки (n-50) в мазках был обнаружен HPV. Встречаемость HPV 16 и 18 составляла 41 % при слабой дисплазии и увеличивалась до 94% при разных формах рака.
- Читать далее "Перспективы выявления вируса папилломы. Молекулярные методы обнаружения микроорганизмов"
Оглавление темы "Выявление микроорганизмов и вирусов с помощью ПЦР":1. Хранение фильтров после гибридизации. Полимеразная цепная реакция
2. Изготовление препаратов для ПЦР. Консервативные и типоспецифичные праймеры вируса папилломы человека
3. Статегия скрининга HPV. Полимеразная цепная реакция на мазках шейки матки
4. Типоспецифичная ПЦР на мазках шейки матки. Блот-гибридизация для выявления вируса папиломы шейки матки
5. Мечение зондов для GP-ПЦР. 5-концевое мечение TS-ПЦР-зондов
6. Особенности скрининга вируса папилломы. Требования к скринингу вируса папилломы
7. Перспективы выявления вируса папилломы. Молекулярные методы обнаружения микроорганизмов
8. Выявление кишечной микрофлоры молекулярными методами. Перенос колоний с селективной среды на твердую подложку
9. Гибридизация нуклеиновых кислот иммобилизованных на фильтрах с ДНК-зондами. Техника гибридизации с ДНК зондами
10. Применение ПЦР для обнаружения патогенных микроорганизмов. Техника выявления микроорганизмов методами ПЦР

