Изготовление препаратов для ПЦР. Консервативные и типоспецифичные праймеры вируса папилломы человека
Материалы
• ФСБ: 10 мМ фосфат натрия, 150 мМ NaCI, pH 7,2
• Щетки Cervex (фирмы International Medical Products, Zutphen, The Netherlands)
• 10 мМ трис-НСl, рН8,1
Методика
1. Помещают соскобы в 5 мл стерильного ФСБ, содержащего 0,05% мертиолат, и интенсивно встряхивают.
2. Удаляют шетки стерильным пинцетом (периодически прогревая его).
3. Осаждают клетки центрифугированием при 3000 g в течение 10 мин.
4. Микропипеткой со съемным наконечником (фирмы Sarstedt) суспендируют осадок в 1 мл 10 мМ трис-HCl, рН 8,1.
5. Отбирают четыре аликвоты по Юмкл для ПЦР2) и хранят их, а также оставшийся материал, при —70 С.
6. Для каждой ПЦР размораживают по одной аликвоте.
7. Денатурируют аликвоту при 100 °С в течение 5 мин, затем охлаждают во льду и центрифугируют при 3 000 g 1 мин.
8. Добавляют нужное количество смеси для ПЦР.
- Все процедуры, за исключением центрифугирования, следует выполнять в ламинарном шкафу.
- Рекомендуется использовать пробирки с завинчивающимися крышками фирмы Sarstedt, а также микропипетки со съемными наконечниками фирм Microman, Gibson, France.
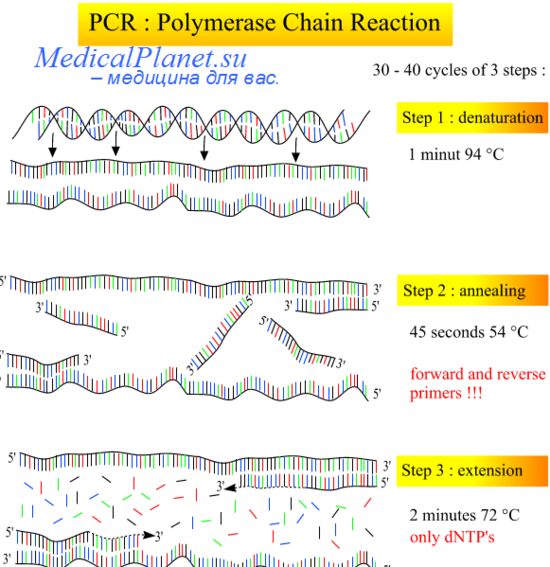
Поскольку метод ПЦР оказался самым чувствительным методом выявления ДНК HPV в соскобах с шейки матки, была начата разработка новой быстрой и доступной процедуры скрининга HPV на его основе. Следовало создать такую методику, которая позволяла бы выявлять одновременно разные типы HPV.
В соответствии с этим были выбраны праймеры, специфичные в отношении консервативных нуклеотидных последовательностей HPV разных типов. Сравнение секвенированных последовательностей НPV 6b, 11,16, 18, 31 и 33 показало, что наиболее консервативные участки локализованы в пределах открытых рамок считывания (ORF) E1 и L1. В ORF L1 были обнаружены две высококонсервативные последовательности длиной по 20 п.н., общие для всех секвенированных типов HPV; их и можно использовать в качестве консервативных праймеров для ПЦР (general primer, GP5/6. Они гибридизуются с ДНК HPV разных типов, так что отжиг можно проводить в мягких условиях. Оптимизация режима ПЦР для консервативных праймеров (GP-ПЦР) описана в работе. Последовательности, распознаваемые этими праймерами во всех исследованных ДНК HPV, охватывает участок длиной 140-150 п.н.
Поскольку ко времени подбора праймеров были секвенированы ДНК всего шести типов генитальных HPV, их общие свойства можно было установить только при помощи ПЦР-анализа обширной группы клонированных ДНК HPV. Помимо секвенированных ДНК HPV типов 6b, 11, 16, 18, 31 и 33, праймер GP 5/6 гибридизовался и давал ПЦР-продукты длиной 140-150 п.н. с несеквенированными ДНК HPV 13, 30, 32, 39 и 45. GP 5/6-праймеры не давали амплификацию ДНК pBR322, что свидетельствовало об HPV-специфичности ПЦР-продуктов и о том, что они не являются результатом перекрестной гибризизации с векторными последовательностями. Об этом говорили и результаты блот-гибридизации в мягких условиях со смесью зондов, состоящей из амплифицированных последовательностей, специфичных для HPV 6, 11, 16, 18, 31 и 33: были выявлены все фрагменты длиной 140—150 п.н. Специфичность этих ПЦР-продуктов была подтверждена также результатами дот-блот-гибридизации с Rsal-фрагментами и данными секвенирования. Кроме того, эмпирически установлено, что если число несоответствий между праймером и мишенью больше трех, то амплификация не идет.
Такому числу нуклеотидов отвечает от 0,1 до 1 фг ДНК pHPV, или 7-70 вирусных геномов.
Было также показано, что с помощью пары праймеров GP 5/6 можно амплифицировать разные последовательности-мишени HPV в мазках. Однако при этом в продуктах амплификации обнаруживается много фрагментов клеточной ДНК. Наличие таких коамплифицированных продуктов требует подтверждения присутствия HPV с помощью гибридизации. Праймеры, специфичные для НРV 6, 11, 16, 18,31 и 33, были выбраны потому, что нуклеотидные последовательности ДНК этих типов вирусов уже были установлены. Отбор праймеров проводили так, чтобы можно было дифференцировать разные типы HPV по длине соответствующих ПЦР-продуктов.
- Читать далее "Статегия скрининга HPV. Полимеразная цепная реакция на мазках шейки матки"
Оглавление темы "Выявление микроорганизмов и вирусов с помощью ПЦР":1. Хранение фильтров после гибридизации. Полимеразная цепная реакция
2. Изготовление препаратов для ПЦР. Консервативные и типоспецифичные праймеры вируса папилломы человека
3. Статегия скрининга HPV. Полимеразная цепная реакция на мазках шейки матки
4. Типоспецифичная ПЦР на мазках шейки матки. Блот-гибридизация для выявления вируса папиломы шейки матки
5. Мечение зондов для GP-ПЦР. 5-концевое мечение TS-ПЦР-зондов
6. Особенности скрининга вируса папилломы. Требования к скринингу вируса папилломы
7. Перспективы выявления вируса папилломы. Молекулярные методы обнаружения микроорганизмов
8. Выявление кишечной микрофлоры молекулярными методами. Перенос колоний с селективной среды на твердую подложку
9. Гибридизация нуклеиновых кислот иммобилизованных на фильтрах с ДНК-зондами. Техника гибридизации с ДНК зондами
10. Применение ПЦР для обнаружения патогенных микроорганизмов. Техника выявления микроорганизмов методами ПЦР

