Хранение фильтров после гибридизации. Полимеразная цепная реакция
После выявления зонда фильтры можно хранить во влажном состоянии при 4 С. Можно также сначала смыть гибридизовавшийся зонд и хранить фильтр в сухом виде при 4 С или сразу использовать для повторной гибридизации. Обычно для смывания зонда фильтр выдерживают в трех сменах 0,025% ДСН, по 30 мин в каждой смене, при 68 С.
Необходимость в отмывании отпадает, если после гибридизации с радиоактивно меченным зондом фильтр предполагается хранить до повторной гибридизации длительное время, поскольку по прошествии времени, равного пяти периодам полураспада, радиоактивность зонда уменьшается в 25 раз, т. е. составляет всего 3% от исходной величины.
Если используются нерадиоактивные зонды, то, хотя фермент (щелочная фосфатаза) быстро инактивируется, сама молекуласвидетель остается стабильной, так что отмывание фильтра от гибридизовавшегося зонда абсолютно необходимо. Не рекомендуется повторно использовать для гибридизации те фильтры, на которых проводилась колориметрическая детекция нерадиоактивных зондов; особенно это относится к нитроцеллюлозным фильтрам.
Это связано с тем, что конечный продукт ферментативной реакции, формазан, растворяют с помощью диметилформамида, растворяющего также нитроцеллюлозу. Найлоновые фильтры устойчивы к его действию, однако отмывание их от формазана и гибридизовавшегося зонда — очень трудоемкая и длительная процедура.
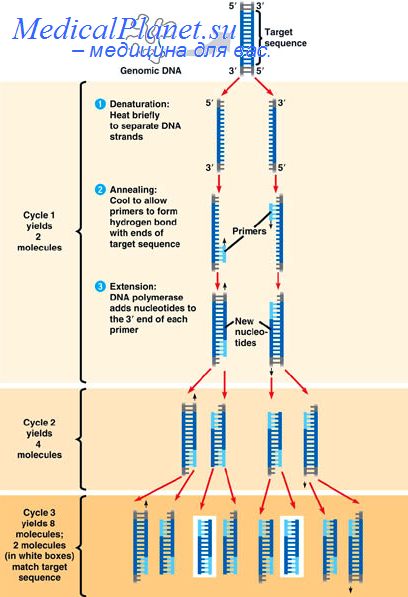
Полимеразная цепная реакция для скрининга вирусов папилломы
Цитологическое исследование мазков шейки матки, впервые предложенное Папаниколау, представляет собой наиболее распространенный метод скрининга рака шейки матки. Применение этого так называемого Pap-метода ограничивается по ряду причин, например возможностью ошибок при взятии мазков в клинике или при микроскопическом исследовании. Поэтому возникла необходимость в более точных и быстрых методах диагностики. Согласно Pap-классификации, цитологические аномалии в мазках делятся на несколько типов: Рар I и Рар II — значительные морфологические изменения; Рар IIIa — слабая или средняя дисплазия; Рар IIIb — сильная дисплазия; Рар IV — рак in situ; Рар V — инвазивный рак.
В настоящее время лечению подвергаются все пациентки с цитологическими аномалиями шейки матки, хотя во многих случаях в этом нет нужды: как показали некоторые исследования. Однако для более точного прогнозирования клинического исхода патологических изменений шейки матки у отдельных женщин требуются дополнительные обследования.
Как показывают результаты изучения вирусной этиологии опухолей, важную роль в развитии шейки матки играют вирусы папилломы человека (HPV). В настоящее время выделено 60 различных типов HPV, 24 из которых связано со слизистой гениталий. Поскольку HPV нельзя культивировать in vitro, а типоспецифичные антитела, необходимые для иммуноцитохимии, отсутствуют, типы HPV в мазках приходится определять путем идентификации вирусных нуклеиновых кислот. Наиболее чувствительным методом обнаружения ДНК HPV сегодня является полимеразная цепная реакция (ПЦР).
Теоретически с помощью ПЦР можно выявить в данном образце ткани всего одну копию последовательности -мишени. Наша группа разработала чувствительный метод ПЦР, который можно использовать для исследования большого числа мазков с нормальной и аномальной цитологией. Это позволило расширить наши знания о роли HPV в развитии рака шейки матки и оценить возможности, которые дает выявление HPV для диагностики предраковых или раковых патологических изменений шейки матки. В данной главе обсуждаются:
а) изготовление препаратов для ПЦР;
б) выявление HPV в соскобах с шейки матки;
в) клинические аспекты: возможное применение ПЦР для скрининга рака шейки матки.
Соскобы берут из патологически измененной части шейки матки; для получения высококачественных мазков рекомендуется пользоваться щеткой Cervex (О. P. Bleker, личное сообщение). Первый мазок используют для рутинного цитологического анализа. Для выявления HPV материал, оставшийся на щетке от первого соскоба, а также материал, полученный при втором соскобе, помещают в 5 мл стерильного ФСБ с 0,05% мертиолатом. Подробное описание изготовления препаратов см. в протоколе.
Важнейшее преимущество, которое дает использование ПЦР в крупномасштабных программах скрининга, — возможность избежать трудоемкого выделения ДН К. Уже описано проведение ПЦР непосредственно на отдельных клетках или в клеточных суспензиях. Если клетки инкубировали с протеиназой К или подвергали кислотному гидролизу с последующей нейтрализацией, то воспроизводимых результатов получить не удавалось. Стабильную успешную амплификацию последовательностей-мишеней HPV обеспечивало замораживание—оттаивание материала до его внесения в среду для ПЦР. Эффективность амплификации после такой обработки близка к эффективности ПЦР, проведенной на очищенной ДНК соскобов, содержавших, как было предварительно установлено, HPV 16, 18 и 33.
- Читать далее "Изготовление препаратов для ПЦР. Консервативные и типоспецифичные праймеры вируса папилломы человека"
Оглавление темы "Выявление микроорганизмов и вирусов с помощью ПЦР":1. Хранение фильтров после гибридизации. Полимеразная цепная реакция
2. Изготовление препаратов для ПЦР. Консервативные и типоспецифичные праймеры вируса папилломы человека
3. Статегия скрининга HPV. Полимеразная цепная реакция на мазках шейки матки
4. Типоспецифичная ПЦР на мазках шейки матки. Блот-гибридизация для выявления вируса папиломы шейки матки
5. Мечение зондов для GP-ПЦР. 5-концевое мечение TS-ПЦР-зондов
6. Особенности скрининга вируса папилломы. Требования к скринингу вируса папилломы
7. Перспективы выявления вируса папилломы. Молекулярные методы обнаружения микроорганизмов
8. Выявление кишечной микрофлоры молекулярными методами. Перенос колоний с селективной среды на твердую подложку
9. Гибридизация нуклеиновых кислот иммобилизованных на фильтрах с ДНК-зондами. Техника гибридизации с ДНК зондами
10. Применение ПЦР для обнаружения патогенных микроорганизмов. Техника выявления микроорганизмов методами ПЦР

