Воротные механизмы катионных каналов клетки - с точки зрения физиологии человека
Оглавление статьи:- Потенциалзависимая активация и инактивация каналов
- Альтернативные сигналы для переключения воротных механизмов
- Резюме
- Список использованной литературы
а) Потенциалзависимая активация и инактивация каналов. Активация потенциалуправляемых каналов представляет собой цепь событий: смещение сенсора электрического потенциала мембраны, затем открытие поры канала; инактивация канала вследствие перекрытия поры с цитоплазматической стороны инактивационным доменом.
Как отмечалось выше, ионный канал имеет два основных состояния — закрытое, когда пора непроницаема, и открытое, когда ионы могут проникать в канал, обеспечивая физиологически важную функцию проводимости.
1. Активация и деактивация канала. Для открывания, т. е. активации канала, необходима затрата энергии, которую обеспечивает классический потенциалзависимый воротный процесс (gating). Это явление, зарегистрированное в NaV-, КV- и СаV-каналах, происходит в результате сдвига мембранного потенциала, запускающего каскад конформационных изменений молекулы канала.
Первый этап каскада — передача электрической энергии сенсору потенциала, который соответствует сегменту S4. Этот трансмембранный сегмент имеет положительный заряд (речь идет о типе канала с 2-8 остатками аргинина и/или лизина), благодаря которому может перемещаться в электрическом поле (рис. 1):
- при деполяризации мембраны сегмент S4 перемещается кнаружи, в сторону внеклеточного пространства;
- при реполяризации сегмент S4 перемещается кнутри, в сторону внутриклеточного пространства.
Как показали исследования клонированных КV-каналов, спираль S4 циклически перемещается, обеспечивая сдвиг 12 положительных зарядов (по три на сегмент S4) во внеклеточное пространство.
Вследствие перемещения S4 окружающие его трансмембранные сегменты, особенно порообразующие сегменты S5 и S6, претерпевают ряд конформационных изменений, главным образом повороты и наклоны. В результате пора, расположенная под селективным фильтром, расширяется и происходит открывание канала (рис. 1).
В отличие от перемещений спирали S4, которые в NaV-, КV и СаV-каналах практически единообразны, характер и скорость конформационных изменений, приводящих к открыванию поры, каналоспецифичны. Так, в NaV-каналах эти процессы протекают менее чем за одну миллисекунду, тогда как в Куканалах продолжаются от 10 до нескольких десятков миллисекунд.
Канал, открывшийся при деполяризации, снова закрывается (деактивируется) при реполяризации мембраны. По сути, этапы деактивации зеркально отражают процесс активации. На первом этапе спираль S4 снова перемещается к внутренней стороне мембраны, перестраивая таким образом порообразующие сегменты; процесс завершается закрытием канала.
2. Инактивация канала. Каналы NаV-типа, как и некоторые КV-каналы (так называемые каналы А-типа), после их активации не остаются открытыми, несмотря на продолжение деполяризации мембраны, а вновь закрываются, так что ионный поток прекращается. Такое закрытие канала, совершаемое буквально за одну миллисекунду, называется инактивацией.
Важная роль в инактивации каналов принадлежит белковым доменам цитоплазмы. В КV-каналах это N-конец α-субъединицы (первые 20-40 аминокислот, отсюда возникло понятие инактивация N-типа) или β-элемент KVβ1. В NaV-каналах это короткий участок, соединяющий 3-й и 4-й сегменты шестисегментного домена (interdomain III-IV linker).
В соответствии с представлениями о четвертичной структуре каналообразующих белков NaV-каналы обладают именно таким инактивационным доменом, тогда как KV-каналы могут иметь до четырех подобных доменов (т. е. все возможные сочетания при гетеромультимеризации α-элементов, имеющих инактивационный домен и не имеющих его).
Инактивация каналов происходит следующим образом. Инактивационный домен проникает в пору (после ее открывания) и там связывается с рецептором в стенке канала (рис. 1). Пока эта связь продолжается, «открытый» канал блокирован (закупорен) инактивационным доменом, который препятствует потоку ионов, иначе говоря, канал инактивирован.
Чтобы инактивация завершилась, необходима реполяризация мембраны. При реполяризации инактивационный домен диссоциирует от рецептора благодаря конформационным изменениям сегмента поры и выходит из поры (инактивация завершилась). В этом состоянии канал способен еще раз открыться на короткое время (reopening), затем снова деактивируется.
Наряду с классической инактивацией N-типа существует более медленный процесс инактивации, обусловленный изменениями конформации каналообразующего белка, прежде всего в области селективного фильтра. Подобный альтернативный механизм инактивации, который можно наблюдать в некоторых КV-каналах, а также в NaV-каналах, получил название инактивации С-типа. Это самостоятельный процесс, однако при инактивации N-типа он может ускоряться до миллисекунд.
С функциональной точки зрения инактивация С-типа важна в двух аспектах. Во-первых, это предпосылка для блокирования NaV-каналов местными анестетиками (лидокаином или бензокаином), а во-вторых, это возможность продления инактивированного состояния NaV- и KV-каналов на период до нескольких секунд (!).
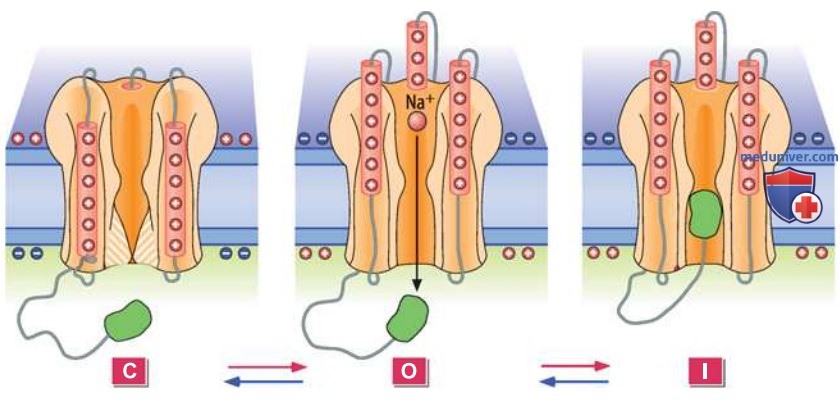
3. Модель состояний воротного механизма канала. Процесс переключения потенциалуправляемого катионного канала упрощенно рассматривается как циклическая реакция системы, состоящая из трех состояний (рис. 1):
- закрытое, когда канал способен к активации (С-состояние);
- открытое (0-состояние);
- инактивированное, когда канал блокирован инактивационным доменом (I-состояние).
При деполяризации мембраны система, находившаяся в сбалансированном С-состоянии, переходит в I-состояние в результате двух последовательных этапов (реакций). Первый этап — активация, представляет собой переход из С-состояния в О-состояние. Второй этап — инактивация, соответствует переключению из О-состояния в I-состояние. В случае гиперполяризации этапы переключения совершаются в обратной последовательности.
Если адаптировать подобную модель к реальным конформационным изменениям каналообразующего белка, то система существенно усложнится, поскольку необходимо добавить несколько С-состояний и I-состояний.
б) Альтернативные сигналы для переключения воротных механизмов. Открывание и/или закрывание ионных каналов может происходить под влиянием разнообразных сигналов: внутриклеточных посредников (мессенджеров), белков, механического натяжения, повышения или снижения температуры, низкомолекулярных блокаторов поры.
Помимо натяжения мембраны или связывания рецептора с нейромедиатором, стимулами для открывания каналов могут служить и другие воздействия. Воротные механизмы классифицируются по природе стимула и по расположению соответствующего «рецептора» в канале.
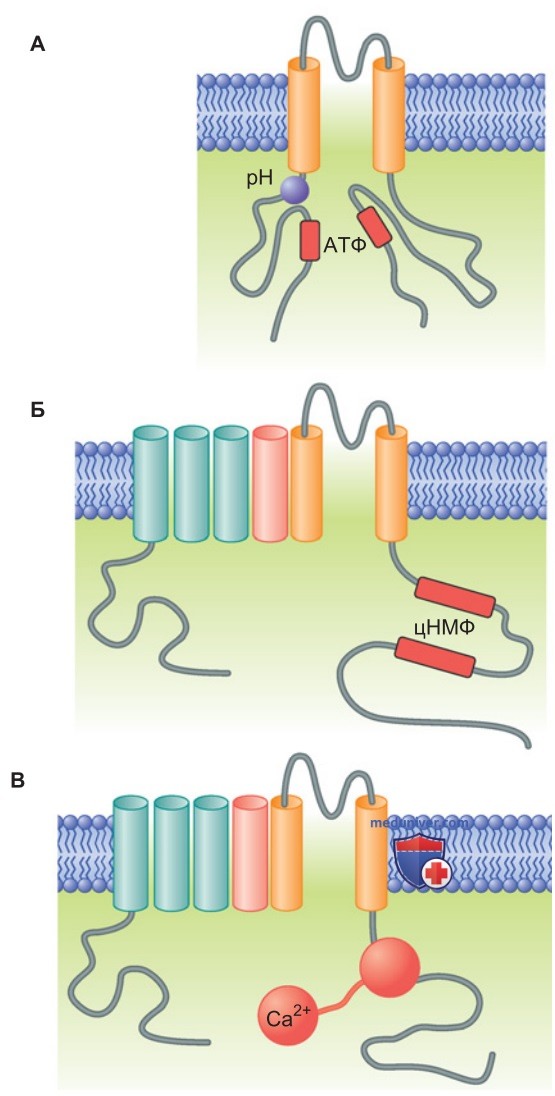
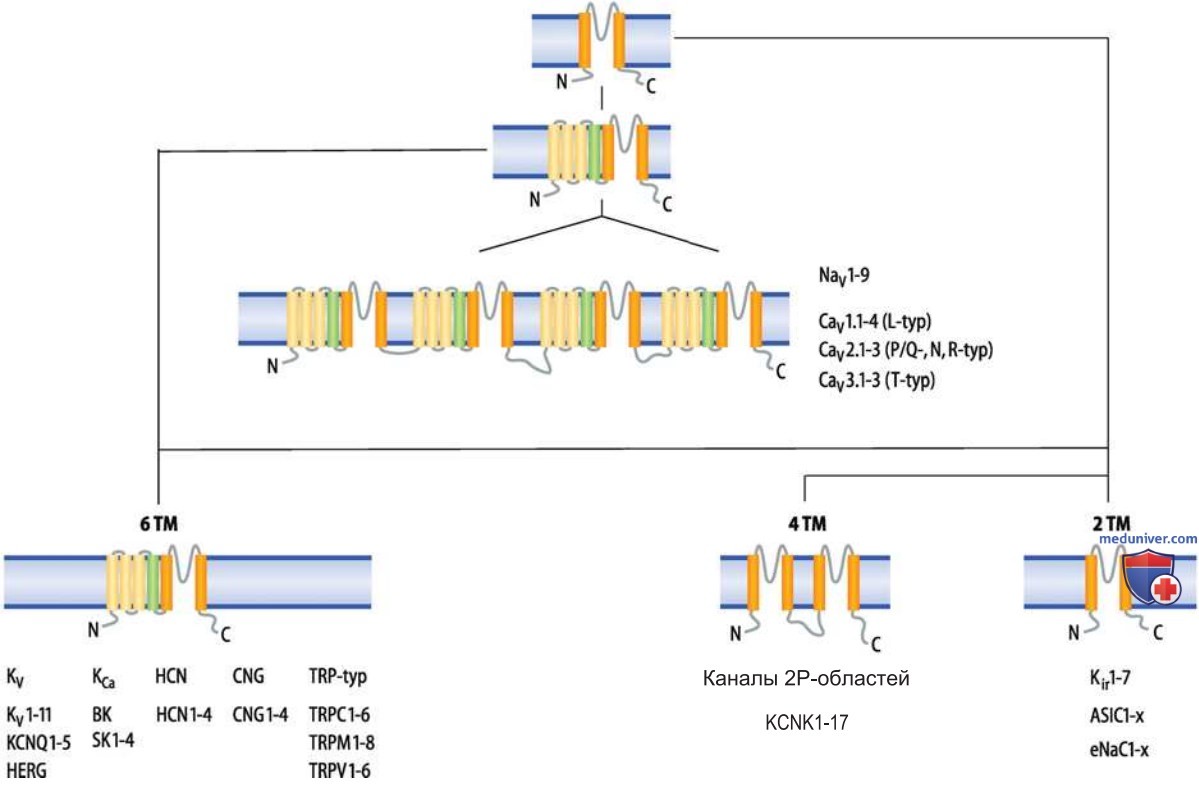
1. Внутриклеточные посредники. Воротные механизмы некоторых каналов приводятся в действие при изменениях концентрации внутриклеточных посредников (мессенджеров) — АТФ, рН, циклических нуклеотидов, Са2+ (рис. 2). Так, двухсегментный K+-канал (Kir6; рис. ниже) с цитоплазматическим участком связывания АТФ (КАТФ-канал) закрывается при высокой концентрации АТФ и активируется при ее снижении.
Посредством К+-каналов этого типа регулируется секреция инсулина в клетках поджелудочной железы (КАТФ).
Другой двухсегментный K+-канал (Kir1, или RОМК; рис. выше) закрывается при снижении внутриклеточного рН (т. е. при высокой концентрации Н+) и открывается при сдвиге реакции в щелочную сторону. Благодаря этим каналам в дистальных почечных канальцах осуществляется секреция K+, участвующая в поддержании кислотно-основного равновесия (каналы типа RОМК). Циклические нуклеотиды (цГМФ и цАМФ) вызывают активацию шестисегментных K+-каналов двух семейств, НCN и CNG (рис. выше), взаимодействуя с участками связывания на С-концевом домене (рис. 2).
Управляющее действие, опосредованное циклическими нуклеотидами, служит основой для электрической реакции сенсорных клеток сетчатки глаза на свет (CNG-каналы), ритмической активности клеток синусового узла сердца, а также некоторых нейронов центральной нервной системы (НCN-каналы).
2. Модулятором воротного механизма целого ряда каналов (среди которых наиболее известны SK- и СаV1-каналы) является Са2+. В качестве рецептора выступает Са2+-связывающий белок кальмодулин, который опосредует связывание Са2+ с проксимальным С-концом α-спирали (рис. 2). При связывании Са2+ с кальмодулином изменяется конформация каналообразующих белков и соответственно их последующая активация (в случае SK-каналов) либо инактивация (в случае СаV1-каналов).
Оба варианта переключения воротного механизма играют важную роль в процессах передачи сигналов в центральных нейронах (следовая гиперполяризация, синаптическое облегчение либо депрессия).
3. Внешние физические факторы (изменение температуры, механическое натяжение, осмотическое давление). Эти факторы тоже могут оказывать влияние на воротный механизм ионных каналов. Так, шестисегментные каналы ТRР-типа (рис. выше) активируются при повышении температуры (TRPV1, TRPV2), охлаждении (TRM8), повышении осмотического давления (TRPV4); при воздействиях противоположного знака эти каналы, наоборот, деактивируются.
Сила натяжения, направленная тангенциально (по касательной к плоскости клеточной мембраны), активирует механочувствительные каналы, характерные, например, для сенсорных клеток внутреннего уха или тактильных рецепторов кожи. Однако до сих пор в геномах млекопитающих не удалось идентифицировать соответствующие гены.
4. Блокирование каналов. Существуют также иные альтернативные факторы, которые вызывают потенциалзависимый блок поры путем воздействия на инактивационные домены воротного механизма NaV- и КV-каналов. Это такие низкомолекулярные структуры, как двухвалентные ионы Mg2+ либо полиамины спермин (SPM4+) и спермидин (SPD3+), обладающие еще более значительными положительными зарядами.
Особого внимания заслуживает блокада NMDA-рецепторов внеклеточным Mg2+, а также блокада калиевых каналов Kir-типа внутриклеточным SPM4+. Поступая в пору с внешней либо с внутренней стороны мембраны, эти блокаторы продвигаются до тех пор, пока не застрянут в узком участке селективного фильтра, перекрывая пору для других ионов. При этом блокада тем прочнее, чем больше электродвижущая сила (см. выше), которая действует на Na+ и K+ (рис. 3).
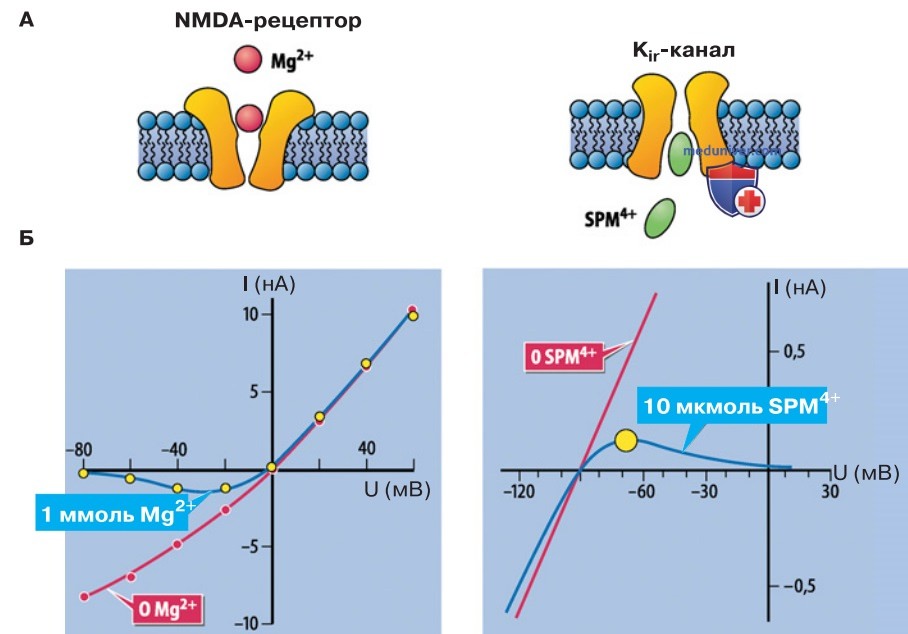
- Потенциалзависимый блок поры. Потенциалзависимость блока каналов ионами Mg2+ и спермином можно объяснить исходя из того, что мембранный потенциал соответствует равновесному потенциалу для проникающих ионов (рис. 3). При равновесном потенциале в физиологических условиях (0 мВ для неселективного NMDA-рецептора и -90 мВ для селективного Кir-канала) блок отсутствует, а при сдвиге мембранного потенциала менее чем на 10 мВ к более отрицательным значениям (для NMDA-рецептора) или к более положительным (для Кir-канала) развивается блок (рис. 3).
Статистистическая вероятность блокады одиночного канала при равновесном потенциале равна 0; при сдвиге потенциала примерно на 10 мВ к отрицательным либо положительным значениям вероятность смещается к 1; при промежуточных значениях потенциала вероятность колеблется между 0 и 1, так что кривая соотношения ток—потенциал имеет форму «горба» или «крюка». Еще одним следствием зависимости влияния блокаторов от электродвижущей силы (а не только от абсолютного значения мембранного потенциала!) является сдвиг вольт-амперной характеристики при изменении равновесного потенциала.
Отсюда следует, что при повышенной внеклеточной концентрации K+ (гиперкалиемии), сопровождаемой смещением блокирующего эффекта спермина (SPM4+) вправо, Kir-каналы останутся открытыми при нормальных значениях мембранного потенциала, при которых они обычно заблокированы.
1. Потенциалуправляемый воротный механизм ионных каналов. Для открывания канала (активации) необходима энергия. При потенциалуправляемом воротном механизме (gating) энергия поступает в результате сдвига мембранного потенциала, запускающего каскад молекулярных процессов. В итоге находящийся внутри канала сенсор потенциала (сегмент S4) получает электрическую энергию. Этот сенсор несет положительный заряд, поэтому при деполяризации он перемещается кнаружи, а при реполяризации — кнутри (перемещение S4).
В процессе перемещения S4 изменяется конформация окружающих трансмембранных сегментов. Это приводит к расширению поры в селективном фильтре и тем самым к открыванию канала.
Канал, открывшийся в результате деполяризации, может при реполяризации мембраны снова закрыться — происходит его деактивация. Закрывание канала при деполяризованной мембране носит название инактивации. Это явление обусловлено перекрытием поры цитоплазматическим инактивационным доменом.
2. Управление воротным механизмом при посредстве различных сигналов. Катионные каналы определенного типа могут открываться под воздействием различных стимулов, например внутриклеточных факторов (вторичных посредников, АТФ, изменений рН или концентрации Са2+), ассоциированных белков, механического натяжения мембраны, повышения или снижения температуры либо закрываться при участии низкомолекулярных блокаторов канальных пор, например Mg2+ или спермина.
- Рекомендуем ознакомиться далее "Анионные каналы клетки - с точки зрения физиологии человека"
Редактор: Искандер Милевски. Дата публикации: 10.9.2024

