Мембранный потенциал покоя и потенциалы действия - с точки зрения физиологии человека
Оглавление статьи:- Диффузионный потенциал
- Мембранный потенциал покоя
- Потенциал действия
- Гиперкалиемический периодический паралич
- Синдром удлиненного интервала QT
- Конгенитальная миотония
- Резюме
- Список использованной литературы
а) Диффузионный потенциал - трансмембранная разность потенциалов. Мембранные потенциалы обусловлены избирательной проницаемостью биологических мембран и неравномерным распределением ионов между внутри- и внеклеточной средой.
Между содержимым живой клетки и внешней средой существует градиент электрического напряжения, так называемый мембранный потенциал. Основу трансмембранной разности потенциалов составляет диффузионный потенциал.
1. Происхождение диффузионного потенциала. Диффузионный потенциал возникает при следующих условиях:
- при неравномерном распределении по обе стороны мембраны ионов некоторого определенного типа (градиент концентрации);
- при избирательной проницаемости мембраны для этих ионов.
Причину возникновения диффузионного потенциала объясняют на основе следующей модели клетки. Внутри клетки концентрация ионов K+ выше, чем снаружи, причем мембрана пропускает в клетку только K+ (рис. 1).
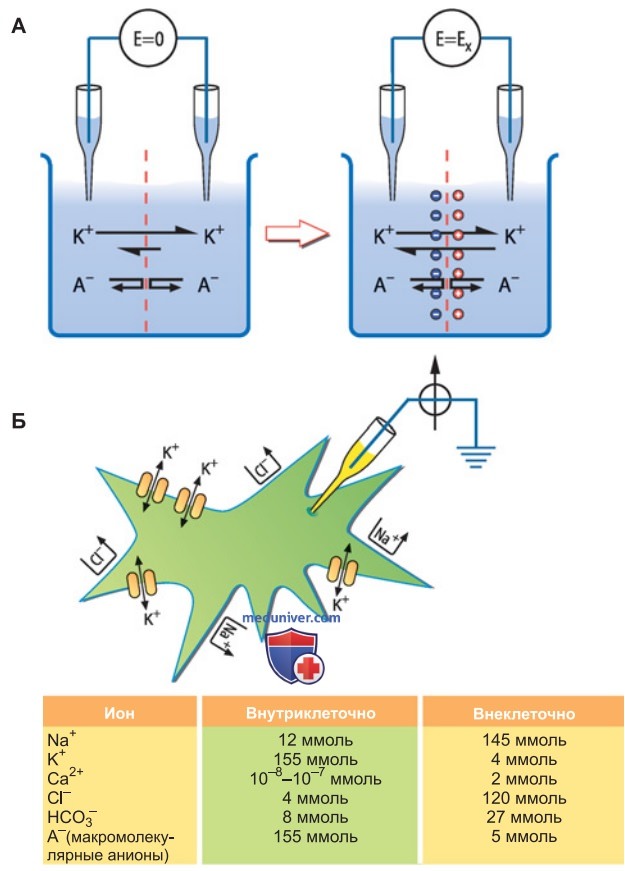
Исходно разность потенциалов отсутствует, поскольку по обе стороны мембраны количество положительных и отрицательных ионов одинаково (электрическая нейтральность). Вначале единственной движущей силой для потока ионов через избирательно проницаемую мембрану служит градиент концентрации, вследствие которого из клетки выходит больше K+, чем в обратном направлении.
Поскольку мембрана пропускает только K+, вместо каждого выходящего иона K+ в клетке остается анион.
В результате по обе стороны мембраны возникает разница зарядов, т. е. создается трансмембранная разность потенциалов, или электрическое напряжение между внутри- и внеклеточной средой. Это напряжение становится движущей силой для ионов, которая противостоит диффузии, вызванной градиентом их концентрации. Процесс достигает равновесия, когда электрическая и химическая движущие силы уравниваются.
После установления равновесия из клетки в единицу времени выходит такое же количество K+, которое проникает в нее. Величина возникшего трансмембранного потенциала остается постоянной до тех пор, пока не изменится концентрация ионов и через мембрану не пойдет ионный ток.
2. Уравнение Нернста. Для описания диффузионного потенциала используется уравнение Нернста:
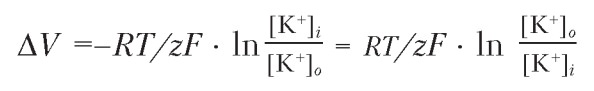
Значение потенциала зависит от концентрации ионов по обе стороны мембраны, от абсолютной температуры (Т), а также от постоянных R и F.
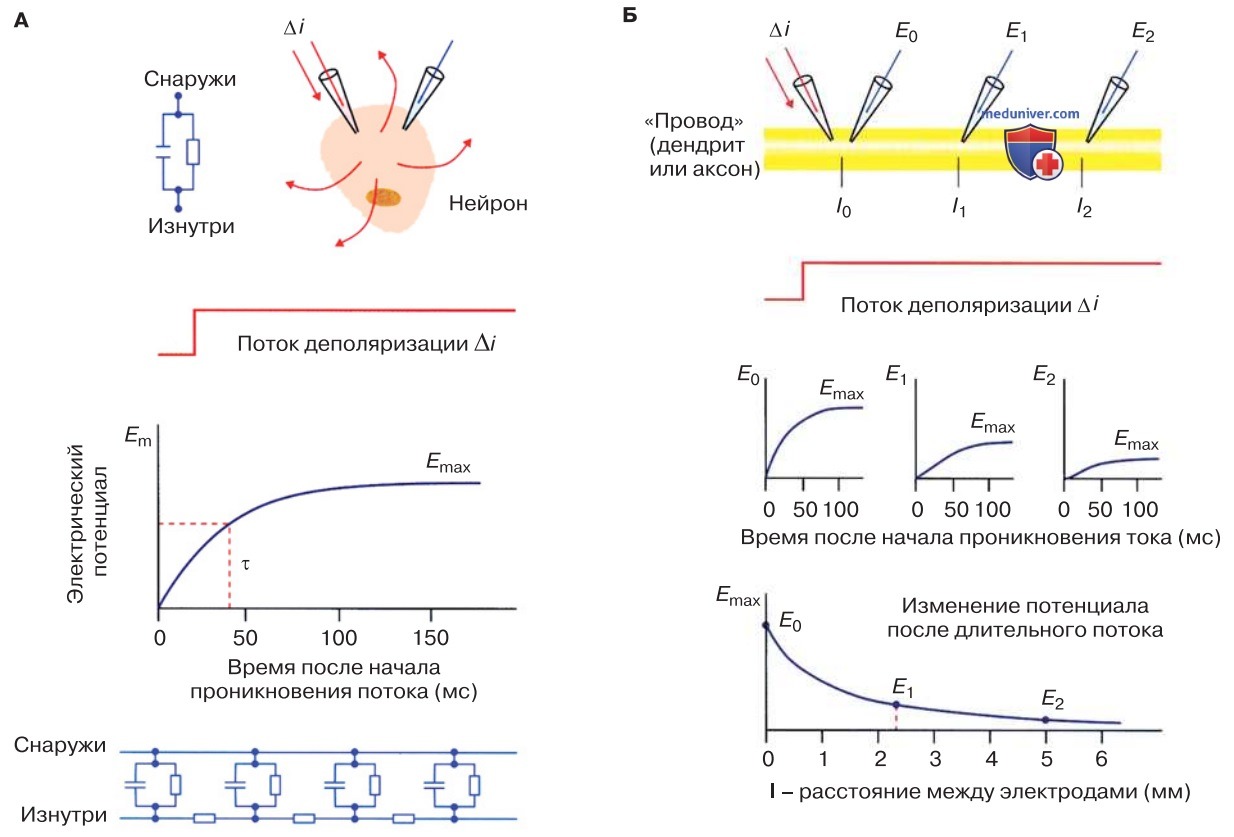
Диффузионный потенциал подчиняется элементарным физическим законам и его легко воспроизвести в эксперименте, например поместив избирательно проницаемую искусственную мембрану между двумя отделениями сосуда, содержащими растворы с разной концентрацией иона (рис. 1).
Уравнение Нернста корректно описывает мембранный потенциал только в тех случаях, когда мембрана пропускает исключительно ионы одного вида, что бывает крайне редко. Поэтому обычно уравнение позволяет рассчитать лишь приблизительное значение мембранного потенциала.
3. Уравнение Гольдмана. Когда мембрана пропускает потоки ионов нескольких видов, мембранный потенциал можно вычислить на основе уравнения Гольдмана-Ходжкина-Катца (Goldman-Hodgkin-Katz, GHK):
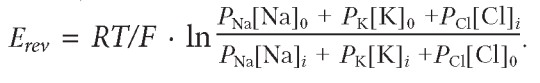
Это уравнение позволяет рассчитать мембранный потенциал в случае проницаемости к нескольким различным ионам, например Na+, K+, и Cl-.
При равновесном потенциале сумма всех ионных токов равна нулю. При этом равновесное значение трансмембранной разности потенциалов зависит от токов всех проникающих ионов. В свою очередь, амплитуды ионных токов определяются мембранным потенциалом и концентрациями ионов (см. потенциалзависимый блок поры), поэтому рассчитать их можно только приблизительно. Согласно уравнению Гольдмана-Ходжкина-Катца ионный ток представляет собой функцию концентраций ионов и проницаемости мембраны (Р).
По закону Фика, проницаемость рассчитывается как отношение коэффициента диффузии (D) к толщине мембраны (d): Р = D/d.
б) Мембранный потенциал покоя. Во многих клетках потенциал покоя соответствует диффузионному потенциалу для K+. В состоянии покоя K+-проводимость клеточной мембраны преимущественно обеспечивают потенциалнезависимые Kir-каналы внутреннего выпрямления (их также называют выпрямляющими входными К+-каналами, inward rectifiers), которые пропускают входящие, но невыходящие К+-токи, способствуя стабилизации мембранного потенциала на уровне покоя; кроме того, участвуют двупоровые К+-каналы (с 2Р-доменами).
Почти во всех возбудимых клетках организма млекопитающих мембранный потенциал покоя примерно равен диффузионному потенциалу, иными словами, калиевому равновесному потенциалу (ЕK) (рис. 2); приблизительные значения потенциала покоя составляют (со знаком «минус»): 70 мВ для нейронов, 90 мВ для клеток нейроглии; 90 мВ для клеток скелетных мышц и миокарда. Как известно, условием возникновения диффузионного потенциала в клетке является наличие открытых, т. е. проницаемых, K+-каналов.
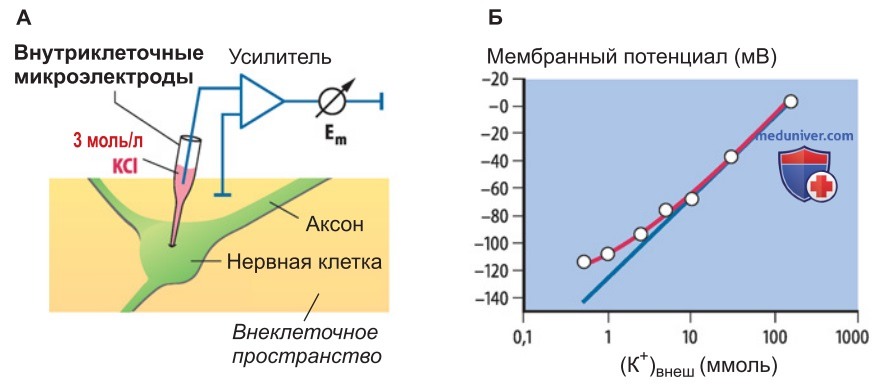
Если мембранный потенциал более отрицателен, чем -70 мВ, в открытом состоянии могут находиться лишь немногие типы К+-каналов. Сюда относятся потенциалнезависимые K+-каналы аномального выпрямления (или внутреннего выпрямления, т. е. Kir-каналы, inward rectifiers) и двупоровые K+-каналы (с 2Р-доменами), а также потенциалуправ-ляемые К+-каналы KCNQ-типа (KCNQ4), которые первыми полностью деактивируются при мембранном потенциале, значительно более отрицательном, чем -100 мВ.
Все остальные потенциалуправляемые К+-ка-налы (особенно Кv-каналы) закрыты при классическом уровне мембранного потенциала покоя и, следовательно, не участвуют в его формировании. Каким именно типом К+-канала обеспечивается потенциал покоя, зависит от функциональных свойств клетки (от ее принадлежности к определенному типу ткани).
Так, Кir-каналы присутствуют в клетках миокарда, скелетных мышц, многих эпителиальных тканей, нейроглии и в некоторых центральных нейронах, в то время как двупоровые К+-каналы (с 2Р-доменами), часто называемые «фоновыми каналами», определяют потенциал покоя большинства центральных ЦНС.
- Если мембранный потенциал покоя достигает значений, более положительных, чем -60 мВ (например, при повышении Na+-проводимости), то открываются потенциалуправляемые КV-каналы, которые выпускают из клетки ионы K+, поддерживая мембранный потенциал на уровне -60 мВ.
в) Потенциал действия. После того как мембранный потенциал превысит пороговое значение, в возбудимой клетке генерируется потенциал действия (ПД); NаV-каналы обеспечивают деполяризацию мембраны, а КV-каналы (которым свойственна более медленная скорость открывания) — реполяризацию.
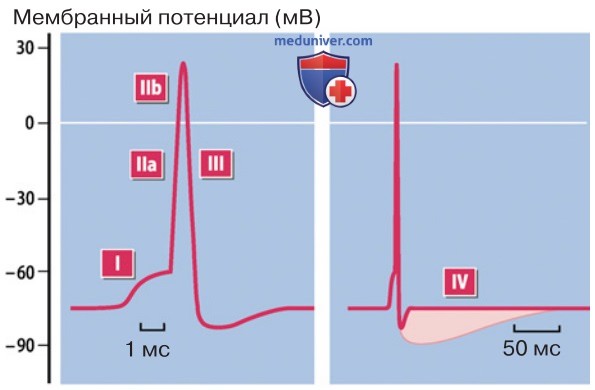
1. Потенциал действия — это кратковременный сдвиг мембранного потенциала в положительном направлении, вызванный стимулом, который деполяризовал клетку выше уровня порогового потенциала. Стереотипный временной ход событий, составляющих ПД, можно представить в виде нескольких фаз (рис. 3):
- инициация (преодоление уровня порогового потенциала);
- деполяризация (фаза нарастания ПД — вплоть до овершута, т.е. реверсии полярности);
- реполяризация;
- следовая гиперполяризация.
Быстрые изменения мембранного потенциала обусловлены сдвигами проницаемости мембраны для ионов Na+ и К+ в определенной временной последовательности (рис. 4). В некоторых клетках, например в кардиомиоцитах, в развитии ПД также участвуют потенциалзависимые Са2+ -каналы.
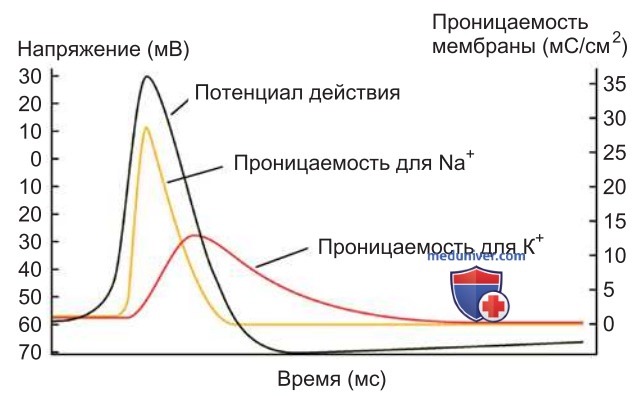
2. Деполяризация. Чтобы возник ПД, стимул должен деполяризовать мембрану до порогового уровня (иными словами, порога возбуждения — фаза инициации, рис. 4). Это означает, что входящий в клетку поток катионов (Na+ , Са2+ ), вызванный стимулом, более значителен, чем выходящий поток К+, который характерен для потенциала покоя и противодействует деполяризации.
Если деполяризация преодолеет пороговый уровень, начинается восходящая фаза потенциала действия, обусловленная активацией NaV-каналов. Поскольку воротный механизм активируется потенциалом, ионные каналы при величине мембранного потенциала положительнее значения -60 мВ начинают переходить в открытое состояние (рис. 4).
Входящие через них ионы Na+ обеспечивают нарастание деполяризации, которое благодаря положительной обратной связи приводит к дальнейшей активации NaV-каналов. В результате такого быстрого «взрывного» потока Na+ мембрана деполяризуется до уровня натриевого равновесного потенциала (ENa — +60 мВ). На вершине ПД трансмембранная разность потенциалов меняет свой знак и достигает значения от 0 до 40 мВ (овершут).
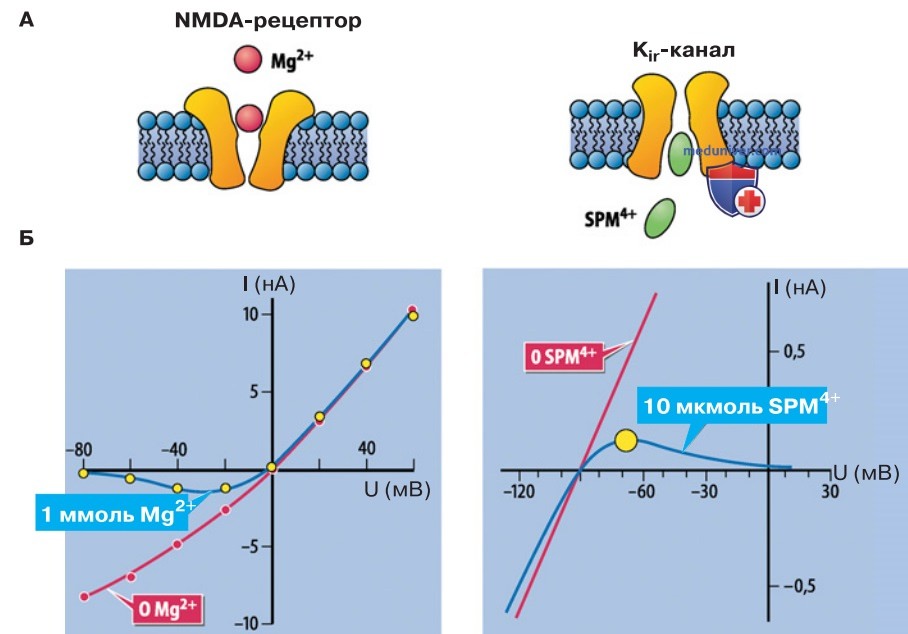
- Распространение потенциалов действия. Достигнув порога возбуждения, ПД распространяется в соответствии с известной формулировкой по закону «все или ничего». Генерацию ПД обеспечивают два процесса. Во-первых, это потенциалуправляемая активация NaV-каналов с положительной обратной связью между деполяризующим Na+-током и активацией каналов; во-вторых — сильный потенциалуправляемый блок Kir-каналов внутриклеточным катионом спермином.
Инициирующая деполяризация (стимул) преодолевается явлением «отрицательного импеданса» (рис. ниже, «сперминовый горб» — спад кривой зависимости ионного тока от потенциала), который способствует ослаблению блока Кir-каналов. Поскольку выходящий тормозный К+-ток резко прекращается, результирующий стимул может изменить заряд мембраны, что при соучастии NaV-ка-налов приводит к быстрой деполяризации клетки.
P.S. Гиперкалиемический периодический паралич:
1) Симптомы и признаки. Основной симптом этого заболевания — приступы мышечной слабости, вызванные нарушением функции натриевых каналов NaV 1.4 скелетных мышц. Приступы длятся от нескольких минут до нескольких часов, может преобладать средняя степень мышечной слабости, либо развивается генерализованный вялый паралич.
2) Причины. Мышечная слабость наступает в результате длительной деполяризации мышечных волокон, например из-за повышенной концентрации K+ в крови (рис. 5). Такая продолжительная деполяризация может возникать при нарушении инактивации потенциалуправляемых натриевых каналов. В то время как нормальные каналы NaV 1.4 полностью инактивируются в течение нескольких миллисекунд, при генной мутации каналы открываются вновь. При «повторных открываниях» каналов наблюдается персистирующий натриевый ток и возникает длительная деполяризация.
Это приводит к инактивации еще большего количества Na-каналов и препятствует генерации ПД; следствием является мышечная слабость.
3. Реполяризация. При сильной деполяризации воротный механизм инактивирует NaV-каналы в течение нескольких миллисекунд, прекращая вход Na+ в клетку. Благодаря отсутствию деполяризующего Na+-тока, а также медленному открыванию KV-каналов начинается выход K+ из клетки; это соответствует фазе реполяризации ПД (рис. 3 и 4). Во время реполяризации мембранный потенциал снова приближается к уровню ЕK. Таким образом, ПД завершен и развиваются последующие воротные процессы:
- KV-каналы деактивируются;
- происходит разблокирование калиевых каналов внутреннего выпрямления (Kir-каналов), так что они опять способны обеспечивать К+-проводимость, необходимую для формирования мембранного потенциала покоя;
- NaV-каналы возвращаются в активируемое закрытое состояние.
Вследствие перехода NaV-каналов в состояние инактивации ограничивается возможность повторного возбуждения клетки после ПД. В течение абсолютного рефрактерного периода (~2 мс после завершения ПД) новое возбуждение невозможно (даже под действием сильного деполяризующего стимула). Затем следует относительный рефрактерный период, когда порог возбуждения повышен, а возникающие ПД имеют низкую амплитуду. Таким образом инактивация натриевых каналов выполняет двойную функцию: приостанавливается генерация ПД и, кроме того, мембрана защищена от преждевременного повторного возбуждения.
4. Следовая гиперполяризация. Во многих нейронах, а также в некоторых других возбудимых клетках мембранный потенциал после ПД имеет более отрицательные значения, чем непосредственно перед ПД (рис. 3). Такое явление, называемое следовой гиперполяризацией, представляет собой кратковременную дополнительную K+-проводимость, ассоциированную с ПД. Этот вид проводимости обеспечивают кальцийактивируемые калиевые каналы (SK-, ВК-каналы; см. Приложение, табл. А2).
Они активируются ионами Са2+, вошедшими в клетку по СаV-каналам во время ПД, и остаются открытыми до тех пор, пока внутриклеточная концентрация Са2+ не упадет до значения <100 нМ. При дальнейшем снижении внутриклеточной концентрации Са2+, для которого может потребоваться от нескольких десятков миллисекунд до нескольких секунд работы Са2+-насоса (!), каналы снова закроются, а мембранный потенциал приблизится к значениям, наблюдавшимся до возникновения ПД.
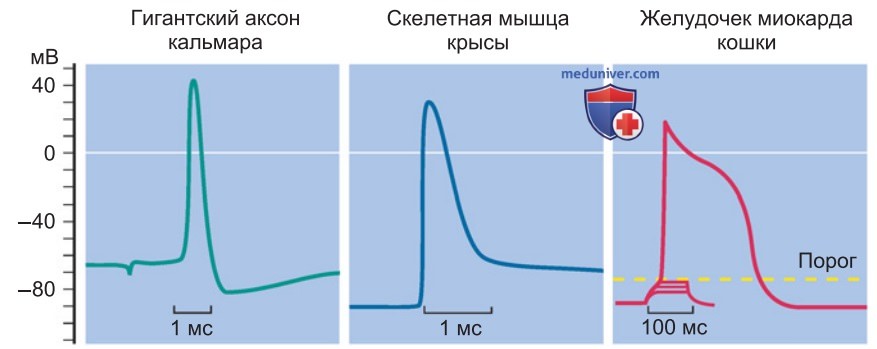
5. Длительность потенциала действия зависит от количества участвующих ионных каналов, но прежде всего — от свойств их воротного механизма. Благодаря быстро активируемым KV-каналам возникают короткие ПД (~1 мс в различных центральных нейронах), тогда как при более медленной активации генерируются длительные ПД (~10 мс в клетках скелетных мышц).
Если наряду с NaV-каналами деполяризацию поддерживают другие структуры, например CaV-каналы, или же реполяризацию преимущественно обеспечивают крайне медленно активируемые KV-каналы, ПД может быть еще более продолжительным (~300 мс в клетках миокарда; рис. 6).
P.S. Синдром удлиненного интервала QT. Синдром представляет собой одну из форм сердечной аритмии. У молодых пациентов нередко возникает потеря сознания (синкопальное состояние); не исключена внезапная смерть.
1) Патогенез. При регистрации ЭКГ наблюдается удлинение интервала QT, ассоциированное с увеличением длительности ПД кардиомиоцитов. При генетических формах заболевания идентифицированы пять патологических генных мутаций; продукты экспрессии этих генов участвуют в кодировании ионных каналов (см. Приложение, табл. А2). Два кодируемых домена соответствуют α- и β-субъединицам K+-каналов кардиомиоцитов, KCNQ1 (или KvLQT1) и KCNE1 (которая часто обозначается как minK или IsK).
Мутация β-субъединицы KCNE1 обусловливает крайне медленную активацию KCNQ1-каналов; это объясняет чрезвычайную продолжительность реполяризации (более 300 мс) в клетках миокарда желудочков. Мутация KCNQ1-каналов приводит прежде всего к редукции К+-токов, тогда как мутация KCNE1-влияет в основном на работу воротного механизма.
Оба типа каналопатии замедляют реполяризацию и, следовательно, увеличивают продолжительность ПД в миокарде. KCNQ1- и KCNT1 -каналы выявлены не только в кардиомиоцитах, но и в сосудистой полоске (stria vascularis) улиткового лабиринта (компонент внутреннего уха), где они обеспечивают секрецию K+ в эндолимфу. Этот дефект вызывает нейросенсорную тугоухость.
1) Симптомы и признаки. Заболевание характеризуется тугоподвижностью мышц во время произвольных движений. Пациент испытывает затруднения, когда он пытается встать, или побежать, или разогнуть пальцы после рукопожатия. Поскольку скованность мышц появляется только при повторных движениях, ограниченность двигательных возможностей пациента рассматривается как относительная.
2) Причины. Тугоподвижность мышц обусловлена генерацией спонтанных ПД в мышечных волокнах после возбуждения, вызванного нервным импульсом. Такая гипервозбудимость обусловлена снижением хлорной проводимости вследствие патологии мышечных хлорных каналов ClC-1. В отличие от большинства других возбудимых клеток, волокна скелетных мышц обладают выраженной хлорной проводимостью. Хлорные каналы не участвуют непосредственно в формировании потенциала покоя мембраны волокон скелетных мышц, но при определенных условиях стабилизируют его.
В трубочках Т-системы во время фазы реполяризации при ритмических сериях ПД повышается внеклеточная концентрация K+, поскольку не все количество K+, высвобождаемого из клеток, может полностью выходить из узкого просвета трубочек. В результате мембрана Т-трубочек деполяризуется. В здоровой мышце при деполяризации Т-трубочек потенциал сарколеммы не изменяется, так как гипервозбудимость подавлена вследствие высокой хлорной проводимости мышечной мембраны.
При конгенитальной миотонии такая проводимость отсутствует, и когда в Т-трубочках возрастает концентрация K+, деполяризуется также часть плазматической мембраны. В итоге возникает следовая деполяризация, способная при соответствующей амплитуде вызвать ПД.
1. Мембранный потенциал покоя. Для возникновения диффузионного потенциала требуется градиент концентрации, а также избирательная проницаемость мембраны.
Мембранный потенциал покоя соответствует диффузионному потенциалу для K+; в возбудимых клетках он составляет от -70 до -90 мВ. Необходимую для создания потенциала покоя калиевую проводимость обеспечивают К+-каналы внутреннего выпрямления (Kir-каналы) и двупоровые К+-каналы.
2. Потенциал действия. Потенциал действия — это кратковременный сдвиг мембранного потенциала, достигающий амплитуды примерно +40 мВ; его можно подразделить на следующие фазы.
• Инициация: блокада Кir-каналов входящим деполяризующим потоком катионов, который индуцирован стимулом (сперминовая блокада).
• Деполяризация (нарастание амплитуды и овершут): активация потенциалуправляемых NaV-каналов и вход в клетку ионов Na+.
• Реполяризация: инактивация NaV-каналов и активация KV-каналов; вход К+. Реполяризация обеспечивает разблокирование Кir-каналов, а также возврат NaV-каналов в активируемое состояние.
• Следовая гиперполяризация (в нейронах ЦНС): кратковременная активация Са2+-управляемых К+-каналов.
Видео физиология возбуждения тканей (потенциал покоя, потенциал действия) - профессор, д.м.н. П.Е. Умрюхин
- Рекомендуем ознакомиться далее "Распространение электрических сигналов в мембране нейронов - с точки зрения физиологии человека"
Редактор: Искандер Милевски. Дата публикации: 10.9.2024

