Синаптические рецепторы - с точки зрения физиологии человека
Оглавление статьи:- Ионотропные рецепторы
- Десенситизация (десенсибилизация)
- Лигандуправляемые анионные каналы
- Глутаматергические рецепторные каналы
- Рецепторы непрямого сопряжения с лигандом
- Газообразные медиаторы
- Коротко
- Список использованной литературы
а) Ионотропные рецепторы. Ионные каналы непосредственного сопряжения с лигандом составляют единую молекулу с рецептором; иными словами, это ионотропные рецепторы.
1. Рецепторные каналы, или ионотропные рецепторы. Их макромолекула объединяет функции связывания с агонистом и активации ионного канала. Такого рода «быстрыми» синаптическими рецепторами обладают концевые пластинки (рис. ниже), большинство глутаматергических синапсов, а также тормозные глицинергические и ГАМКергические синапсы.
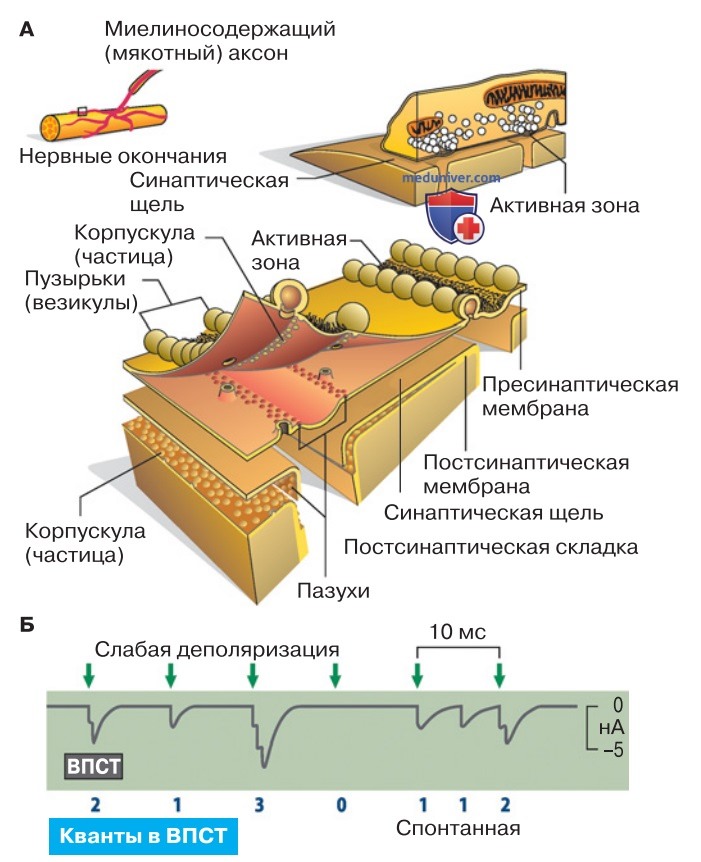
2. Никотиновые ионотропные рецепторы концевой пластинки. Взаимодействие рецептора с агонистом (А) наиболее подробно изучено на активируемых ацетилхолином (АцХ) ионных каналах концевой пластинки, которые связываются с двумя молекулами АцХ. Деятельность такого канала представлена на рис. 1.
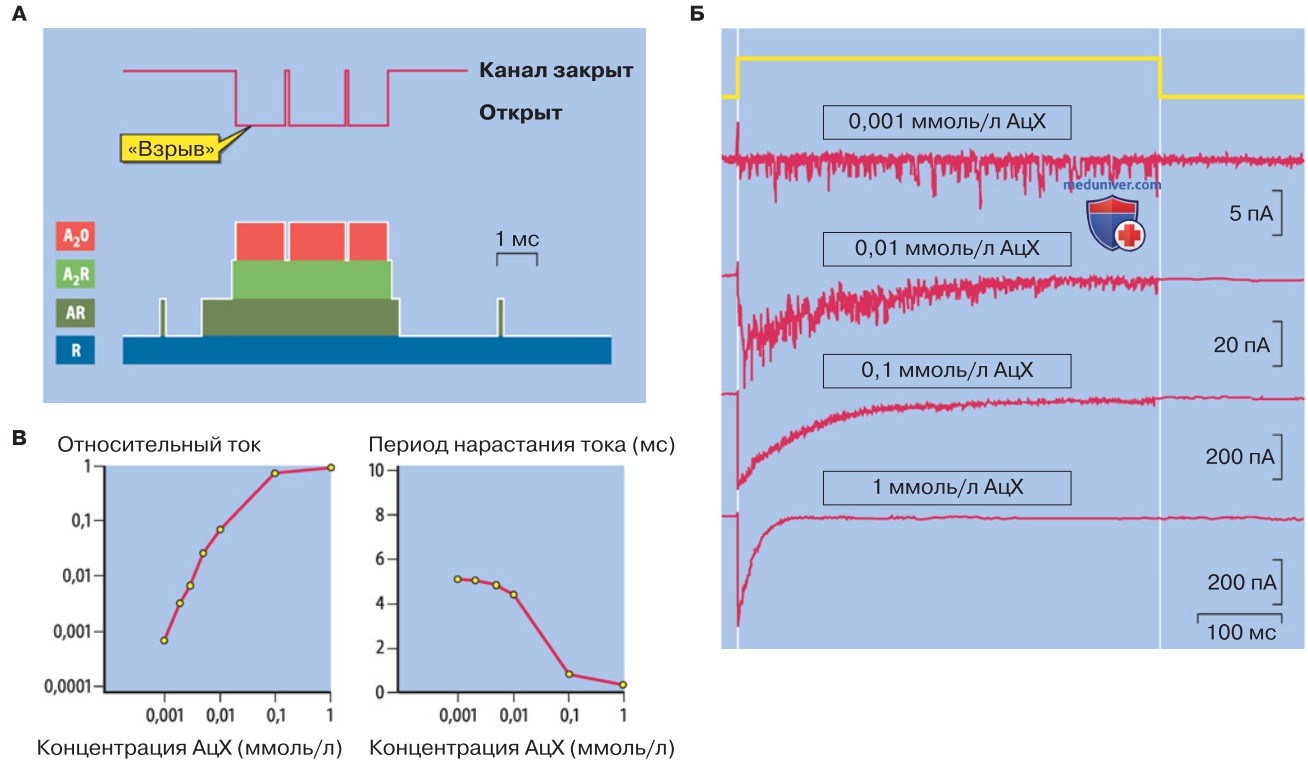
Верхняя запись на схеме отражает открывание канала при связывании с двумя молекулами агониста (А2О). Открывание каналов происходит с короткими интервалами в виде разрядов; при этом молекулы каналов подвергаются быстрой конформационной перестройке из открытого состояния А2О в закрытое состояние А2R и обратно (рис. 1).
Такого рода разряды характерны для всех ионных каналов, непосредственно сопряженных с лигандами, например для потенциалзависимых К+-каналов; это прямая химическая синаптическая передача.
б) Десенситизация (десенсибилизация). Ионные каналы непосредственного сопряжения с лигандами (ионотропные рецепторы) десенситизируются в присутствии медиатора: вероятность открывания канала снижается с течением времени.
1. Десенситизация (десенсибилизация) АцХ-рецепторов. При аппликациях АцХ с короткими интервалами вероятность открывания рецепторов неизменна только при концентрации АцХ примерно 2 мкмоль/л; при высоких концентрациях АцХ частота открытого состояния каналов вначале достигает максимума, а затем быстро снижается.
Десенситизация означает закрывание каналов, т. е. переход из состояния А2О к состоянию А2D (на рис. 1 это состояние не обозначено). Переход осуществляется при концентрации АцХ, равной 1 ммоль/л, с постоянной времени 20-50 мс (рис. 1).
P.S. Ночная лобная эпилепсия:
- Симптомы. Семейная ночная лобная эпилепсия — редкое заболевание с аутосомно-доминантным типом наследования. Во время 1-й и 2-й фаз медленного сна возникают серии коротких приступов гипермоторных актов. Заболевание может дебютировать практически в любом возрасте — от раннего детского до позднего зрелого возраста. Возможна генерализация пароксизмов, вплоть до потери сознания.
- Патогенез. У пациентов выявлены мутации генов никотиновых АцХ-рецепторов. Мутациям подвержены гены, кодирующие наиболее распространенный тип нейронных никотиновых АцХ-рецепторов. Некоторые из этих мутаций становятся причиной ускоренной десенситизации рецепторов (рис. 1), однако неясно, каким образом это ассоциировано с приступами судорог.
- Лечение. Часть пациентов благоприятно реагируют на противосудорожный препарат карбамазепин, но механизм действия до конца не изучен.
Вероятность открывания каналов быстро достигает максимума при высокой концентрации АцХ (1 ммоль/л) и падает при снижении концентрации (рис. 1). При низкой концентрации АцХ спад вероятности открывания каналов более значителен, чем следовало ожидать в том случае, если бы он был пропорционален концентрации АцХ; это объясняется связыванием двух молекул АцХ при открытии канала (рис. 1). Время достижения первоначального максимума зависит от концентрации АцХ.
3. Десенситизация (десенсибилизация) других каналов. Десенситизация свойственна всем лигандуправляемым каналам; ее скорость существенно различается для каналов разного типа. Видимо, десенситизация — это механизм предотвращения слишком сильной и продолжительной активации синапсов. С этой точки зрения десенситизация аналогична инактивации Na+-каналов.
4. Установлена аминокислотная последовательность АцХ-активируемого канала двигательной концевой пластинки, получившего известность как никотиновый ацетилхолиновый рецептор (по названию специфического агониста). Рецептор имеет молекулярную массу 268 000 и состоит из пяти близких по размеру и другим характеристикам субъединиц, окружающих центральную пору.
Некоторые другие лигандуправляемые каналы сходны с никотиновым рецептором по структуре; вероятно, эти молекулы родственны. Среди разнообразных каналов существует много вариантов структуры, определяющих различие свойств каналов, в частности спектры действия агонистов и антагонистов.
в) Лигандуправляемые анионные каналы. Ионные каналы ГАМКA-рецепторов и глицинергических рецепторов пропускают ионы Cl- и HCO3- и обычно реализуют торможение.
1. Комплексы ионного канала с ГАМКA-рецептором либо рецептором глицина принадлежат к тому же семейству, что и рецепторные каналы, активируемые АцХ, однако они проницаемы не для катионов, а для анионов (Cl- и HCO3-); при их открывании обычно происходит торможение. Каналы рецепторов глицина обеспечивают в спинном мозге возвратное торможение α-мотонейронов клетками Реншоу. Каналы рецепторов состоят из α- и β-субъединиц.
Функция глицинергического рецепторного канала нарушается при замене в а-субъединице определенной аминокислоты около участка связывания. В случае мутации аК276Е уменьшается крутизна кривой дозозависимости эффекта глицина, а график смещается вправо (рис. 2). На рисунке в центре также видно, что время открытого состояния канала укорачивается. Таким образом, эта мутация изменяет как связывание рецептора с агонистом, так и кинетику канала.
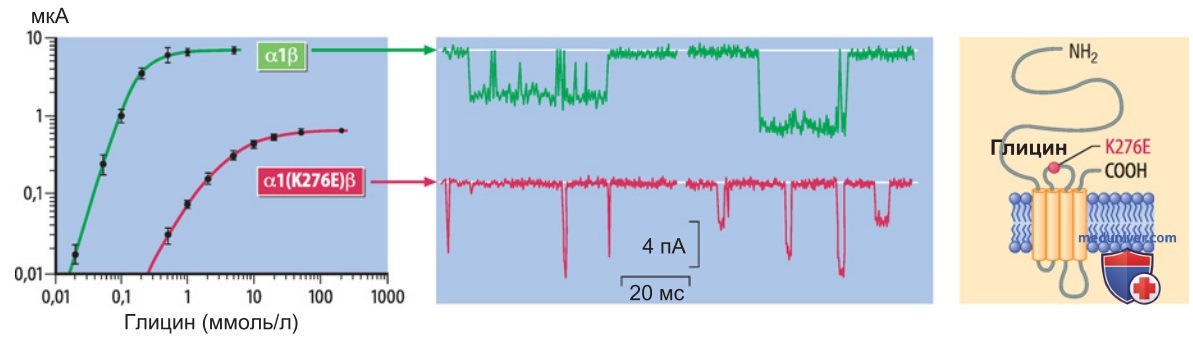
Подбирая кинетические схемы реакций для такого рода данных, можно выявить влияние на конкретный элемент структуры рецепторного канала (на участок связывания либо на пору). Что касается нашего примера, то, несмотря на близость мутации к участку связывания агониста (рис. 2, справа), изменились процесс открывания канала и кинетика поры. Такая мутация обнаружена у пациентов со стартл-синдромом, или гиперэкплексией.
Это редкое наследственное неврологическое заболевание, при котором повышен мышечный тонус и вследствие недостаточного спинального торможения возможна избыточная реакция на испуг.
г) Глутаматергические рецепторные каналы. Многие глутаматергические синапсы имеют одновременно два типа рецепторных каналов.
1. NMDA-рецепторы и АМРА/каинатные рецепторы. Глутаматергические рецепторные каналы получили названия по специфическим агонистам: N-метил-D-аспартатные рецепторы (NMDA-тип) и АМРА/каинатные рецепторы (А/К-рецепторы, или не-NMDA-тип) (рис. 3). NMDA-рецепторы не открываются при отрицательных значениях мембранного потенциала, так как их пора блокирована ионами Mg2+.
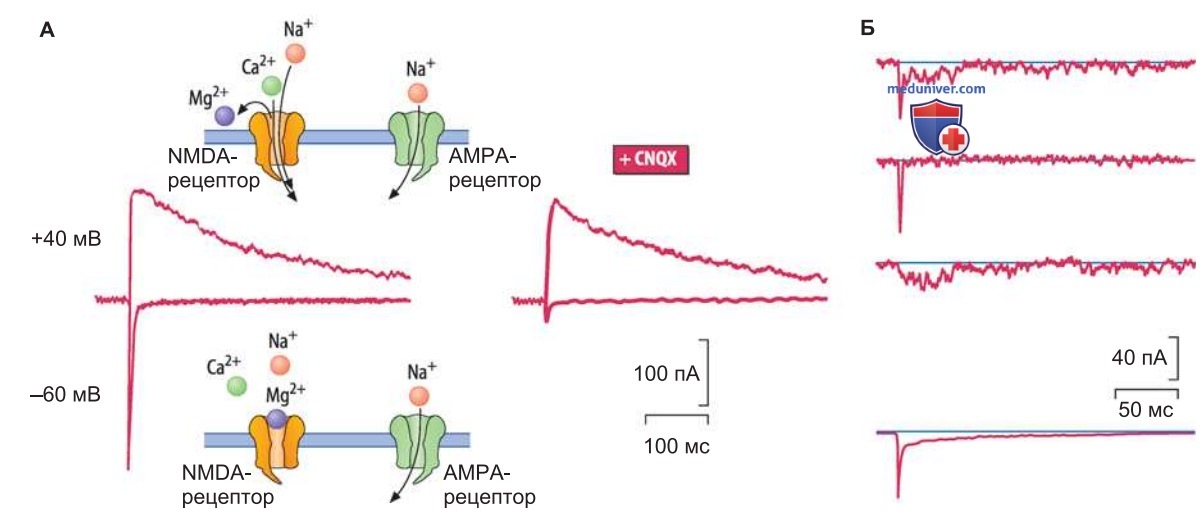
NMDA-рецепторы обладают высоким сродством к глутамату и на изменения концентрации глутамата отвечают медленнее, чем АМРА/каинатные рецепторы. При деполяризации мембраны ионы Mg2+ вытесняются из NMDA-ре-цепторных каналов и эти каналы открываются. Отсюда понятно, почему длительность ВПСТ различается при мембранных потенциалах +40 и -60 мВ (рис. 3). CNQX, антагонист не-NMDA-рецепторов, блокирует быстрый компонент ВПСТ (рис. 3).
P.S. Эксайтотоксичность:
- Патогенез. Возбуждающие аминокислоты (в первую очередь рассматривается глутамат) в высоких концентрациях могут повреждать нервную систему, вплоть до гибели клеток ЦНС. Избыточное высвобождение глутамата возможно при эпилепсии, черепно-мозговой травме, гипоксии, ишемии мозга. Токсический эффект может инициировать пищевой глутамат, например добавленный в качестве приправы (синдром китайского ресторана).
Наконец, подобным действием могут обладать агонисты рецепторов глутамата, например домоат (случаи отравления амнестическим ядом моллюсков).
Гиппокамп — это область нашего мозга, наиболее чувствительная к возбуждающим нейротоксинам. Вероятно, повреждение ткани, вплоть до гибели клеток, происходит вследствие избыточного входа Са2+ при аномальной активации рецепторов глутамата. В опытах на животных показано, что антагонисты рецепторов глутамата ослабляют эксайтотоксичность.
2. Молчащие синапсы. Неспособность ионного канала из-за магниевой блокады генерировать ВПСТ при отрицательных значениях мембранного потенциала свойственна только синапсам с рецепторами NMDA-типа. Так называемые «молчащие синапсы» можно «разбудить» (см. Долговременная потенциация) путем включения в мембрану рецепторов не-NMDA-типа. Определенные компоненты квантового тока зависят от присутствия рецепторов NMDA- либо не-NMDA-типа (рис. 3). Ионные токи, представленные на рисунке, зарегистрированы в среде без Mg2+'.
д) Рецепторы непрямого сопряжения с лигандом. В случае ионных каналов непрямого сопряжения с лигандом при связывании медиатора с рецептором активируются G-белки на внутренней стороне клеточной мембраны. G-белки открывают канал либо напрямую, либо при участии вторичного посредника, либо через влияние на метаболические процессы.
1. Мускариновый ацетилхолиновый рецептор. Этот рецептор взаимодействует с АцХ, который высвобождается из окончаний блуждающего нерва в миокарде. В результате открываются K+-каналы и прекращается спонтанная генерация возбуждения в синусовом узле. Рецептор называется мускариновым, поскольку здесь, так же как во многих холинергических синапсах вегетативной нервной системы, специфическим агонистом является мускарин (в отличие от никотиновых рецепторов двигательной концевой пластинки).
В экспериментах с регистрацией трансмембранных токов в изолированных клетках миокарда при аппликации АцХ выявлены К+-токи (рис. 4).
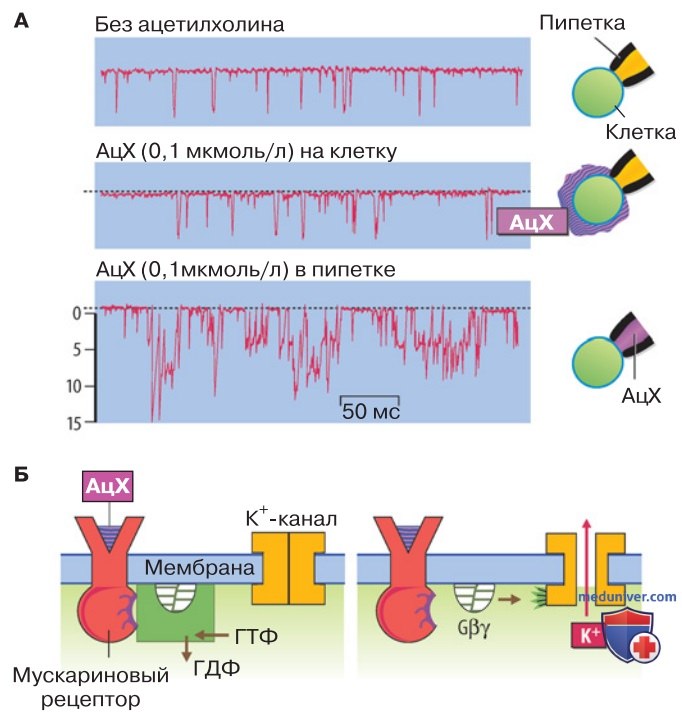
При связывании АцХ с мускариновым рецептором активируется G-белок на внутренней стороне клеточной мембраны. В результате внутриклеточный ГТФ расщепляется до ГДФ и фосфата. G-белок распадается на βγ- и α-субъединицы. βγ-Субъединица диффундирует во внутриклеточный слой мембраны и там связывается с К+-каналом. Через 30-100 мс после связывания АцХ с рецептором К+-канал открывается; задержка обусловлена диффузией βγ-субъединицы ближе к каналу.
2. Связывание при участии вторичных посредников (second messengers). К+-канал мускаринового рецептора открывается при связывании АцХ с Ру-субъединицей G-белка (рис. 4). Синаптические рецепторы, сопряженные с G-белком, могут осуществлять свои функции также при участии цитоплазматических вторичных посредников цАМФ или IP3.
Примером служит β-адренергическая передача в синапсах симпатического нерва в миокарде. При связывании медиатора норадреналина с β-адренорецептором происходит запуск сигнального каскада с образованием цАМФ. Протеинкиназа А, активированная цАМФ, фосфорилирует Са2+-каналы, повышая вероятность их открывания. В результате входа Са2+ увеличивается частота импульсов, генерируемых водителем сердечного ритма (пейсмекером) и соответственно возрастает частота сокращений сердца.
3. Ионотропное и метаботропное действие лигандов. При повышении внутриклеточной концентрации ионов Са2+ вследствие их входа из внешней среды либо поступления из саркоплазматического ретикулума возрастает сократительная сила миофибрилл. Постсинаптический эффект, опосредуемый G-белком, может быть реализован благодаря различным механизмам, таким как открывание ионных каналов или повышение сократительной силы миофибрилл. Прямое влияние на ионные каналы, вызывающее их открывание, называется ионотропным, а непрямое влияние через изменения внутриклеточных функций — метаботропным.
е) Газообразные медиаторы. Посредником между синаптическими рецепторами и каналами или другими функциональными структурами может служить оксид азота (NO).
Благодаря выделению оксида азота (NO) из клеток эндотелия осуществляется расслабление гладких мышц кровеносных сосудов. Кроме того, NO служит медиатором в межнейронных синапсах. Реакцию синтеза NO из аргинина катализирует синтаза оксида азота (NO-синтаза, NOS), ассоциированная с кальмодулином. Инициатором синтеза NO служит повышение концентрации Са2+ в клетках, например при открывании ионных каналов возбуждающих глутаматергических синапсов в ЦНС или в результате высвобождения Са2+ из внутриклеточных запасов, опосредуемого инозитолтрифосфатом (IP3).
Когда Са2+ связывается с кальмодулином, возрастает активность NOS и при взаимодействии NOS с аргинином образуется NO. Оксид азота очень быстро распространяется в клетках, а также может диффундировать через плазматическую мембрану в межклеточное пространство; среднее время полужизни NO составляет не более 5 с. В соседних клетках NO активирует гуанилатциклазу, обеспечивающую синтез медиатора цГМФ из ГТФ. В свою очередь, цГМФ регулирует открывание или закрывание ионных каналов, а также активирует цГМФ-зависимые протеинкиназы (аналогично влиянию цАМФ). Кроме того, цГМФ способствует секреции квантов медиатора из нервных окончаний.
Вызываемое NO расширение сосудов можно рассматривать в качестве физиологической основы для визуализации активных областей головного мозга с использованием метода функциональной магнитно-резонансной томографии.
ж) Коротко. Лигандуправляемые ионные каналы. Существуют различные типы трансмембранных ионных каналов, управляемых лигандами. В ионных каналах непосредственного сопряжения с лигандами связывание медиатора с постсинаптическим рецептором приводит к открыванию ионных каналов, принадлежащих этому рецептору (например, никотиновый АцХ-рецептор). В каналах непрямого сопряжения с лигандами связывание медиатора с рецептором приводит к активации G-белка.
G-белок либо связывается с молекулой канала (например, мускариновый АцХ-рецептор), либо воздействует на молекулы канала опосредованно через ферментные цепи и вторичные мессенджеры, такие как цАМФ или NO (например, адренергическая передача). Наряду с ионотропным эффектом (открывание канала) осуществляется метаботропное влияние лигандов на внутриклеточные функции через вторичные мессенджеры.
- Рекомендуем ознакомиться далее "Синаптическая пластичность - с точки зрения физиологии человека"
Редактор: Искандер Милевски. Дата публикации: 9.10.2024

