Причины и механизмы развития врожденного буллезного эпидермолиза
- Группа врожденных генодерматозов с характерным образованием пузырей в ответ на легкую травму.
- В зависимости от уровня образования пузыря выделяют простой, пограничный и дистрофический типы эпидермолиза
- Кожные проявления варьируют от единичных до распространенных пузырей.
- Степень внекожных проявлений в разных случаях различна: симптомы варьируют от полного отсутствия до тяжелого поражения; возможен летальный исход.
- В зависимости от формы заболевания поражаются ротоглотка, трахея, пищевод, глаза, зубы, ногти и волосы.
- Диагноз устанавливается методами иммунофлюоресценции и/или электронной микроскопии с последующим анализом ДНК.
Термином врожденный буллезный эпидермолиз (ВБЭ) обозначают группу заболеваний, общим признаком которых является образование пузырей в ответ на легкую травму. У пациентов с ВБЭ развиваются мелкие везикулы или крупные пузыри как на кожной поверхности, так и на тканях слизистых. Для всех разновидностей ВБЭ характерны повышенная уязвимость кожи и слизистых оболочек и возникновение болезненных пузырей вследствие травмы. Распределение высыпаний, глубина образования пузырей и тяжесть патологического процесса при разных формах ВБЭ различны и зависят от наследственного молекулярного дефекта. Вариабельной также является и картина заживления на участках поражения.
Нередко при врожденном буллезном эпидермолизе (ВБЭ) наблюдается аномальное заживление раны, что может приводить к хроническим эрозиям, развитию гипертрофической грануляционной ткани, рубцеванию и даже инвазивной карциноме. При более легких формах ВБЭ поражение внутренних органов носит ограниченный характер или полностью отсутствует, а продолжительность жизни не отличается от среднего показателя. Наиболее тяжелые разновидности заболевания имеют рецессивный тип наследования и представляют собой деформирующие поражения нескольких органов, влияющие и на качество жизни, и на ее продолжительность.
В ряде первоначальных исследований были идентифицированы основные формы буллезного эпидермолиза. В исследованиях Hebra было впервые проведено различие между пузырчаткой и наследственным образованием пузырей, а термин наследственный буллезный эпидермолиз был впервые предложен Koebner. Hallopeau первым дифференцировал простую (без рубцевания) и дистрофическую (с рубцеванием) формы заболевания, a Weber и Cockayne, Dowling и Meara и Koebner описали соответственно уникальные формы простого буллезного эпидермолиза. Hoffman, Cockayne, Тоuraine, Pasini and Bart предоставили много данных о типах дистрофического буллезного эпидермолиза. Герлитц описал летальный буллезный эпидермолиз, который впоследствии был определен как часть третьей основной категории буллезного эпидермолиза — пограничной формы буллезного эпидермолиза (БЭ).
Применение электронной микроскопии для диагностики буллезного эпидермолиза в исследованиях Pearson и сотрудников привело к классификации пациентов не только на основании клинических признаков, но и с учетом наличия ультраструктурных изменений. Полная классификация буллезного эпидермолиза, исходя из комбинации ультраструктурных и клинических признаков, была завершена в работе Gedde-Dahl. Последние важные достижения в этой области привели к идентификации у пациентов белковых и генетических аномалий при большинстве форм буллезного эпидермолиза. Эти исследования углубили понимание биологических основ буллезного эпидермолиза, исходя из генетических/белковых дефектов, что обеспечивает рациональный подход к специфической молекулярной терапии.
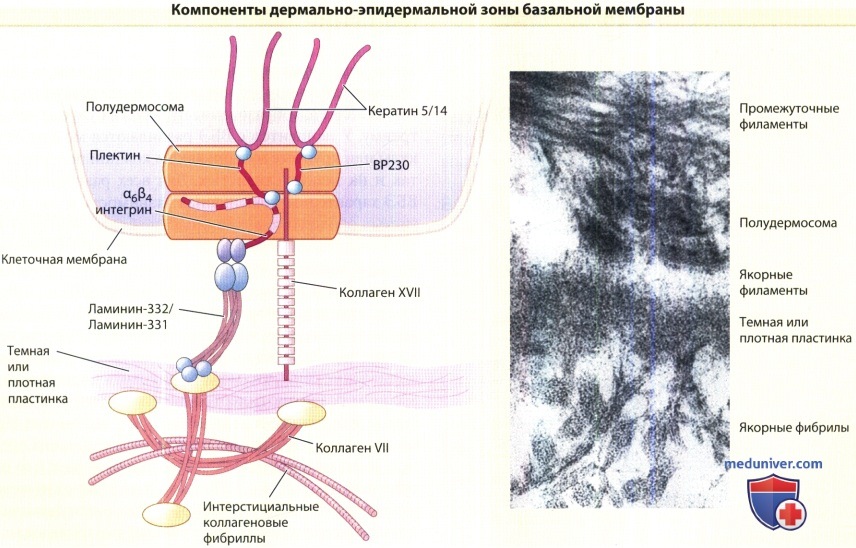
и ультраструктурная картина морфологических единиц базальной мембраны (справа).
Этиология и патогенез. Врожденный буллезный эпидермолиз (ВБЭ) развивается вследствие нарушения соединения базальных кератиноцитов с расположенной под ними дермой. Подобные дефекты могут возникать как внутри кератиноцитов (в пределах, ограниченных плазмалеммой), так и во внеклеточной дермально-эпидермальной зоне базальной мембраны (ЭВМ). Многие ткани (например, кожа и роговица), будучи уязвимыми для внешних воздействий, имеют сложноорганизованную ЭВМ, состоящую из группы специализированных компонентов, сочетание которых образует якорные комплексы. В верхней части ЗБМ промежуточные кератиновые филаменты цитоскелета базальной клетки входят в электронно-плотные скопления в составе плазмалеммы, которые называются полудесмосомами. Якорные филаменты охватывют светлую пластинку (lamina lucida), соединяя полудесмосомы с темной (плотной) пластинкой (lamina densa) и фибриллами.
В нижнем участке ЗБМ, содержащем коллаген типа VII, находятся якорные фибриллы, которые тянутся от плотной пластинки в сосочковый слой дермы, соединяя плотную пластинку с якорными пластинками и захватывая интерстициальные коллагеновые фибриллы. Таким образом, ЗБМ соединяет обширную сеть цитоскелета базальной клетки с сетью интерстициальных коллагеновых фибрилл в дерме.
1. Кератиновые филаменты. Кератины представляют собой облигатные гетерополимеры, которые состоят из пар кислых и основных мономеров. Пара кератинов 5 и 14 собирается, образуя обширную сеть промежуточных филаментов цитоскелета базальных клеток. Кератины содержат центральный а-спиральный палочковидный домен с несколькими неспиральными перерывами, а также неспиральные карбоксильные и амино-терминальные участки. Области максимальной консервации между кератинами расположены на концах палочковидного домена кератина в пограничных мотивах спирали. Многочисленные исследования мутагенеза указывают на важную роль спиральных участков у концов центрального палочковидного домена для удлинения кератиновых филаментов, в то время как неспиральные домены, возможно, важны при формировании боковых связей.
2. Полудесмосомы. Полудесмосомы содержат внутриклеточные белки, в том числе плектин и ВР230. Плектин представляет собой белок с молекулярным весом 500 кДА, который связывает промежуточные филаменты. Возможно, что плектин взаимодействует также с микрофиламентами, поскольку плектин содержит домен, сходный со связывающим актин доменом спектрина. ВР230, известный также как BPAG1, представляет собой белок с молекулярным весом 230 кДа, гомологичный и десмоплакину, и плектину. Некоторые сплайсинговые варианты ВР230 жизненно важны для нервной системы. ВР230 локализуется в участке, известном как внутренняя пластинка цитоплазматической поверхности полудесмосомы, и, подобно плектину, функционирует в соединении между полудесмосомами и промежуточными филаментами. У трансгенных мышей, нокаутных по ВР230, отсутствует внутренняя пластинка полудесмосом, и соединение между полудесмсомами и промежуточными филаментами нарушено, что создает механически хрупкую цитоплазматическую зону сразу над полудесмосомами.
3. Якорные филаменты. Полудесмосомы содержат также трансмембранные белки коллаген XVII (обозначаемый также как BPAG2 и ВР180) и α6β4-интегрин. Цитоплазматические участки этих молекул составляют часть плотной пластинки полудесмосомы. Внеклеточные участки этих молекул являются частью якорного филамента и, вероятно, участвуют в структуре, известной как супрабазальная плотная пластинка, которая расположена под полудесмосомами в области светлой пластинки. β4-интегрин составляет пару только с субъединицей α6, в то время как субъединица α6 может соединяться либо с интегрином β4, либо с интегрином β1. Обе интегриновые комбинации, α6β1 или α6β4, действуют как рецепторы ламинина 332, но как специфический рецептор ламинина 332 функционирует только интегрин α6β4. Интегрин α6β4 играет центральную роль в организации полудесмомомы. Интегрин β4 содержит особенно крупный цитоплазматический домен, который функционирует во взаимодействии с другими белками полудесмосомальной пластинки, в том числе коллагеном XVII и плектином.
В коже трансгенных мышей, лишенных интегрина β4, отсутствуют полудесмосомы, и наблюдается тяжелый дефицит клеточной адгезии. Взаимодействия между плектином и интегрином α6β4 играют решающую роль как в сборке, так и в разборке полудесмосом. Коллаген XVII (BPAG2, ВР180) представляет собой коллагеновый белок с трансмембранной ориентацией типа II. Электронная микроскопия и исследования поперечных связей показывают, что коллаген собирается в тройной спиральный гомотример и содержит три основных участка: (1) внутриклеточную амино-терминальную глобулярную головку, (2) центральный палочковидный домен, и (3) гибкий внеклеточный хвост. Коллаген XVII соединяется с ламинином-332 и интегрином α6β4 в адгезионных структурах, обозначаемых как стабильные якорные контакты. Эти стабильные якорные контакты образованы кератиноцитами in vivo и, вероятно, являются предшественниками полудесмосом. Аутоантиген линейного, IgA-зависимого буллезного дерматоза, LAD-134, представляет собой белок с молекулярным весом 120 кДа, который, как было показано секвенированием пептидов, является расщепленным экзодоменом коллагена XVII. Коллаген XVII подвергается процессингу в культурах кератиноцитов и в коже под действием шеддаз, мембранных протеаз, которые растворяют рецепторы клеточной поверхности.
Кроме интегрина α6β4 и коллагена XVII, якорные филаменты содержат молекулы ламинина-332 и ламинина-311. Как и все члены семейства белков-ламининов, ламинин-332 представляет собой крупную гетерогенную молекулу и содержит цепи α3, β3 и γ2. Первые описанные ламинины содержали три коротких плеча и одно длинное плечо, образуя крестообразную форму, что было показано методом теневой электронной микроскопии,. В отличие от этого, ламинин-332 содержит усечения каждого короткого плеча. По причине этих коротких плечевых усечений ламинин-332 не может самостоятельно полимеризоваться с другими ламининами или связаться с нидогеном. Вместо этого ламинин-332 присоединяется дисульфидной связью к ламинину-311, другому известному ламинину якорных филаментов, который содержит цепи α3, β1 и γ1. Цепи γ2 и α3 ламинина-332 также подвергаются процессингу. Хотя ранее было показано, что цепь у2 ламинина крысы расщепляется металлопротеиназой-2 и мембранной металлопротеиназой типа 1, преобладающий участок расщепления этими ферментами не законсервирован в человеческом ламинине-332. Другие исследования показали, что процессинг цепи у2 ламинина происходит посредством особого класса белков, называемых С-протеиназами, которые расщепляют также С-терминальные домены молекул проколлагена.
Поскольку один из членов этого класса белков, костный морфогенный белок 1, способен выполнять это действие, значит сплайсинговый вариант костного морфогенного белка 1 (толлоид млекопитающих), экспрессированный преимущественно в кератиноцитах и фибробластах, может выполнить эту же функцию в коже. Толлоид млекопитающих также воздействует на α3- цепь ламинина, хотя выполнять эту функцию способны другие ферменты, такие как плазмин, матричная металлопротеиназа-2 или мембранная матричная металлопротеиназа-1. Короткое плечо цепи γ2 играет важную роль для соединения ламинина-332 с базальной мембраной. Антиген, распознаваемый структурой mAb 19-DEJ-158, также локализуется в якорных филаментах, но его молекулярная идентичность остается неизвестной.
4. Якорные фибриллы. Коллаген VII является основным компонентом якорных фибрилл. Анализ расшифрованной аминокислотной последовательности коллагена VII выявляет присутствие длинного центрального коллагенового участка с характерными повторяющимися последовательностями Gly-X-Y, который содержит ряд неколлагеновых перерывов, в том числе аминокислотный неколлагеновый сегмент 39 в центре спирали, который соответствует «шарнирному участку», предсказанному биохимическими исследованиями. Этими перерывами объясняется гибкость молекулы коллагена VII и ее способность образовывать петлю и улавливать молекулы дермального матрикса, стабилизируя таким образом базальную мембрану относительно подлежащего сосочкового слоя дермы. Был также идентифицирован компонент якорных фибрилл с молекулярным весом 50 кДА, который локализован в участках вхождения якорных фибрилл в плотную пластинку.
N-терминальный конец коллагена VII с молекулярным весом 145 кДа содержит самый крупный неколлагеновый домен, который входит в плотную пластинку и якорные пластинки. Коллаген IV, самый обильный компонент этих структур, связывается с доменом NC-1 коллагена VII. Прямое взаимодействие между якорными филаментами и якорными фибриллами осуществляется в результате специфического взаимодействия между компонентом якорных филаментов ламинином-332 и доменом NC-1 коллагена VII. Коллаген VII связывается с цепью β3 на ламинине-332. Это является решающим фактором в поддержании дермо-эпидермальной когезии. Подобно всем коллагенам, коллаген VII собирается в тройную спираль. Идентифицированы только один ген и одна а 1 -цепь коллагена VII, следовательно, коллаген VII является гомотримером. Тройные спирали коллагена VII соединяются вместе у своих подвергшихся процессингу глобулярных доменов NC-2, образуя антипараллельные димеры. Процессинг доменов NC-2 происходит посредством того же семейства С-протеина (костный морфогенный белок-1 и/или толлоид млекопитающих), которые расщепляют ламинин-332, близкородственную молекулу. Якорные фибриллы могут происходить из боковых связей антипараллельных димеров коллагена VII.
- Рекомендуем далее ознакомиться со статьей "Классификация врожденного буллезного эпидермолиза"
Оглавление темы "Врожденный буллезный эпидермолиз (ВБЭ).":- Причины и механизмы развития врожденного буллезного эпидермолиза
- Классификация врожденного буллезного эпидермолиза
- Варианты и клиника простого буллезного эпидермолиза (ПБЭ)
- Варианты и клиника пограничного буллезного эпидермолиза (ПгБЭ)
- Варианты и клиника дистрофического буллезного эпидермолиза
- Симптомы и клиника Киндлер-синдрома
- Алгоритм диагностики врожденого буллезного эпидермолиза (ВБЭ)
- Современное лечение врожденого буллезного эпидермолиза (ВБЭ)

