Состав базальной мембраны и ее биохимия
В состав базальной мембраны входят коллагенозные и неколлагенозные гликопротеины и протеогликаны. Содержание коллаген-специфических аминокислот (гидроксипролина и гидроксилизина) указывает на то, что на коллаген приходится от 40% до 65% белков базальной мембраны. Количественное содержание гидроксипролина в базальной мембране указывает на то, что коллаген составляет 40-65% от общего объема ее белка.
Все базальные мембраны, независимо от типа ткани, содержат коллаген IV в качестве основного коллагена, ламинин, нидоген и гепарансульфат протеогликана перликан. Кроме того, в базальных мембранах имеется множество других гликопротеинов, специфических для конкретных тканей, в том числе различные ламинины, фибулины и фибронектин.
Различия в макромолекулярном составе влияют на морфологическую и функциональную вариабельность базальных мембран.
Компоненты присутствующие во всех базальных мембранах:
- Коллаген IV
- Ламинины
- Нидогены
- Перлекан
а) Коллаген IV базальной мембраны. Коллаген IV представляет собой ге-теротример, состоящий из трех α-цепей. Каждая из них содержит три различных домена: (1) N-концевой богатый цистеином (7-S) домен, (2) центральный трехспиральный домен и (3) С-концевой глобулярный домен (NC-1). Состав тримера определяется доменами NC-1, посредством которых a-цепи сцеплены друг с другом ковалентными связями. Тройная спираль коллагена IV длинная и содержит несколько разрывов, что приводит к повышению гибкости в спирали коллагена IV, но также делает ее восприимчивой к действию протеаз.
Супраструктура коллагена IV была определена с помощью теневой электронной микроскопии, которая показала, что основные связи между молекулами коллагена IV осуществляются за счет аминовых и карбоксильных концевых доменов, а также посредством латерального соединения их тройных спиралей. Ковалентные связи между 7-S-регионами различных молекул являются основой для специфической сетчатой структуры, присущей базальным мембранам. Индивидуальные регионы 7-S перекрывают друг друга в параллельном и встречно-параллельном направлениях, создавая характерную форму «паука с четырьмя ножками».
Домены NC-1 на конце каждой ножки «паука» взаимодействуют с доменами NC-1 соседних агрегатов. Это соединение стабилизируется ковалентными связями. Подобные межконцевые взаимодействия приводят к образованию обширной двухмерной сетки, которая является структурной основой базальной мембраны.
Высокая гибкость сетчатой структуры базальной мембраны значительно увеличивает возможность взаимодействия с другими коллагенами или неколлагенозными молекулами. Например, сплетения коллагена IV с ламининами или перлеканом легко визуализируются. Подразумеваемая ячеистость такой структуры должна ограничиваться размером ячеек коллагеновой сети и связанными с ней структурными элементами. В подобной модели структура базальной мембраны обеспечивает значительную механическую устойчивость, сохраняя при этом физиологическую гибкость. Данное сочетание прочности и эластичности необходимо для такой динамичной поверхности, каковой являются эпидермально-дермальное соединение и окружающие его кровеносные сосуды.
Молекулы коллагена IV в различных базальных мембранах содержат генетически различные, но структурно гомологичные a-цепи. Цепи α1 и α2 встречаются повсеместно. Распределение цепей α3, α4, α5 и α6 зависит от типа ткани. Структурная организация цепей и избирательные взаимодействия между доменами NC-1 определяют сетчатое строение базальных мембран. Шесть цепей коллагена IV распределены по трем основным сетям: (1) α1-α2, (2) α3-α4-α5, и (3) α1-α2-α5-α6, состав которых определяется доменами NC-1.
Две сети, одна из которых содержит α1 и α2, а другая — α3, α4 и α5, находятся в базальных мембранах гломерул. Базальные мембраны гладких мышц, наряду с типовой сетью, содержащей α1 и α2, также имеют сеть, включающую в себя α1, α2, α5 и α6. В дермо-эпидермальном соединении доминирует сеть коллагена IV, содержащая цепь α1-α2, но вероятно присутствует также сеть α1-α2-α5-α6.
Мутации в генах, кодирующих цепи α1 и α2, вызывают нарушения в различных органах, начиная от патологии сосудов мелкого калибра, которая часто является причиной ишемических инсультов и внутримозговых кровоизлияний до поражения глаз и HANAC-синдрома (hereditary angiopathy with nephropathy, aneurysms, and muscle cramps) в составе наследственной ангиопатии с невропатией, аневризмами и мышечными спазмами. Интересно отметить, что, несмотря на повсеместное присутствие цепей α1 и α2 коллагена IV в базальных мембранах, во всех базальных мембранах отклонений не наблюдается, что указывает на вариабельность и тканевую специфичность ролей коллагена IV.
Структурные аномалии в генах, кодирующих цепи α3, α4, α5 и α6, вызывают различные формы синдрома Олпорта, генетического заболевания, для которого характерны нефрит и глухота. Цепь α3 (IV) является антигеном, который распознается циркулирующими аутоантителами при синдроме Гудпасчера.
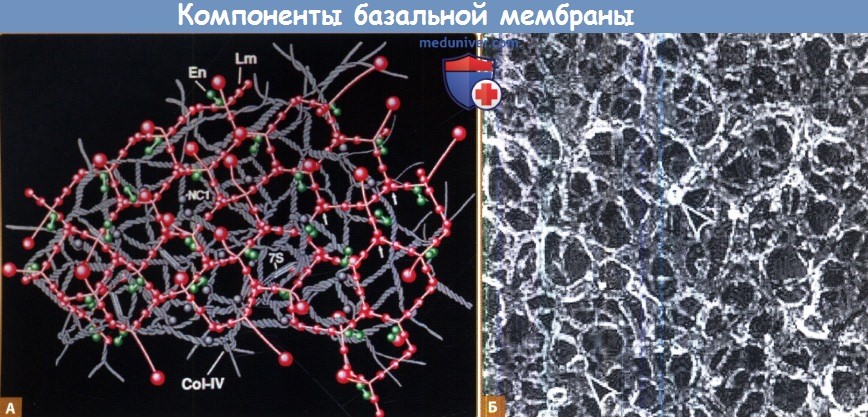
Мономерный коллаген IV (CollV) осуществляет самосборку в димеры и тетрамеры, которые затем образуют сложное сплетение.
Ламинины самополимеризуются в сети. Перлекан подвергается олигомеризации in vitro, а боковые цепи гликозаминогликана взаимодействуют со структурой коллагена IV.
Нидоген-энтактин связывает компоненты всех трех сетей, а также фибулины. В связи с этим нидоген играет центральную роль, являясь стабилизатором структуры темной пластинки (lamina densa).
В изображении отдельных молекул масштаб не соблюден.
Б. Теневая микроскопия реплики полимеров коллагена IV, полученной методом быстрой заморозки и глубокой фиксации.
Реплика демонстрирует обширную разветвляющуюся и анастомозирующую сеть с отдельными глобулярными структурами (стрелки), которая представляет собой наглядную модель строения темной пластинки (lamina densa).
б) Ламинины базальной мембраны. Ламинины являются очень большими по молекулярной массе гликопротеинами (600-950 кд), находящимися в составе светлой/темной пластинок (lamina lucida/lamina densa) всех базальных мембран. Три структурных элемента ламининов были обозначены как α, β и γ цепи — любой ламинин представляет собой трехмерный агрегат, состоящий из α-, β- и γ-цепей. Каждый тример имеет полужесткую протяженную структуру, которая при теневой микроскопии предстает в виде асимметричного креста. Размер длинного плеча креста — около 125 нм; длина коротких плеч вариабельная. В каждой молекуле ламинина выделяются глобулярные и палочковидные домены, которые выполняют различные функции.
К подобным функциям относятся агрегация с такими же доменами молекул ламинина и с другими компонентами темной пластинки, адгезия и экспансия клеток, рост нейритов или клеточная дифференцировка. С-концевой Ig-домен a-цепи у основания длинного плеча ламининового креста содержит участок связывания интегринов.
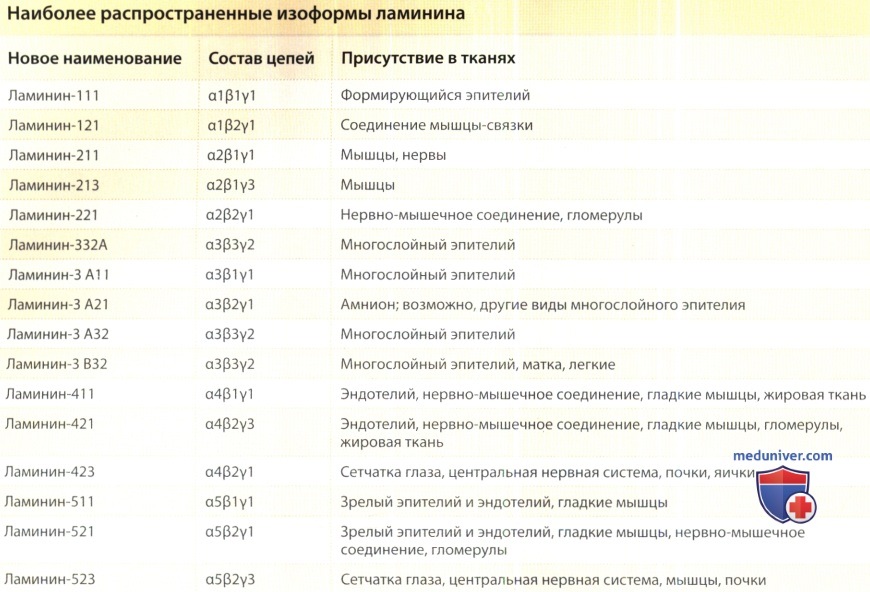
К настоящему времени идентифицированы 15 изоформ ламинина. Они представляют собой различные тримерные комбинации из пяти известных α-цепей, трех β-цепей и трех γ-цепей. Первоначально изоформы ламинина имели порядковую нумерацию (от ламинин-1 до ламинин-15), соответствующую последовательности их открытия; однако такая терминология на практике оказалась неудобной из-за необходимости помнить соответствие между номерами изоформ и их структурой. Новая упрощенная номенклатура основана на последовательном перечислении номеров α-, β- и γ-цепей, составляющих конкретную изоформу. Например, исходный «прототип» ламини-1, имеющий в составе цепи α1, β1 и γ1 (α1β1γ1) в новой номенклатуре обозначен как ламинин-111.
Основной ламинин базальной мембраны эпидермиса (ранее ламинин-5), содержащий цепи α3β3γ2, переименован в ламинин-332.
Ламинины, содержащие цепь α2, представлены преимущественно в базальных мембранах мышечных волокон, нервов, нервно-мышечного соединения и гломерул. Цепь α3 участвует в эпителиальной адгезии, а цепи α4 и α5 обнаруживаются в различных тканях, включая эндотелий, эпителий, нервно-мышечное соединение и гломерулы. Ламинин-511 присутствует в базальной мембране эпидермиса и волосяных фолликулов, где, как представляется, он участвует в эволюционной сигнализации. Цепи β2 в основном находятся в нервно-мышечном соединении, однако также они встречаются и в немышечных тканях, например, в почечных клубочках и базальной пластинке капилляров. Цепь β3 задействована в эпителиальной адгезии. Идентифицированы три варианта γ-цепи: γ1, γ2 и γ3.
Из них в коже встречается только цепь γ2 в составе ламинина-332. Цепь γ3 — компонент ламининов-423 и 523 — связывает нидогены 1 и 2 и локализована в зонах базальных мембран взрослой и эмбриональной ткани мозга, почек, кожи, мышц и яичек. По сравнению с yl, концентрации цепи γ3 гораздо ниже, что, возможно, свидетельствует о том, что ее функции являются высокоспецифичными. Функции ламининов на данный момент в полной мере не изучены, однако очевидно, что, взаимодействуя с интегринами и другими компонентами клеточной поверхности в различных органах, ламинины контролируют такие виды клеточной деятельности, как адгезия, миграция, пролиферация и полярность.
Некоторые врожденные заболевания человека вызваны мутациями в цепях ламинина. Поскольку некоторые цепи могут быть компонентами нескольких различных ламининов, их мутации могут влиять на функции многих ламининов в различных тканях. Например, мутации в цепи α2 вызывают врожденную мышечную дистрофию и значительное уменьшение в объеме базальной мембраны вокруг мышечных клеток. Отсутствие базальной мембраны приводит к прогрессирующей дегенерации мышцы вследствие клеточной гибели. Следовательно, можно предположить, что ламинины, и базальные мембраны в целом, необходимы для предупреждения апоптоза в окружаемых ими типах клеток. Мутации в цепях α3, β3 или γ2 обнаружены при пограничном буллезном эпидермолизе, а мутации в α4-цепи ассоциируются с кардиомиопатией. Синдром Пирсона, тяжелое врожденное заболевание, поражающее главным образом почки и глаза, вызывается мутацией в β2-цепи.
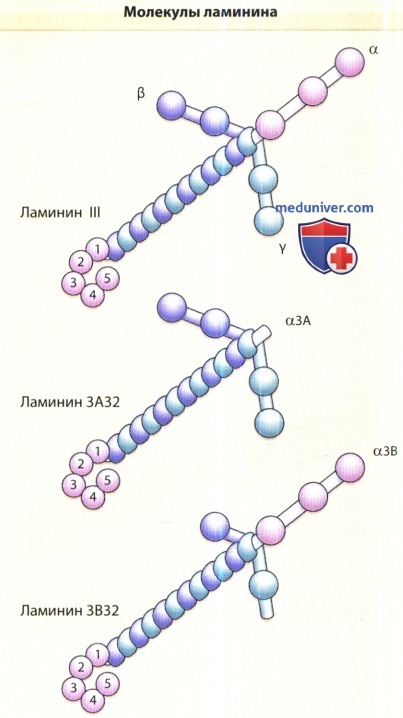
Каждый ламинин представляет собой гетеротример с одной α, одной β и одной γ цепью.
Слева представлен классический прототип ламинин-111, состоящий из цепей α1, β1, γ1.
Короткое плечо N-конца каждой цепи свободно, длинное плечо образовано С-концами, закрученными в винтовую спираль.
Дистальный С-конец a-цепи имеет пять глобулярных LG-доменов, в которых находится участок связывания интегринов.
Ламинин-332, ранее известный как ламинин-5, существует в двух формах — 3A32 и 3В32.
Они представляют собой сплайсинговые варианты a-цепи: 3А—более короткий вариант, 3В — вариант полной длины.
N-конец цепей β3 и γ2 подвергается протеолизу и синтезирует зрелый ламинин-332.
в) Нидогены базальной мембраны. Оба нидогена— 1 и 2, также известные какэнтактин 1 и 2,— являются характерными генными продуктами. Они представляют собой сравнительно небольшие молекулы, связывающие ламинины на определенных участках цепей у 1 и γ3,98,102 коллаген IV, перлекан и фибулины.
Нидогены действуют, вероятно, как соединяющие элементы между сетями коллагена IV и ламинина и интегрируют другие компоненты базальной мембраны в этот специалицированный внеклеточный матрикс.
Целенаправленное удаление нидогенов у мышей показало, что утрата какой-либо одной изоформы не влияла на образование базальной мембраны и развитие органов, однако одновременное отсутствие обоих нидогенов приводило к серьезным, несовместимым с жизнью дефектам легких и сердца. Примечательно, что, несмотря на присутствие нидогенов во всех базальных мембранах, лишь в некоторых из них встречаются аномалии, связанные с данными молекулами, что свидетельствует о различной роли нидогенов в разных типах базальных мембран.
г) Гепарансульфатные протеогликаны базальной мембраны. Протеогликаны представляют собой еще один класс интегральных компонентов, присутствующих в базальных мембранах всех разновидностей. В базальных мембранах эпителия и сосудов, как правило, встречаются три протеогликана: (1) перлекан, (2) агрин и (3) бамакан. Они состоят из стержневого белка различной длины и боковых цепей (гепарансульфат у перлекана и агрина и хондроитинсульфат у бамакана). Название перлекан связано с тем, что при теневой микроскопии данный протеогликан предстается похожим на нитку жемчуга (от англ. Pearl — жемчужина). Перлекан является комплексным мультидоменным протеогликаном чрезвычайно крупных размеров с наличием нескольких посттрансляционных модификаций. У мышей, лишенных перлекана, развивались патологические изменения во многих тканях, включая базальные мембраны, а также наблюдалась гибель эмбрионов.
Нарушения базальных мембран возникали на участках сильного механического напряжения, таких как миокард или кожа, что приводило к летальным аномалиям сердца и образованию пузырей. Аргин представляет собой основной гепарансульфатный протеогликан нервно-мышечного соединения базальных мембран почечных канальцев. Коллаген XVIII в различных органых считается гибридным коллагеном-протеогликаном. У мышей, нокаутных по коллагену XVIII, расширены базальные мембраны в различных органах в сочетании с мезангиальной экспансией и сниженной функцией почек. Протеогликаны способны к взаимодействию с некоторыми другими компонентами базальной мембраны, они играют определенную роль в поддержании ее целостной структуры, а также выполняют тканеспецифические функции. Высокая концентрация сульфата в протеогликанах обусловливает их сильный отрицательный заряд и гидрофильность, причем плотность заряда отвечает за обеспечение селективной проницаемости базальных мембран гломерул.
Синдеканы — это трансмембранные гепарансуль-фатные протеогликаны, присутствующие на поверхности большинства клеток, включая базальные кератино-циты эпидермиса. Их внеклеточные домены обладают аффинностью к ламининам и, вероятно, посредством таких взаимодействий регулируют различные биологические процессы—от сигнализации фактора роста, клеточной адгезии и организации цитоскелета до инфицирования клетки микроорганизмами.
д) Фибулины базальной мембраны. Фибулины представляют собой семейство высококонсервативных кальцийсвязывающих внеклеточных матричных протеинов. Они присутствуют в стенках сосудов, базальных мембранах и микротубулах и имеют перекрывающиеся участки связывания для различных лигандов — как белков базальных мембран, так и компонентов интерстициальных соединительных тканей. в связи с этим исследователи полагают, что фибулины функционируют как межмолекулярные мостики, которые стабилизируют супрамолекулярную организацию таких структур внеклеточных мембран, как эластичные волокна и базальные мембраны. Дефекты в генах, кодирующих фибулин-4 и -5, вызывают различные формы вялой кожи (cutis laxa).
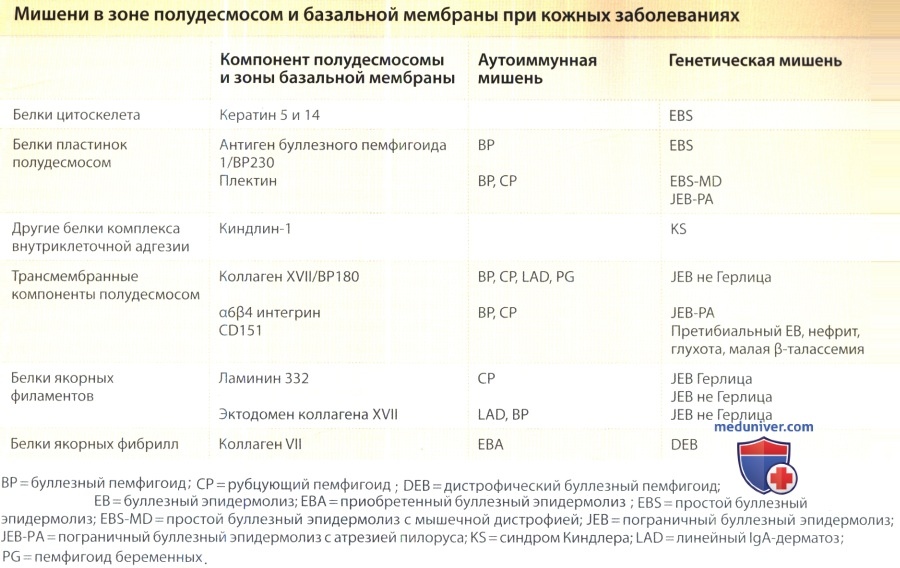
е) Специфичные для эпителия компоненты базальной мембраны. Дермо-эпидермальное соединение кожи является наглядным примером специфической дивергенции в структуре базальной мембраны. На сегодняшний день достаточно хорошо изучены структурные компоненты полудесмосом, якорных филаментов и якорных фибрилл в зоне базальной мембран. Локализация белков в дермо-эпидермальном соединении представлена на рисунке ниже. Указанные белки перечислены в таблице ниже; подробнее речь о них пойдет в отдельных статьях на сайте.
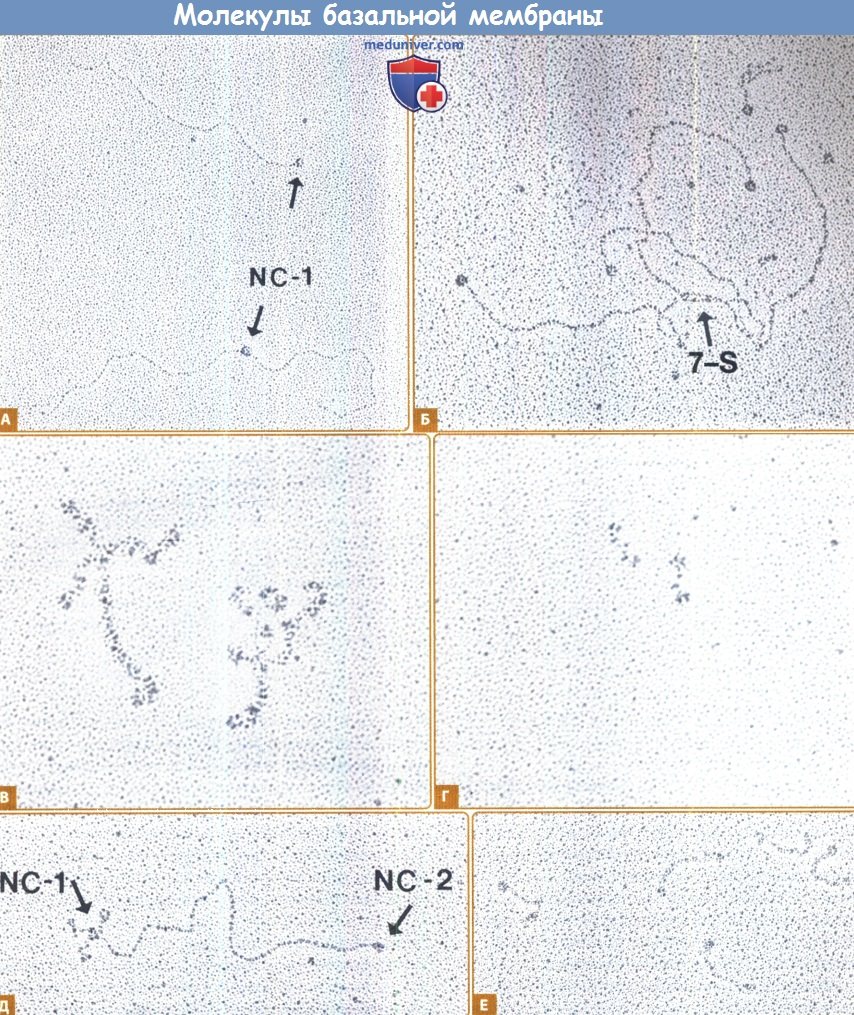
А. Мономер коллагена IV и димер, возникший в результате агрегации С-концевых доменов NC-1.
Б. Тетрамер коллагена IV («паук»), содержащий домен 7-S с четырьмя выступающими молекулами и их крупными концевыми доменами NC-1. В. Молекулы ламинина-1 (ламинин-111).
Г. Молекулы нидогена.
Д. Проколлаген VII. Стрелками указаны участки NC-1 и NC-2. Е. Молекулы ламинина-5 (ламинин-332).
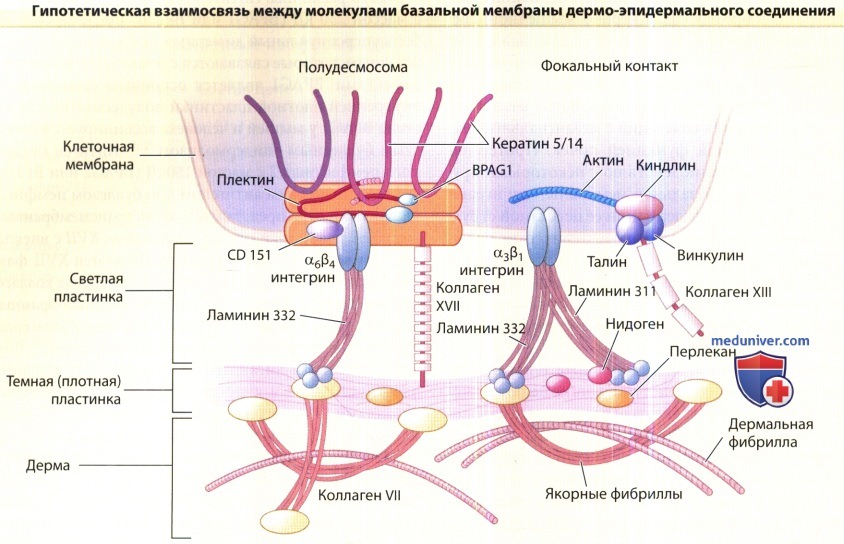
На рисунке ламинин-332 представлен в виде мостика между трансмембранным интегрином полудесмосомы α6β4 и доменом NC-1 коллагена VII.
Сильная связь ламинина-332 с а6β4 и с коллагеном VII обеспечивает первичную устойчивость к воздействию сил трения.
Ее также поддерживает трансмембранный коллаген XVII, так как и его внеклеточный домен связывает ламинин-332.
В эпителиальной клетке трансмембранные элементы связывают белки плотной пластинки полудесмосом, антиген буллезного пемфигоида (BPAG) 1 и плектин, которые затем соединяются с кератинами.
Коллаген VII связывает BPAG1, интегрин α6β4 и плектин, а интегрин α6β4 вступает в связь с плектином.
Комплекс ламининов 5-6 изображен в базальной мембране между полудесмосомами, он связан интегрином α3β1 и соединен с внутриклеточными белками киндлином, талином и винкулином.
По всей вероятности, данный комплекс поддерживает устойчивость базальной мембраны.
In vitro интегрин α3β1, киндлин, талин, винкулин, а также другой трансмембранный коллаген типа XIII расположены в фокальных контактах, которые могут служить связующим звеном между базальной мембраной и сетью кортикального актина эпителия.
В темной пластинке (lamina densa) сети коллагена IV и перлекана стабилизируются нидогеном. Якорные фибриллы прикрепляются к темной пластинке посредством домена NC-1 коллагена VII.
Фибриллы проникают в дерму и либо оканчиваются в якорной пластинке, либо, образуя петлю, возвращаются назад в темную пластинку.
Сеть якорных фибрилл захватывает дермальные фибриллы, обеспечивая адгезию темной пластинки (lamina densa) к сосочковому слою дермы. В изображении молекул масштаб не соблюден.
- Рекомендуем далее ознакомиться со статьей "Строение полудесмосом базальной мембраны и их функции"
Оглавление темы "Базальная мембрана.":- Эпидермальная адгезия и строение десмосом
- Строение белков десмосом и их функции
- Строение базальной мембраны и ее функции
- Строение дермо-эпидермального соединения кожи
- Состав базальной мембраны и ее биохимия
- Строение полудесмосом базальной мембраны и их функции
- Строение якорных филаментов и их функции
- Строение плотной пластины эпителия (lamina densa) и ее функции
- Строение якорных фибрилл и их функции
- Клетки участвующие в образовании базальной мембраны

