Строение белков десмосом и их функции
Присоединяя клеточную поверхность к сети промежуточных филаментов, десмосомы создают трехмерную конструкцию из белков, которая тянется от поверхности клетки вплоть до ядерной оболочки. Эта конструкция является ключевым фактором стабилизации эпителия в случае касательного напряжения или внешней травмы. В первоначальных морфологических исследованиях десмосома представлялась статичной структурой, «точечной сваркой», функционирующей только для сохранения межклеточной адгезии. В последние три десятилетия были биохимически изучены и клонированы индивидуальные десмосомальные белки, что позволило выяснить как динамическую природу структуры десмосом, так и разнообразие функций десмосомальных белков.
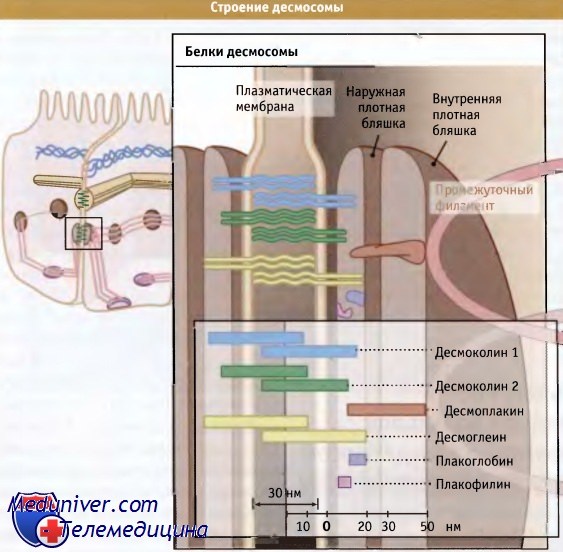
Десмосомальные белки подразделяются на три основных категории: (1) десмосомальные кадгерины (десмоглеины и десмоколлины), (2) белки семейства armadillo (плакоглобин и плакофиллины) и (3) плакины (десмоплакин, энвоплакин и периплакин). Дополнительные белки, такие как Регр, нинеин, казрин и корнеодесмозин также локализованы в десмосомах эпидермиса. Электронная микроскопия с применением иммунологического метода окрашивания золотом еще более углубила понимание того, как эти молекулярные компоненты расположены в десмосоме на ультраструктурном уровне. Десмосомальные кадгерины представляют собой трансмембранные белки, внеклеточные амино-терминальные домены которых, взаимодействуя, образуют транс-адгезивный интерфейс между клетками, которые представлены электронно-плотной средней линией десмоглеи.
Внутри клетки, примерно в 10-20 нм от плазмолеммы, внешняя плотная пластинка содержит цитоплазматические «хвосты» десмосомального кадгерина: плакоглобин, амино-терминальный домен десмоплакина, и плакофиллин. Примерно в 40-50 нм от плазмолеммы карбоксильный конец десмоплакина взаимодействует с промежуточными филаментами кератина, образуя внутреннюю плотную пластинку.
Биохимические характеристики, тип экспрессии и патологии, связанные с каждым из компонентов десмосомы подробно обсуждаются ниже. Хотя специфические физиологические роли и патофизиологические механизмы, влияющие на многие десмосомальные белки, продолжают активно изучаться, полученные к настоящему моменту данные четко указывают на важность десмомом и их компонентов не только для клеточной адгезии.
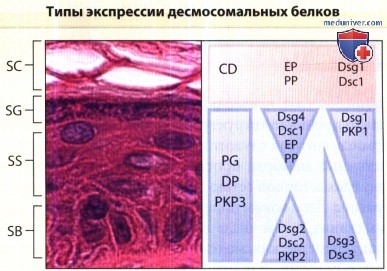
SC = роговой слой, SG = зернистый слой, SS = шиповатый слой, SB = базальный слой.
а) Десмосомальные кадгерины. Десмоглеины и десмоколлины являются частью кадгеринового суперсемейства трансмембранных гликопротеинов. Члены этого суперсемейства, к которым относится белок адгезионных контактов Е-кадгерин, опосредуют кальций-зависимую адгезию в ряде эпителиальных тканей. У человека имеется четыре изоформы десмоглеина (Dsg) и три изоформы десмоколлина (Dsc), каждая из них имеет различный тип экспрессии в пределах одного эпителия и в разных видах эпителиальных тканей. В нормальном эпидермисе человека Dsg1, Dsg4, и Dsc1 экспрессированы преимущественно в дифференцированных клетках поверхностного эпидермиса, в то время как Dsg2, Dsg3, Dsc2 и Dsc3 сильнее экспрессированы в базальном и/или супрабазальном слоях. Экспрессия Dsgl и Dsg3 в различных эпителиальных тканях в основном ограничена многослойным плоскоклеточным эпителием кожи и ротоглотки, а также эпителиальными клетками тимуса.
Dsg3 также сильно выражен в плоскоклеточных карциномах и других видах рака в области головы и шеи, где он предлагается в качестве потенциальной молекулярной мишени для терапии. Dsg2 является основной изоформой десмоглеина в большинстве видов простого и переходного эпителия, а также в миоцитах сердечной мышцы. Dsg4 выражен в десмосомах волосяных фолликулов, яичках и простате. Тип экспрессии десмоколлинов человека изучен меньше.
В нормальных тканях экспрессия Dsc1 ограничена, в основном, кожей и эпителием полости рта, в то время как Dsc2 шире экспрессирован в большинстве содержащих десмосомы видов эпителия и является единственной изоформой десмоколлина в ткани сердечной мышцы. Dsc3, подобно Dsg3, наиболее сильно выражен в многослойном плоскоклеточном эпителии кожи и ротоглотки, хотя в базе данных «UniGene» указывается на более слабую экспрессию в ряде других эпителиальных тканей. Переключение экспрессии десмоколлина было описано в случае колоректального рака с подавлением Dsc2 и активизаций Dscl и Dsc3.
Внеклеточные домены десмосомальных кадгеринов состоят из четырех кадгериновых повторов плюс внеклеточный якорный домен, причем каждый из этих компонентов отделен кальций-связывающим мотивом. Все кадгерины синтезируются как препротеины, которые включают амино-терминальную сигнальную последовательность и пропептид. Считается, что пропептид препятствует внутриклеточному скоплению вновь синтезированных кадгеринов в секреторном механизме клетки. Конвертазы препротеина в концевой сети аппарата Гольджи расщепляют кадгериновый пропептид, производя таким образом зрелый адгезивный белок. Хотя кристаллическая структура десмосомальных кадгеринов остается неизвестной, сравнительные исследования структуры десмосом путем криоэлектронной томографии замороженных гидратированных образцов со структурой раствора классических кадгеринов указывают на общие механизмы межклеточной адгезии, при которых консервативный амино-терминальный триптофановый остаток на одной молекуле кадгерина взаимодействует с гидрофобным приемным карманом в первом внеклеточном домене другой молекулы кадгерина на соседней клетке, образуя транс-адгезивный интерфейс.2 Дополнительно, кадгерины могут участвовать в «cis»-взаимодействиях с молекулами кадгерина одной и той же клетки через свои проксимальные мембранные домены, что может упростить сборку десмосом.
Десмосомальные кадгерины участвуют как в гомофильных (напр., Dsg-Dsg или Dsc-Dsc), так и в гетерофильных (напр., Dsg-Dsc) взаимодействиях, хотя считается, что сильной межклеточной адгезии больше всего содействуют гетерофильные взаимодействия.
Цитоплазматические домены десмосомальных кадгеринов менее консервативны. Десмоколлины имеют две сплайсинговые изоформы: а-изоформу полной длины и укороченную b-изоформу. А-изоформы цитоплазматических доменов десмоглеина и десмоколлины могут также непосредственно связывать плакофилины. Все больше данных указывают на то, что десмосомальные кадгерины являются не только адгезивными молекулами, но могут также активно регулировать межклеточную сигнализацию, транскрипцию и другие процессы в клетке. Этот вывод подтверждается также данными о том, что дефицит десмоколлина-3 у мышей вызывает летальность эмбриона на 2,5 день до имплантации, что указывает на центральную роль десмоколлина-3 в раннем морфогенезе тканей вне зависимости от его десмосомальной адгезивной функции.
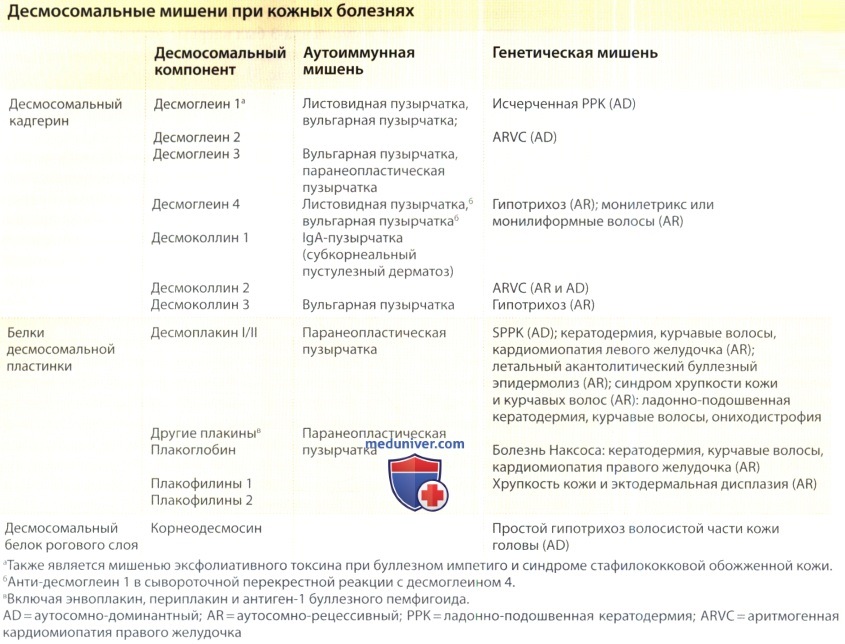
В дерматологии лучше всего известна роль десмосомальных кадгеринов как аутоантигенов при такой иммунобуллезной патологи, как пузырчатка. Ген десмоглеина-3 был впервые открыт и клонирован, поскольку он является аутоантигеном при вульгарной пузырчатке.). С тех пор все десмосомальные кадгерины ассоциируются с аутоиммунными инфекциями человека и/или генетическими болезнями.
Десмоглеин 1 является мишенью патологического протеолитического расщепления при инфекционных заболеваниях, таких как буллезное импетиго и синдром стафилококковой обожженной кожи, а также при наследственных ихтиозах, ассоциированных с синдромом Нетертона. Расщепление десмоглеина 1 стафилококковым эксфолиативным токсином происходит между внеклеточными доменами 3 и 4. Патогенные аутоантитела к десмоглеину 1 обнаружены при листовидной пузырчатке, слизисто-кожной вульгарной пузырчатке и паранеопластической пузырчатке. Большинство патогенных аутоантител листовидной пузырчатки связывают первые два внеклеточных домена десмоглеина 1, которые частично совпадают с участками, важными для транс-адгезии десмоглеина. Аутосомно-доминантные мутации, вызывающие гаплонедостаточность десмоглеина 1, приводят к ладонно-подошвенной кератодермии (ЛПК). ЛПК при этом классически полосовидная и развивается на участках максимальной травмы или трения, но описаны также очаговая и диффузная формы.
Десмоглеин 2 обнаружен при сердечно-сосудистой патологии у человека в качестве причины аутосомно-доминантной аритмогенной кардиомиопатии правого желудочка (АКПЖ). Отсутствие кожных фенотипов у пораженных пациентов указывает на то, что десмоглеин 2 не требуется для эпидермальной адгезии, вероятно, вследствие компенсаторной адгезии с участием более интенсивно экспрессированных в эпидермисе изоформ десмосомальных кадгеринов.
Десмоглеин 3 является мишенью патогенных аутоантител при вульгарной пузырчатке с поражением слизистых оболочек или слизисто-кожным поражением, а также при паранеопластической пузырчатке. Большинство патогенных аутоантител при вульгарной пузырчатке нацелены на амино-терминальные внеклеточные (ЕС1-2) домены десмоглеина 3. Поскольку дефицит десмоглеина 3 у мышей фенотипически похож на аутоиммунитет к десмоглеину 3 при вульгарной пузырчатке слизистых с супрабазальными эрозиями в полости рта, считается, что аутоантитела к пузырчатке являются причиной утраты функции десмосомального кадгерина. Недавние исследования были сконцентрированы на сигнальных механизмах, активируемых после связывания аутоантител вульгарной пузырчатки с кератиноцитами, так как было показано, что несколько биохимических ингибиторов препятствуют образованию пузырей в модели пассивной передачи аутоантител у новорожденной мыши.
Мутации десмоглеина 4 описаны при редких аутосомно-рецессивных формах гипотрихоза и монилетрикса. У одного пациента наблюдались преходящие эрозии на волосистой части кожи головы в течение первых 2 недель жизни. Большинство мутаций в Dsg4 — это мутации со сдвигом рамки считывания или нонсенс-мутации, которые предсказуемо приводят к гаплонедостаточности, хотя сообщалось также о миссенс-мутациях. Иммунореактивность десмоглеина 4 наблюдается в сыворотке вульгарной пузырчатки и листовидной пузырчатки, но дальнейшие исследования связали этот факт с перекрестной реактивностью аутоантител Dsg1.
Десмоколлин 1 является мишенью аутоантител субкорнеального пустулезного дерматоза при IgA- пузырчатке.
Десмоколлин 2, как и десмоглеин 2, мутирует как в аутосомно-доминантной, так и в рецессивной формах АКПЖ без эпидермального фенотипа у пораженных пациентов.
Мутации десмоколлина 3 обнаружены в одной пакистанской семье с аутосомно-рецессивным гипотрихозом. Аутоантитела к десмоколлину 3 обнаружены также у пациентов с вульгарной пузырчаткой, особенно при наличии вегетативных очагов.
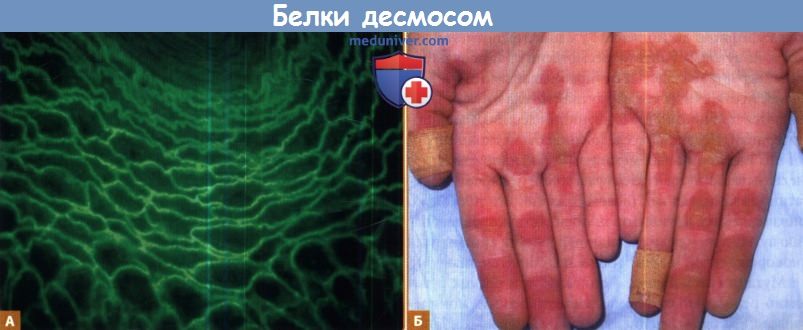
Непрямая иммунофлуоресценция: окрашивание на пищеводе обезьяны сывороткой больного пузырчаткой, которая содержит аутоантитела к десмоглеину 3.
Окрашивание клеточной поверхности и межклеточных пространств диагностическое для пузырчатки.
Б. Полосовидная ладонно-подошвенная керато-дермия ассоциируется с гаплонедостаточностью десмоглеина 1 или десмоплакина.
б) Плакоглобин. Плакоглобин (известный также как γ-катенин) непосредственно связывается с цитоплазматическими хвостами а-изоформ десмоглеина и десмоколлина, а также с Е-кадгерином, основным трансмембранным белком адгезивных контактов в эпидермальных кератиноцитах. Он экспрессирован во всех слоях эпидермиса, а также во всех видах эпителиальных тканей. Плакоглобин, как и плакофилин, является членом семейства armadillo и характеризуется консервативной белковой структурой с головным и хвостовым доменами, примыкающими к многочисленным гомологичным плечевым повторам. Различные домены плакоглобина модулируют его связывание с десмосомальными кадгеринами. Некоторые домены связываются с десмоплакином, соединяя таким образом десмоглеины и десмоколлины с десмоплакином. Плакоглобин может также локализоваться в ядре, где модулирует генную транскрипцию членами семейства TCF/LEF.Хотя большинство описаний десмосом указывают, что с десмоплакином связываются и плакоглобин, и плакофилин, биохимические исследования предполагают, что эти взаимодействия являются взаимоисключающими.
Вероятно, белки семейства armadillo играют более динамические роли в привлечении в пластинку десмосомальных белков, похожих на а-катенин в адгезивных контактах.
Мутации плакоглобина приводят к болезни острова Наксос, аутосомно-рецессивному синдрому в составе диффузной ЛПК, шерстистых волос и аритмогенной кардиомиопатии правого желудочка, которая может проявиться в позднем детском или подростковом возрасте.
в) Десмоплакин. Десмоплакин существует в двух сплайсинговых вариантах РНК: десмоплакин I и II. Неизвестно, выполняют ли различные изоформы разные клеточные функции, однако мутации приводящие к заболеванию, указывают что для нормальной функции десмосом необходим десмоплакин I. Десмоплакин является частью генного семейства плакинов, которое включает белки полудесмосом, такие как антиген буллезного пемфигоида 1 и плектин, а также энвоплакин и пе-риплакин. Как и другие компоненты десмосом, десмоплакин является модульным белком, различные модули которого выполняют разные функции. Одна центральная часть молекулы десмоплакина закручена вокруг центральной части другой молекулы, образуя палочковидный центр. Амино-терминальный головной домен связывается с плакоглобином, а карбоксильный терминальный хвост — с кератином. Следовательно, десмоплакин обеспечивает основную связь между филаментами кератина и десмосомальной бляшкой.
Независимо от его функции в десмосомах, десмоплакин играет также важную роль в развитии, поскольку нулевые по десмоплакину мыши умирают на ранних стадиях эмбриогенеза при Е 6,5 еще до формирования десмосом. С заболеваниями у человека ассоциируется широкий спектр мутаций десмоплакина, которые приводят к различным фенотипическим комбинациям в составе ЛПК (полосовидной или диффузной), дилатационной кардиомиопатии (левого или правого желудочка), шерстистых волос, аномалий ногтей и/или пузырей на коже. Гаплонедостаточность десмоплакина притводит к аутосомно-доминантной полосовидной ЛПК. Аутосомно-рецессивные мутации в десмоплакине описаны в трех семьях из Эквадора с синдромом Карбахал в составе диффузной ЛПК, шерстистых волос и аритмогенной кардиомиопатии левого желудочка. Синдром по типу болезни острова Наксос, включающий ЛПК, шерстистые волосы и АКПЖ, развивается при нонсенс-мутации p.R1267X, которая поражает только сплайсинговую изоформу десмоплакина I, что указывает на недостаточность десмоплакина II для восстановления нормальной функции десмосом в эпидермисе. Летальный акантолитический буллезный эпидермолиз (распространенный эпидермолиз, генерализованная алопеция, анонихия и неонатальные зубы) был вызван сложными гетерозиготными мутациями в десмоплакине, которые привели к утрате хвоста десмоплакина. Кроме того, аутоантитела к десмоплакину обнаруживаются в сыворотке больных с паранеопастической пузырчаткой.
г) Плакофилины. Плакофилины, как и плакоглобин, могут находиться как в плазмолемме, так и в ядре, хотя их функция вне десмосомальной адгезии плохо изучена. Плакофилины непосредственно связываются с десмоплакином и могут также непосредственно связываться с кератином и десмосомальными кадгеринами, что, вероятно, способствует группировке и латеральной стабильности десмосомальной пластинки. Плакофилин-1 ассоциируется также с эукариотическим фактором инициации трансляции eIF4Al в КЭП-структуре мРНК, где он функционирует как регулятор трансляции и клеточной пролиферации.
Мутации в плакофилине-1 вызывают синдром в составе эктодермальной дисплазии и хрупкости кожи, что указывает на роль плакофилина 1 в морфогенезе эпидермиса, а также в адгезии. Мутации плакофилина являются самой частой причиной аутосомно-доминантной АКПЖ. В настоящее время неизвестны заболевания человека, связанные с мутацией плакофилина-3.
д) Другие десмосомальные белки. Энвоплакин и периплакин являются белками десмосомальных пластинок и экспрессированы в поверхностных слоях эпидермиса. Оба белка входят в состав корнеодесмосом рогового слоя. У мышей, дефицитных по энвоплакину, периплакину и инволюкрину, дефектов десмосомальной адгезии не наблюдается, но зато отмечается нарушение десквамации и барьерной функции эпидермиса. Аутоантитела к энвоплакину и периплакину характерны для сыворотки паранеопластической пузырчатки.
Корнеодесмозин — это секретируемый гликопротеин, который входит в состав корнеодесмосом и экспрессирован также во внутреннем корневом влагалище волосяного фолликула. Гетерозиготные мутации в корнеодесмозине ассоциируются с аутосомно-доминантным простым гипотрихозом волосистой части кожи головы. Утрата когезии во внутреннем корневом влагалище и скопление протеолитически расщепленного корнеодесмозина вокруг волосяных фолликулов наблюдаются в биопсиях, взятых с волосистой части кожи головы у пораженных пациентов.
- Рекомендуем далее ознакомиться со статьей "Строение базальной мембраны и ее функции"
Оглавление темы "Базальная мембрана.":- Эпидермальная адгезия и строение десмосом
- Строение белков десмосом и их функции
- Строение базальной мембраны и ее функции
- Строение дермо-эпидермального соединения кожи
- Состав базальной мембраны и ее биохимия
- Строение полудесмосом базальной мембраны и их функции
- Строение якорных филаментов и их функции
- Строение плотной пластины эпителия (lamina densa) и ее функции
- Строение якорных фибрилл и их функции
- Клетки участвующие в образовании базальной мембраны

