Строение якорных филаментов и их функции
Якорные филаменты содержат ламинин-332 и эктодомен коллагена XVII два лиганда, которые взаимодействуют друг с другом посредством ковалентных связей. Эктодомен коллагена XVII, выступающий из плазмолеммы и внедряющийся в светлую пластинку, имеет петлеобразную структуру, соответствующую его роли в качестве белка якорных филаментов.
Ламинин-332 представляет собой соединенный дисульфидными связями комплекс цепей α3, β3 и γ2. Два сплайсинговых варианта α-цепи — α3А и α3В — связываются с цепями α3 и γ2, образуя ламинин 3A32 и 3B32. Теневая микроскопия показывает, что ламинин-332 имеет палочковидную структуру, которая заканчивается глобулярными участками, — форма такой структуры отвечает статусу ламинина-332 как белка якорных филаментов.
По сравнению с другими ламининами длина отдельных цепей ламинина-332 значительно меньше: подобное усечение является следствием утраты структур, эквивалентных коротким плечам других ламининов. Кроме того, цепи α3 и γ2 подвергаются протеолизу после секреции из кератиноцитов, что делает плечевые структуры данного ламинина еще более короткими.
С-конец a-цепи ламинина-332 длиннее С-концов β-цепи и γ-цепи и включает в себя пять глобулярных модулей LG (LG1-LG5), взаимодействующих с рецепторами на клеточной поверхности. Интегрины α3β1 и α6β4 обладают аффинностью к доменам LG1-3, тогда как тандем LG4-5 аффинен к синдеканам и β-дистрогликану на поверхности кератиноцитов. Модули LG4-5 протеолитически расщепляются в большинстве ламининов, причем этот процесс может модулировать взаимодействия с рецепторами клеточной поверхности.
Ламинин-332 образует ковалентные комплексы с ламинином 311 α3β1γ1) и связывается с NCI-доменом белка якорных фибрилл коллагена VII и с дистальным эктодоменом коллагена XVII. Генетические исследования показывают, что ламинин-332 необходим для адгезии кератиноцитов, так как нулевые мутации в любом из компонентов цепей α3, β3 или γ2 приводят к тяжелому пограничному буллезному эпидермолизу Герлица.
Прицельный разрыв гена мыши lama3 препятствовал синтезу ламинина-332 и ламинина-311 и приводил к аномалиям полудесмосом, нежизнеспособности мутировавших клеток эпителия, образованию тяжелых пузырей в пограничной дермоэпидермальной зоне, нарушениям дифференцировки амелобластов в развивающихся зубах, а также к перинатальной смертности. Следовательно, тяжесть нулевого фенотипа ламинина-332 отражает потерю данным белком способности соединять полудесмосомы и якорные фибриллы.
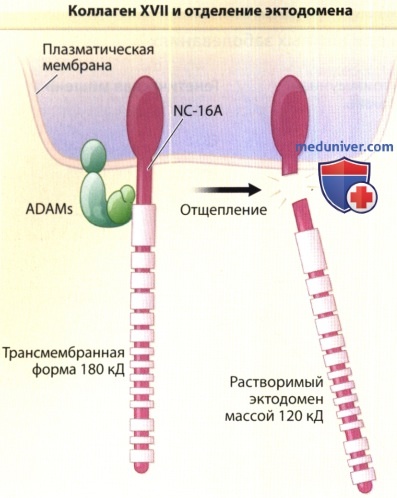
Коллаген XVII представляет собой трансмембранный белок полудесмосомы с внутриклеточным N-концом.
Внеклеточный С-конец (эктодомен) содержит несколько коллагенозных субдоменов (коричневый цвет) и чередуется с неколлагенозными последовательностями (бежевый цвет).
Эктодомен может отщепляться от клеточной поверхности протеиназами семейства ADAM (А-дезинтегрин-подобные белки, содержащие металлопротеиназу), в свою очередь также являющимися трансмембранными протеинами.
Таким образом, молекула полной длины массой 180 кД производит более короткий растворимый эктодомен массой 120 кД.
Молекула полной длины представляет собой классический антиген-2 буллезного пемфигоида, а эктодомен является антигеном массой 120 кД линейного IgA-дерматоза.
Дальнейший распад С-конца эктодомена приводит к образованию антигена массой 97 кД линейного IgA-дерматоза.
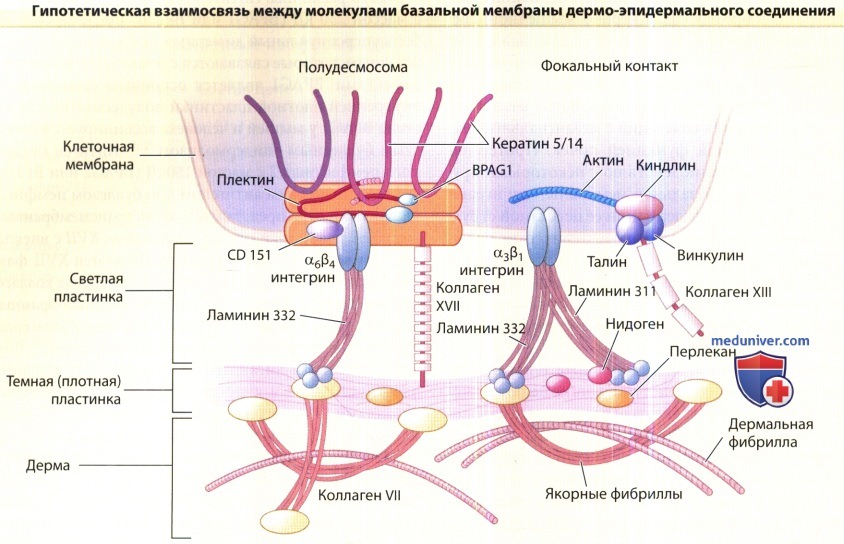
На рисунке ламинин-332 представлен в виде мостика между трансмембранным интегрином полудесмосомы α6β4 и доменом NC-1 коллагена VII.
Сильная связь ламинина-332 с а6β4 и с коллагеном VII обеспечивает первичную устойчивость к воздействию сил трения.
Ее также поддерживает трансмембранный коллаген XVII, так как и его внеклеточный домен связывает ламинин-332.
В эпителиальной клетке трансмембранные элементы связывают белки плотной пластинки полудесмосом, антиген буллезного пемфигоида (BPAG) 1 и плектин, которые затем соединяются с кератинами.
Коллаген VII связывает BPAG1, интегрин α6β4 и плектин, а интегрин α6β4 вступает в связь с плектином.
Комплекс ламининов 5-6 изображен в базальной мембране между полудесмосомами, он связан интегрином α3β1 и соединен с внутриклеточными белками киндлином, талином и винкулином.
По всей вероятности, данный комплекс поддерживает устойчивость базальной мембраны.
In vitro интегрин α3β1, киндлин, талин, винкулин, а также другой трансмембранный коллаген типа XIII расположены в фокальных контактах, которые могут служить связующим звеном между базальной мембраной и сетью кортикального актина эпителия.
В темной пластинке (lamina densa) сети коллагена IV и перлекана стабилизируются нидогеном. Якорные фибриллы прикрепляются к темной пластинке посредством домена NC-1 коллагена VII.
Фибриллы проникают в дерму и либо оканчиваются в якорной пластинке, либо, образуя петлю, возвращаются назад в темную пластинку.
Сеть якорных фибрилл захватывает дермальные фибриллы, обеспечивая адгезию темной пластинки (lamina densa) к сосочковому слою дермы. В изображении молекул масштаб не соблюден.
- Рекомендуем далее ознакомиться со статьей "Строение плотной пластины эпителия (lamina densa) и ее функции"
Оглавление темы "Базальная мембрана.":- Эпидермальная адгезия и строение десмосом
- Строение белков десмосом и их функции
- Строение базальной мембраны и ее функции
- Строение дермо-эпидермального соединения кожи
- Состав базальной мембраны и ее биохимия
- Строение полудесмосом базальной мембраны и их функции
- Строение якорных филаментов и их функции
- Строение плотной пластины эпителия (lamina densa) и ее функции
- Строение якорных фибрилл и их функции
- Клетки участвующие в образовании базальной мембраны

