Меланогенные белки влияющие на синтез меланина
Своевременный и организованный отбор меланогенных ферментов и структурных белков в меланосомы является составной частью формирования меланосом. Белки меланосом экспрессируют сигналы сортировки на аминтерминалах, которые направляют их в эндоплазматическую сеть, а затем в меланосомы.
1. Ферменты:
а) Тирозиназа. Тирозиназа выявлена у растений, насекомых, амфибий и млекопитающих. Первоначально она была обнаружена в начале 1900-х годов в экстрактах грибов, а затем выделена и очищена в 1949 г. из клеток меланомы мыши. Гены тирозиназы мыши и человека имеют длину от 60kb до 70kb и 50kb соответственно.
Ген тирозиназы мыши картируется на хромосоме 7, а ген тирозиназы человека — на хромосоме 11. Ген тирозиназы человека состоит из 5 экзонов и 4 интронов, а матричная РНК тирозиназы имеет в длину примерно 2kb (номер доступа в банк генов NM_000372).
Тирозиназа синтезируется в эндоплазматической сети как прекусорный белок, формирующаяся цепь которого обрабатывается в комплексе Гольджи, где к пептиду добавляются сиаловая кислота и нейтральные сахара посредством N- и О-гликозидных связей в ходе процесса гликозилирования. Идентифицированы как минимум четыре формы тирозиназы, отличающиеся степенью гликозилирования. Этапы гликозилирования важны для соответствующей связи тирозиназы с меланосомами, а также для активности тирозиназы.
После этапов гликозилирования сформировавшаяся тирозиназа складывается в эндоплазматической сети, этот этап необходим для соответствующей транспортировки и отбора тирозиназы в комплекс Гольджи, затем в эндосомы и, наконец, в меланосомы. Строгий контрольный механизм гарантирует устранение дефектной тирозиназы.
Тирозиназа занимает наружную мембрану меланосомы. Она имеет три домена: внутренний меланосомный домен, трансмембранный меланосомный домен и цитоплазматический домен. Внутренний домен, который содержит каталитический участок, составляет примерно 90% белка, за ним следует короткий трансмембранный домен и цитоплазматический домен, состоящий примерно из 30 аминокислот. Гистидиновые остатки, находящиеся во внутреннем (каталитическом) участке тирозиназы связывают ионы меди, необходимые для активности тирозиназы.
Биологическая функция цитоплазматического домена тирозиназы долгое время оставалась неизвестной. В моделях на мышах, у которых этот цитоплазматический домен отсутствовал, белок тирозиназы внедрялся в плазмалемму клетки вместо мембраны меланосомы, что свидетельствует о необходимости цитоплазматического домена тирозиназы для бесперебойной транспортировки тирозиназы в меланосомы. Действительно, было обнаружено, что мотив EXXQPLL (глютаминовая кислота-Х-Х-глютамин-пролин-лейцин-лейцин, где X обозначает любую аминокислоту) в цитоплазматическом домене отвечает за транспортировку тирозиназы в меланосомы.
Кроме того, протеинкиназа С-β (РКС-β) должна фосфорили-ровать два сериновых остатка на этом цитоплазматическом домене, чтобы активировать тирозиназу, причем в отсутствие фосфорилирования пигментации не происходит.
Мутации тирозинкиназы, в том числе миссенс-мутации, нонсенс-мутации со сдвигом рамки и делеции, которые приводят к инактивации фермента, обнаружены при кожно-глазном альбинизме типа I. Такие мутации могут влиять на гликозилирова-ние тирозиназы, препятствуя созреванию фермента, или поражают связывающие медь участки, нарушая активность тирозиназы, либо вызывают преждевременную терминацию белка тирозиназы, что приводит к укорочению цитоплазматического домена.
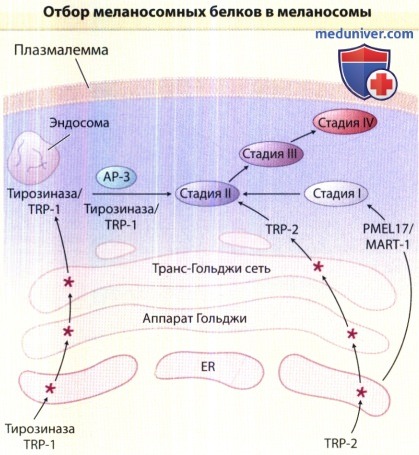
Тирозиназа и родственный тирозиназе белок 1 (TRP-1) вначале синтезируются в эндоплазматической сети (ER) и,
после дополнительных этапов формирования (*) в аппарате Гольджи и транс-сети аппарата Гольджи, упаковываются в эндосомах в один комплекс.
TRP-2 проходит те же этапы формирования. Меланосомы возникают в эндоплазматической сети на стадии I, в которой уже содержатся меланосомные белки PMEL17 и MART-1.
Затем они развиваются в меланосомы стадии II и сливаются стирозиназой/TRP-l при посредстве адаптерного белка 3 (АР-3).
По мере осуществления биосинтеза меланина, меланосомы постепенно все более темнеют.
б) Родственные тирозиназе белки. Два родственных тирозиназе белка, TRP-1 и TRP-2, играют важные роли в меланогенезе. Они структурно схожи с тирозиназой и имеют примерно 40% аминокислотной гомологии. Подобные тирозиназе белки TRP-1 и TRP-2 являются гликопротеинами, которые расположены внутри меланосом и занимают меланосомную мембрану. Консервативная последовательность нуклеотидов и аминокислот у этих трех меланогенных ферментов указывает на их происхождение от общего гена-предка. Мутации в TRP-1 и TRP-2 мышей в соответствии с цветом шкурки («коричневой» и «серой» соответственно) и полиморфизм этих генных продуктов предполагаются в исследованиях европейской популяции в качестве факторов более светлого цвета волос и кожи. Их функции полностью не выяснены, но эти белки образуют комплекс с тирозиназой и могут её стабилизировать.
в) Протеинкиназа С-β. Протеинкиназы С объединяет семейство, состоящее как минимум из 12 изоформ, при этом в регуляции активности тирозиназы участвует изоформа РКС-β. Механизм, посредством которого РКС опосредует широкий спектр генерируемых мембраной сигналов и значение этих сигналов для биологии меланоцитов обсуждаются ниже. РКС-β фосфорилирует сериновые остатки на цитоплазматическом домене тирозиназы и, таким образом, активирует тирозиназу. Однако механизмы, посредством которых опосредуемое протеинкиназой РКС-β фосфорилирование тирозиназы приводит к активации фермента, окончательно не выяснены.
Предполагается, что вследствие фосфорилирования образуется комплекс из тирозиназы и TRP-1, что стабилизирует тирозиназу и повышает ее ферментативную активность.
В меланоцитах активированная РКС-β ассоциируется с меланосомами и обнаруживается в близком соседстве с мембраной меланосомы. Хотя, вследствие структурных различий, изоформы РКС могут связываться с различными субклеточными фракциями, рецепторы активированной С-киназы (RACK), уникальные для каждой РКС-изоформы, определяют перемещение специфических РКС-изоформ в специфические клеточные компартменты для активации мишени протеинкиназы на мембране. RACK-1 является партнером РКС-β, и в меланоцитах человека активированный комплекс PKC-β/RACK-l перемещается в мембрану меланосомы, способствуя фосфорилированию тирозиназы.
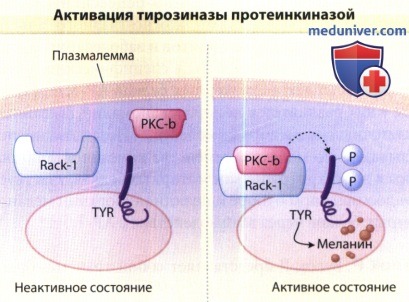
В исходном состоянии отсутствует активация РКС-β и тирозиназа (TYR) не фосфорилируется.
Активированная РКС-β связывает рецепторы для активированной С-киназы-1 (RACK-I), этот комплекс перемещается в меланосому и фосфорилирует сериновые остатки на цитоплазматическом хвосте тирозиназы.
Фосфорилированиетирозиназы активирует фермент, катализирующий биосинтез меланина.
2. Структурные белки. Фибриллярные матриксные белки в меланосоме необходимы для достаточного накопления меланина. Pmel17 и MART-1 представляют собой два таких меланосомных структурных матриксных белка.
а) Pmel17. Pmel17, обозначаемый также gp100 и известный как продукт «серебряного локуса», распознается антителами НМВ45, НМВ50 и NKI-β. Он играет главную роль в формировании фибриллярного матрикса в эумеланосомах. Транскрипция Pmel17 индуцируется а-меланоцит-стимулирующим гормоном (MSH) через MITF. Pmel17 синтезируется в эндоплазматической сети как прекурсорный белок, подвергается гликозилированию и затем расщеплению. После синтеза, Pmel17 транспортируется в меланосомы стадии 1 и формирует фибриллярную структуру, которая является каркасом матрикса эумеланосомы.
Pmel17 придает меланосоме эллипсоидную форму и способствует полимеризации меланина. Меланосомы, у которых Pmel17 отсутствует, не могут перейти в стадию развития II, и активного меланогенеза в них не происходит. Предполагается, что утрата функционального Pmel17 приводит к цитотоксичности меланина, вероятно, вследствие утечки в цитозоль промежуточных продуктов синтеза меланина из аномальных меланосом. Однако гипопигментаций у человека в связи с мутациями в гене Pmel17 не обнаружено.
б) MART-1/Melan A. MART-1 , известный также как Melan А, представляет собой ассоциированный с мембраной белок, который присутствует в меланосомах на стадиях I и II и образует комплекс с Pmel17. MART-1 влияет на экспрессию стабильность, транспортировку и процессинг Pmell7 в меланосомах. К настоящему времени фенотипов гипопигментации, ассоциированных с нефункциональным MART-1 не выявлено.
3. Транспортные белки:
а) Гетеротримерные адаптерные белковые комплексы. Комплексы гетеротримерных адаптерных белков (АР) облегчают отбор связанных с мембраной белков, в том числе тирозиназы, TRP-1, TRP-2 и Pmel17, и их транспортировку в соответствующие органеллы цитозоли. Комплексы АР-3 и возможно также АР-1 способствуют транспортировке тирозиназы из эндосом в меланосомы. Пациенты с синдромом Германски-Пудлака, аутосомно-рецессивным нарушением с проявлениями кожно-глазного альбинизма, дисфункции тромбоцитов и заболевания легких, имеют дефекты в специфических субъединицах комплекса адаптерных белков АР-3, в результате у них развивается несколько аномалий, связанных с клеточным транспортом молекул. Исследования показывают, что молекула семейства кинезинов, двигающихся по микротрубочкам моторных белков, участвует в эндосомальном отборе и позиционировании меланосомных белков через взаимодействие с АР-1.
б) Белок Р. Белок Р представляет собой трансмембранный белок, состоящий из 12 расположенных в мембране доменов с последовательностью, гомологичной последовательности других транспортных белков, в том числе транспортирующих анионы. Считается, что он функционирует как транспортный белок. Исследователи идентифицировали этот белок как ассоциированный с аденозинтрифосфатазой протоновый насос, который отвечает за поддержание кислой среды в меланосомах. К другим предполагаемым функциям белка Р относятся стабилизация комплекса тирозиназа/TRP-1/TRP-2 и/или транспортировка тирозина в меланосомы. У лиц с отсутствием функционального белка Р наблюдается кожно-глазной альбинизм типа 2, вызванный в основном аномалиями меланосомного рН. Синдромы Ангельмана и Прадера-Вили также характеризуются мутациями/делециями, которые включают локус Р на хромосоме 15.
в) SLC24A5. Белок SLC24A5 является меланосомным белком, структура которого и гомология с катионными белками позволяют предположить, что это ассоциирований с меланосомами белок катионного обмена. Мутации в гене slc24a5 у рыбы-зебры приводили к гипопигментации организма. У лиц с темным цветом кожи, включая африканцев и азиатов, экспрессирован гомолог, который достался от предков человека, а у европейцев со светлым цветом кожи экспрессирована вариантная аллель.
4. Белок-скавенджер. Ассоциированные с лизосомами мембранные белки (LAMP). Белки группы LAMP связаны с мембранами и/или матриксом меланосом. Считается, что они защищают целостность меланосомы, действуя как скавенджеры свободных радикалов, которые образуются в ходе биосинтеза меланина. Поскольку LAMP присутствуют и в лизосомах, считается, что лизосомы и меланосомы имеют общее происхождение.
5. Регуляторные белки:
а) Ассоциированный с микрофтальмией фактор транскрипции. Ген и белок. MITF, фактор транскрипции со структурой «основной домен-спираль-петля спираль и лейциновая молния», считается главным геном выживания меланоцитов и ключевым фактором, регулирующим транскрипцию главных меланогенных белков: тирозиназы, TRP-1, TRP-2, РКС-β и MART-1. В меланоцитах транскрипцию тирозиназы и РКС-β стимулирует именно изоформа MITF-M. MITF связывается с консервативными консенсусными элементами в генных промоутерах, в частности M-(AGTCATGTGCT) и E-(CATGTG) боксами. Как гомодимер или гетеродимер, он может связываться с другими членами родственного семейства. MITF является ключевым регулятором, определяющим судьбу клетки, поскольку трансфекция комплементарной ДНК фактора MITF в фибробласты мыши превращает эти клетки в дендритные клетки, экспрессирующие специфические для меланоцита гены.
Семейство MITF включает девять изоформ MITF-M, -A, -D, -Н, -С, -D, -Е, -J и Мс. Экспрессия MITF-M высокоспецифичная для меланоцитарных клеток. Кроме того, меланоциты экспрессируют другие изоформы MITF, в том числе MITF-А, -В и -Е. Биологическая роль других изоформ MITF в нормальных меланоцитах пока неизвестна.
Регуляция активности и экспрессии ассоциированного с микрофтальмией фактора транскрипции. Активность и стабильность MITF модулируется в процессе фосфорилирования белка. Активность MITF возрастает при его фосфорилировании митоген-активированной протеинкиназой-2 (МАР-киназа 2), активность которой, в свою очередь, индуцируется связыванием комплекса SF/kit/SCF с рецептором c-Kit. Фосфорилированный MITF связывается с другим белком, р300/СВР, который принадлежит к семейству белков-коактиваторов и усиливает транскрипционную активность MITF. Еще одна киназа, которая активируется взаимодействием SF/c-Kit,— это киназа p90RSK, которая также фосфорилирует MITF, но на другом участке, отличном от места фосфорилирования МАР-кина-зой-2. Оба эти процесса фосфорилирования активируют MITF и в то же время уменьшают стабильность белка, поскольку фосфорилированный MITF является мишенью для разложения протеосомами.
Экспрессия MITF находится под контролем нескольких факторов транскрипции, включая Sox10 (мутирует при синдроме Ваарденбурга 4 типа, см. главу 73) и РахЗ. Экспрессию MITF контролирует также CREB, белок, связывающий реактивный элемент циклической аденозинмонофосфатазы (цАМФ), и Lef1, транскрипционный фактор, который участвует в Wnt-сигнализации. Эти транскрипционные факторы связываются со специфическими участками в промоутерных регионах MITF и индуцируют транскрипцию MITF. Промоутерные регионы гена MITF содержат реактивный элемент цАМФ (CRE), который взаимодействует с CREB, когда активируется цАМФ-зависимый путь. Поэтому агенты, повышающие уровень цАМФ, такие как a-MSH, индуцируют экспрессию MITF.
Роль ассоциированного с микрофтальмией фактора транскрипции в пролиферации и выживании меланоцитов. MITF способствует выживанию меланоцитов, стимулируя экспрессию главного анти-апоптозного белка—ВС12. При меланомах экспрессия этого белка нередко избыточна или усилена, что способствует их повышенному выживанию. Мутации в MITF выявляются при нарушении пигментации в случае синдрома Ваарденбурга 2 типа.
Предполагается, что MITF играет определенную роль и в пролиферации меланоцитов, поскольку при определенных условиях MITF индуцирует ассоциированную с клеточным циклом киназу Cdk2, которая участвует в переходе клеток из фазы G1 в S-фазу клеточного цикла. MITF также подавляет экспрессию р21, белка, который ингибирует активацию Cdk2. В других условиях, наоборот, MITF может индуцировать экспрессию р21, а также стимулировать экспрессию р16INK4a белка, который ингибирует активацию киназ, необходимых для прохождения клеточного цикла, способствуя тем самым его остановке. Поскольку MITF для осуществления своих функций кооперируется с другими факторами транскрипции, логично предположить, что эти факторы будут влиять на активность MITF, что приведет либо к стимуляции, либо к подавлению пролиферации меланоцитов.
У мышей с нулевыми мутациями гена MITF была выявлена утрата меланоцитов, глухота и неспособность к дифференцировке пигментированного эпителия сетчатки.
б) Рецептор 1 меланокортина. Рецепторы меланокор-тина (MCR) составляют семейство из пяти родственных рецепторов (MC1R, MC2R, MC3R, MC4R и MC5R). Каждый из них имеет семь трансмембранных доменов и принадлежит к суперсемейству рецепторов, сцепленных с G-белками. MC3R и MC4R находятся в основном в центральной нервной системе и отсутствуют в меланоцитах. Считается, что они контролируют потребление энергии. MC2R экспрессирован в коре надпочечников, a MC5R — в периферических адипоцитах. MCI R экспрессирован в различных клетках, в том числе клетках эндотелия, фибробластах и кератиноцитах, но наиболее сильная экспрессия MC1R наблюдается в меланоцитах.
MC1R активируется посредством a-MSH и адренокортикотропного гормона (АКТГ), пептида, состоящего из 39 аминокислот, производного проопиомеланокортина, который содержит последовательность a-MSH. Взаимодействие рецептора и лиганда приводит к зависимой от G-белка активации фермента аденилатциклазы, после чего повышается внутриклеточный уровень цАМФ, индуцируется транскрипция MITF и повышается уровень меланогенных белков, в том числе тирозиназы, что способствует синтезу черного/коричневого эумеланина. Агути, белок, который экспрессирован у людей и у мышей и экспрессия которого у мышей приводит к желтой окраске шерсти, противодействует меланоцитостимулирующему гормону-a, конкурентно связывая MC1R.
Таким образом, он блокирует активность аденилатциклазы и способствует преобладанию синтеза феомеланина над синтезом эумеланина. Однако роль белка агути в пигментации человека документально не описана.
Полиморфизмы в гене MC1R в большой мере влияют на различия в окраске кожи/волос у разных этнических групп. Идентифицировано по меньшей мере 30 различных вариантов MC1R, причем девять из них могут утрачивать свои функции и неспособны индуцировать производство внутриклеточной цАМФ в ответ на a-MSH, несмотря на адекватное связывание рецептором лиганда. Другие варианты MC1R имеют более низкий аффинитет к a-MSH. Три варианта MC1R, каждый с замещением всего одной аминокислоты, ассоциируются с рыжим/желтым цветом волос и светлой кожей у жителей северной Европы и австралийцев.
Мыши с экспрессией рецептора для варианта MC1R с утратой функции также неспособны ответить на УФ-излучение усилением пигментации, несмотря на повышенный уровень эпидермального a-MSH, но все-таки «загорают», если имеется форсколин, химический усилитель пигментации, который, минуя рецептор, непосредственно увеличивает уровень цАМФ, что свидетельствует о функционировании внутриклеточного меланогенного пути у таких особей.
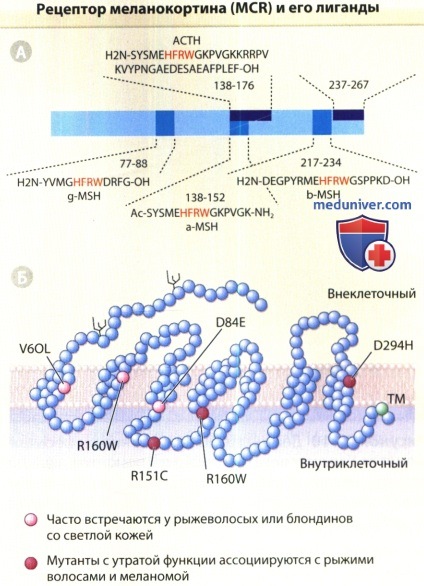
А. Структура прекурсора проопиомеланокортина. Используются стандартные сокращения для аминокислот.
Синтетический аналог суперактивного меланоцитостимулирующего гормона α (α-MSH),
обозначаемый [Nle4 D-Phe7]-a-MSH, модифицирован заменой метионина (М) на норлейцин и L-фенилаланина (F) на D-фенилаланин.
Красным обозначены важные аминокислоты, необходимые для связывания MCR.
Б. Схематическое изображение рецептора MC1R у человека. Каждый из 318 аминокислотных остатков в полипептидной цепи рецептора представлен пустым кружком.
Ответвляющиеся структуры представляют собой N-сцепленные участки гликозилирования.
Указаны мутанты с ослабленной функцией (красные кружки), варианты, распространенные у рыжеволосых и блондинов со светлой кожей (розовые кружки) и консервативный С-терминальный цистеин (зеленый кружок),
возможный участок ацилирования жирной кислоты и прикрепления к плазмалемме.
Ас = ацетилированный; АСТН = адренокортикотропный гормон; NH2 = амидированный; ТМ = трансмембранный домен.

А. Показаны две мыши с различной окраской шерстки. У мыши слева окраска шерстки коричневая/черная вследствие содержания эумеланина,
а у мыши справа— красная/желтая вследствие содержания феомеланина.
Б. Представлены волосяные стержни обеих мышей.
- Рекомендуем далее ознакомиться со статьей "Этапы синтеза меланина"
Оглавление темы "Меланоциты и меланин.":- Строение и функции меланоцитов
- Меланизация и образование меланосом
- Меланогенные белки влияющие на синтез меланина
- Этапы синтеза меланина
- Строение и функции дендритов меланоцитов
- Транспорт меланосом внутри меланоцитов и к кератиноцитам
- Стимуляция и ингибирование синтеза меланина (регуляция функции меланоцитов)
- Сигнальные пути регулирующие функцию меланоцитов
- Этапы и механизмы загара в ответ на ультрафиолетовое облучение
- Повреждение ДНК клеток при меланогенезе - загаре
- Фотостарение и старение меланоцитов

