Клетки врожденной иммунной системы кожи
а) Фагоциты. Фагоцитарную функцию выполняют две ключевые клетки врожденной иммунной системы: макрофаги и PMN (полиморфноядерные нейтрофилы). Эти клетки способны захватывать патогены, распознавать и разрушать их. Некоторые из функций таких клеток регулируются посредством TLR и рецепторов комплемента, как указывалось выше.
PMN обычно не присутствуют в коже, однако, во время воспалительных процессов они мигрируют к месту инфекции и воспаления, где первыми рекрутируются для выполнения фагоцитарной функции. У этих клеток имеются рецепторы, которые непосредственно распознают патогены (см. «Образ-распознающие или паттерн-распознающие рецепторы») и благодаря экспрессии, FcγRII/CD16 и C3bR/CD35 могут фагоцитировать микробы, на поверхности которых находятся антитела и компоненты комплемента С3b.
Вследствие этого, высвобождаются гранулы (содержащие миелопероксидазу, эластазу, лактоферин, коллагеназу и другие ферменты), а также синтезируются убивающие микробы супероксидные радикалы (O2-).
б) Эффекторная функция фагоцитов. Активация фагоцитов патогенами запускает несколько важных эффекторных механизмов, например производство цитокинов. Ряд важных цитокинов секретируется макрофагами в ответ на контакт с микробами, в том числе ИЛ-1, ИЛ-6, TNF-a, ИЛ-8, ИЛ-12 и ИЛ-10 (см. также главу 11).
Еще одним важным защитным механизмом, который запускается в фагоцитах в ответ на патогены, является возбуждение прямых антимикробных реакций. Фагоцитарные клетки, такие как PMN и марофаги, распознают патогены, поглощают их и запускают антимикробные эффекторные механизмы для их уничтожения. PMN осуществляют уничтожение либо зависимым, либо независимым от кислорода путем. Индукция и/или высвобождение токсичных радикалов кислорода, лизосомальных ферментов и противомикробных пептидов приводит к непосредственному уничтожению микробов. Аналогично, активация толл-подобных рецепторов на макрофагах активирует эти различные противомикробные пути, как уже обсуждалось выше.
в) Подтипы макрофагов и функциональные программы. Цитокины, выделяющиеся при адаптивной реакции Т-клеток, влияют на дифференциацию макрофагов: воздействие IFN-y приводит к «классической активации» макрофагов с развитием противомикробной активности, тогда как ИЛ-4 или ИЛ-13, наоборот, индуцируют дифференциацию по пути «альтернативной активации» макрофагов, усиливающему гуморальные и противопаразитарные иммунные реакции. Цитокины, продуцируемые при врожденных реакциях иммунной системы, также запускают определенные программы дифференциации макрофагов. ИЛ-10 индуцирует программу фагоцитоза в макрофагах, что приводит к поглощению липидов и бактерий.
Наоборот, ИЛ-15 вызывает активацию противомикробной программы макрофагов. Эти данные позволили установить, что врожденные иммунные реакции, в зависимости от селективной индукции ИЛ-10 или ИЛ-15, по-разному программируют макрофаги на формирование фагоцитарных либо противомикробных реакций, что в значительной степени определяет исход инфекционного процесса.
Фагоцитарные клетки врожденной иммунной системы могут также активироваться клетками системы адаптивного иммунитета. CD40, гликопротеин массой 50 kd, присутствует на поверхности В-клеток, моноцитов, дендритных клеток и клеток эндотелия. Лигандом CD40 является CD40L, трансмембранный белок типа II массой 33 kd, который экспрессируется преимущественно на активированных Т-клетках CD4+ и тучных клетках. Взаимодействия CD40-CD40L играют решающую роль в развитии эффекторных функций. Через взаимодействие CD40-CD40L Т-клетки CD4+ активируют макрофаги и моноциты для синтеза ФНО-а, ИЛ-1, ИЛ-12, интерферона-у (ИНФ-у) и NO. Было также показано, что CD40L спасает циркулирующие моноциты от апоптоза, удлиняя срок их выживания в месте воспаления. Вдобавок взаимодействия CD4-CD40L во время активации Т-клеток атиген-презентирующими клетками стимулируют выработку ИЛ-12.
Отсюда можно заключить, что взаимодействия CD40-CD40L между Т-клетками и макрофагами играют определенную роль в поддержании клеточных реакций по типу ТЫ и в опосредовании воспалительных реакций. Другие исследования показали роль взаимодействий CD40-CD40L в активации и дифференцировке В-клеток, а также в переключении класса иммуноглобулинов. Кроме того, взаимодействия CD40-CD40L приводят к стимуляции В7.1 (CD80) и В7.2 (СВ86) на В-клетках. Эта стимулирующая активность, индуцированная на В-клетках, усиливает Т-клеточный ответ. Данные механизмы свидетельствуют о важности взаимодействия между врожденной и адаптивной иммунной системой в осуществлении эффективного иммунного ответа.
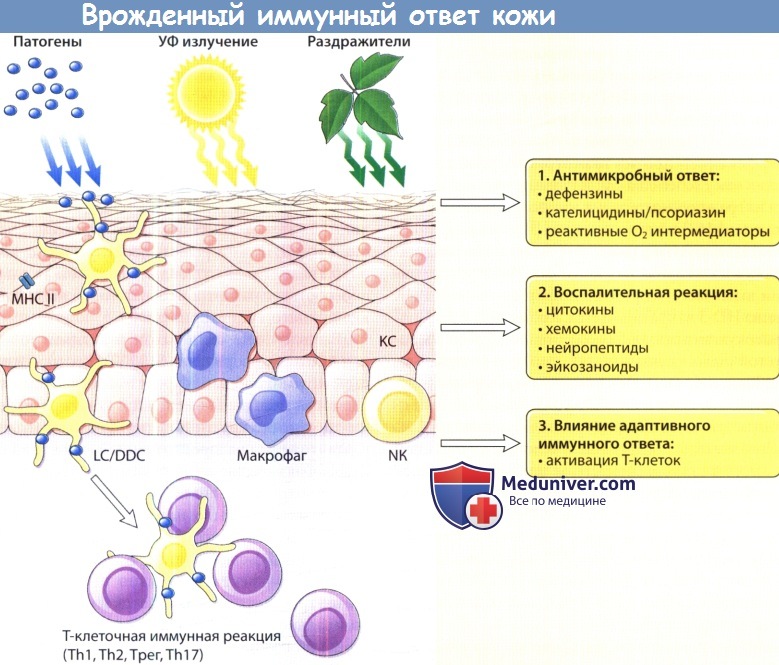
такие как чужеродные патогены, ультрафиолетовое (УФ) излучение и химические раздражители, врожденные иммунные клетки
(гранулоциты, мононуклеарные фагоциты, естественные клетки-киллеры [NK], кератиноциты) генерируют различные типы реакций, включая:
1) высвобождение антимикробных агентов;
2) индукцию медиаторов воспаления, таких как цитокины, хемокины, нейропептиды и эйкозаноиды и
3) инициацию и модуляцию адаптивного иммунного ответа.
DDC = дермальная дендритная клетка; КС = кератиноцит; LC = клетка Лангерганса;
МНС II = главный комплекс гистосовместимости класса II;
Th1, Th2,17= Т-хелпер 2, Th17; Treg = регуляторная Т-клетка.
г) Естественные киллеры (ЕК-клетки). ЕК-клетки представляют собой крупные гранулярные лимфоциты. У человека подавляющее большинство этих клеток принадлежат к фенотипу CD3+, CD56+, CD16+, CD94+, CD161+. Их контрольная функция состоит в поиске измененных клеток, которые могут трансформироваться под действием вирусов (например, цитоме-галовируса), бактерий (например, Listeria monocytogenes) или паразитов (например, Toxoplasma gondi). Эти патогены уничтожаются посредством перфорин-гранзимных или Fas-FasL-зависимых механизмов или же косвенно через секрецию цитокинов (например, ИНФ-у).
Как естественные киллеры различают здоровую ткань и трансформировавшуюся или инфицированную? Все клетки, имеющие ядра, экспрессируют молекулы класса II ГКГ (МНС). ЕК-клетки имеют рецепторы, которые называются ингибиторными рецепторами киллеров и распознают свои молекулы ГКГ класса I. При распознании отдается отрицательный сигнал ЕК-клетке, который ее парализует. Если же клетка утрачивает экспрессию своих молекул ГКГ класса I, что часто случается после злокачественной трансформации или вирусной инфекции, ЕК-клетка при встрече с такой трансформированной клеткой активируется и убивает ее.
Кроме того, ЕК-клетки имеют активирующие рецепторы, которые связывают ГКГ-подобные лиганды на клетках-мишенях. Одним из таких рецепторов является NKGD2, который связывается с неклассическими молекулами ГКГ класса I типов А и В: MICA и MICB. MICA и MICB в нормальной ткани экспрессированы недостаточно, но при карциномах наблюдается их избыточная экспрессия. ЕК-клетки способны уничтожать опухоли, несущие MICA/MICB, что свидетельствует о роли NKGD2 в иммунной защите.
Еще один тип клеток, который по крайней мере у мышей, может выполнять подобную функцию,— производящая интерферон киллерная дендритная клетка, обладающая сходством как с дендритными клетками, так и с ЕК-клетками. Эквивалент такой клетки у человека еще предстоит определить.
д) Кератиноциты. Ранее считали, что роль кератиноцитов заключается лишь в поддержании физического барьера кожных покровов. Однако кератиноциты, преобладающий тип клеток в эпидермисе, могут участвовать во врожденных иммунных реакциях путем объединения иммунных и/или воспалительных реакций посредством секреции цитокинов и хемокинов, метаболитов арахидоновой кислоты, компонентов комплемента и противомикробных пептидов.
Кератиноциты в здоровой коже производят лишь некоторые из этих медиаторов, в частности, цитокины ИЛ-1, ИЛ-6 и трансформирующий фактор роста β (transforming growth factor—TGR-β). В цитоплазме резидентных кератиноцитов содержатся большие количества сформировавшихся ранее и биологически активных ИЛ 1-а, а также незрелых ИЛ 1-β. Вероятная роль in vivo этих накопленных внутриклеточных ИЛ-1 состоит в немедленной инициации воспалительного и репаративного процессов после повреждения эпидермиса. ИЛ-7 представляет собой важный фактор роста лимфоцитов, который, вероятно, играет определенную роль в выживании и пролиферации Т-лимфоцитов кожи человека. Существуют данные о том, что ИЛ-7 вызывает распространение лимфомных клеток при синдроме Сезари.
TGR-β, кроме функции регулировки роста кератиноцитов и фибробластов, модулирует воспалительный и иммунный ответы и важен для развития клеток Лангерганса. При поступлении некоторых опасных или хотя бы содержащих потенциальные риски стимулов (например, гипоксии, травмы, неионизирующего излучения, гаптенов или других быстро реагирующих химикатов, таких как катехолы ядовитого плюща, двуокись кремния, липополисахариды и микробные токсины), производство и/ или секреция многих цитокинов часто резко возрастают. Биологические следствия этого явления многогранны и включают инициацию воспаления (ИЛ-1, ФНО-а, ИЛ-6, члены семейства хемокинов), модулирование фенотипа и функции клеток Лангерганса (ИЛ-1 GM-GSF, ФНО-а, ИЛ-10, ИЛ-15), активацию Т-клеток (ИЛ-15, ИЛ-18), ингибицию Т-клеток (ИЛ-10, TGR-β) и смещение лимфоцитарного ответа в направлении типа 1 (ИЛ-12, ИЛ-18), типа 2 (стромальный лимфопротеин тимуса) или Th17 (ИЛ-23). В некоторых случаях кератиноциты участвуют также в усилении сигналов воспаления в эпидермисе, исходящих от второстепенных популяций эпидермальных клеток.
Выразительным примером является индукция в кератиноцитах про-воспалительных цитокинов, таких как ФНО-а, интерлейкином ИЛ 1-β, происходящим из клеток Лангерганса, в фазе инициации аллергического контактного дерматита. В присутствии сильного стимула производимые кератиноцитами цитокины могут поступать в кровоток в количествах, которые вызывают системные эффекты. Например, во время выраженной реакции на солнечный ожог сывороточные уровни ИЛ-1, ИЛ-6 и ФНО-а явно повышены и, вероятно, являются причиной системных проявлений этой реакции, в частности, лихорадки, лейкоцитоза и синтеза белков острой фазы. Имеются также данные о том, что инициируемые ультрафиолетовым (УФ) излучением цитокины ИЛ-6 и ИЛ-10 могут запускать производство аутоантител и таким образом участвовать в обострении аутоиммунного заболевания, например красной волчанки. Поскольку продукты секреции кератиноцитов могут попадать в кровоток, это предположительно может быть использовано в терапевтических целях. В работе Fenjeves и соавт. было показано, что пересадка мыши кератиноцитов человека с трансфекцией гена алипопротеина Е приводит к появлению алипопротеина Е в крови мыши, и этот факт подтверждает осуществимость такого подхода.
Некоторые из врожденных функций кератиноцитов могут быть инициированы при активации TLR, поскольку кератиноциты экспрессируют TLR 1-6 и 9 типов. Таким образом, распознавая микробные патогены посредством TLR, кератиноциты могут выступать первым звеном реакции со стороны врожденного иммунитета кожи. Активация TLR приводит к продукции ке-ратиноцитами провоспалительных цитокинов (в том числе TNF-a и ИЛ-8), противомикробных пептидов (HBD-2 и НВО-3), а также реактивных медиаторов кислорода (iNOS). Активация TLR3 и TLR9 на кера-тиноцитах вызывает продукцию интерферона I типа (IFN-α/β), который может играть важную роль в стимуляции противовирусных иммунных реакций. И наконец, эти опосредованные TLR реакции могут быть усилены при воздействии сигналов об опасности, таких как токсины, раздражители, УФ-свет, формирующиеся при инфекционном процессе пурины (активация рецептора Р2х7) и активация других рецепторов опознавания образа (NOD1 и NOD2); все эти факторы стимулируют опосредованную инфламмосомами активацию каспазы-1, что приводит к расщеплению про-ИЛ-1βс образованием его активной формы.
Еще одной важной функцией кератиноцитов является секреция факторов, управляющих притоком и оттоком лейкоцитов в кожу и из кожи. Хороший пример представляют собой два хемокина: тимусовый, регулируемый при активациихемокин (TARC; лиганд 17хемокина СС или CCL17) и кожный хемоаттрактант Т-клеток (CTACK/CCL27) с соответствующими им рецепторами CCR4 и CCR10, которые избирательно экспрессированы на хоуминговых Т-лимфоцитах кожи. Блокирование обоих хемокинов резко ингибирует миграцию Т-клеток в кожу при моделировании контактной гиперчувствительности у мыши. Воспалительный белок макрофагов 3a (MIP-3a)/CCL20 образующийся в кератиноцитах, также играет важную роль в привлечении лейкоцитов в эпидермис. Его секреция запускается или усиливается ИЛ-17 и его контррецептор CCR6 имеется на предшественниках клеток Лангерганса и определенных Т-клетках.
Цитокины Т17 (ИЛ-17, ИЛ-21 и ИЛ-22) также модулируют врожденные иммунные функции других кератиноцитов. Например, ИЛ-17 и ИЛ-22 стимулируют продукцию противомикробных пептидов кератиноцитами, включая HBD-2, кателицидин и псориазин. Кроме того, ИЛ-21 и ИЛ-22 индуцируют пролиферацию кератиноцитов, что приводит к гиперплазии эпидермиса и акантозу, что наблюдается при псориазе.
Наличие цитокиновых рецепторов на кератиноцитах и реактивность цитокинов под действием кератиноцитов свидетельствуют о том, что функциональные свойства этих клеток могут регулироваться клетками иммунной системы. Вследствие этого кератиноциты экспрессируют, сами или под определенным воздействием, иммунологически значимые участки поверхности клетки, на которые могут нацеливаться лейкоциты для передачи стимулирующего или ингибирующего сигналов.
Кроме цитокинов, кератиноциты секретируют другие факторы, такие, как нейропептиды, эйкозаноиды и реактивные формы кислорода. Эти медиаторы обладают мощными воспалительными и иммуномодулирующими свойствами и играют важную роль в патогенезе воспалительных и инфекционных кожных заболеваний, а также в процессе старения кожи.
Кератиноциты могут также синтезировать комплемент и соответствующие рецепторы, включая рецептор С3b [рецептор комплемента 1 (CR1), CD35], рецептор вируса Эпштейна-Барр CR2 (рецептор C3d, CD21), рецептор С5а (CD88), мембранный кофакторный белок (CD46), фактор, ускоряющий расщепление (CD55) и протектин комплемента (CD59). CD59 может защищать кератиноциты от атаки комплемента. Его привлечение посредством CD2 стимулирует секрецию провоспалительных цитокинов из кератиноцитов. Мембранный ко-фактор (CD46) является рецептором белка М стрептококков группы А и вируса кори. Его связывание индуцирует провоспалительные цитокины в кератиноцитах, в частности, ИЛ-1a, ИЛ-6 и GM-GSF.
- Рекомендуем далее ознакомиться со статьей "Лимфоциты адаптивного иммунного ответа кожи"
Оглавление темы "Иммунитет кожи.":- Болезни волос и кожи при цветной коже
- Рак кожи при цветной коже
- Советы по косметологическим процедурам при цветной коже
- Врожденный и адаптивный иммунитет кожи
- Молекулы врожденной иммунной системы кожи
- TOLL подобные рецпторы (TLR) кожи
- Клетки врожденной иммунной системы кожи
- Лимфоциты адаптивного иммунного ответа кожи
- Наивные Т-лимфоциты кожи
- T-хелперы кожи (Th1, Th2 лимфоциты кожи)

