Молекулы врожденной иммунной системы кожи
Иммунные механизмы, которые используются организмом для того, чтобы немедленно защитить себя, называются врожденным иммунитетом. К ним относятся физические барьеры, такие как эпителий кожи и слизистых оболочек; растворимые факторы, такие как комплемент, антимикробные пептиды, хемокины и цитокины, а также клетки, в том числе моноциты/макрофаги, дендритные клетки, естественные киллеры и полиморфоядерные лейкоциты (ПМЛ). Современное понимание врожденного иммунитета базируются на исследованиях Ильи Мечникова, который в 1984 г. опубликовал исследования водяной блохи Daphnia и ее взаимодействия с дрожжеподобным грибком.
Он продемонстрировал, что клетки водяной блохи, которые он назвал «фагоцитами», прикреплялись к инородным спорам и поглощали их с последующим «убийством и уничтожением». Таким образом, Мечников описал ключевые прямые функции клеток врожденной иммунной системы; (1) быстрое выявление микробов, (2) фагоцитоз и (3) противомикробная активность. Вдобавок к этой прямой роли в защите организма-хозяина врожденная иммунная система играет непрямую роль в обучении и предопределении типа адаптивных реакций Т- и В- клеток. Наконец, врожденный иммунный ответ посредством индукции воспаления может вызвать повреждение ткани.
а) Физические и химические барьеры кожи. Физические барьеры не позволяют большинству патогенов и токсинов окружающей среды нанести вред организму. Кожа и эпителиальный слой респираторного, желудочно-кишечного и мочеполового трактов создают физический барьер между организмом и внешним миром. Кожа, которую когда-то считали инертной структурой, играет жизненно важную роль в защите человека от внешней среды. Эпидермис препятствует проникновению микробных организмов, химических раздражителей и токсинов, поглощает и блокирует солнечное и ионизирующее излучение, а также препятствует потере воды.
б) Молекулы врожденной иммунной системы. 1. Комплемент. Одним из первых врожденных защитных механизмов, который встречают преодолевающие эпидермальный барьер патогены, является альтернативный путь активации комплемента. В отличие от классического пути комплемента, для запуска которого требуется наличие антител, лектиновый путь, а также альтернативный путь комплемента могут спонтанно активироваться поверхностью бактериальных клеток в отсутствие специфических антител. Таким образом, защитный механизм организма активируется сразу же после встречи с патогеном, а не через 5-7 дней, необходимых для выработки антител.
2. Антимикробные пептиды. Антимикробные пептиды являются важными врожденными защитными механизмами, сохранившимися в процессе эволюции у многих организмов. Обычно имеют положительный заряд и обладают амфифильными свойствами, имея как гидрофобную, так и гидрофильную поверхность. Считается, что противомикробная активность этих пептидов связана с их способностью связываться с мембранами микробов (благодаря гидрофобности их поверхности) и образовывать поры в мембране, что вызывает гибель микроба. В различных тканях и секретах человека выявлено множество антимикробных пептидов. Этот раздел будет посвящен антимикробным пептидам, выявленным в клетках, постоянно находящихся в коже, в том числе β-дефензинам (HBD-1, HBD-2, HBD-3), кателицидину (LL-37), псориазину и РНКазе-7, синтезируемым кератиноцитами, и дермцидину, который у человека секретируется с потовой жидкостью.
Кроме того, существует множество других антимикробных пептидов, секретируемых клетками, которые инфильтрируют кожу и могут участвовать во врожденных иммунных реакциях в коже.
β-дефензины представляют собой богатые цистеином катионные антимикробные пептиды с низким молекулярным весом. Первый β-дефензин человека, HBD-1, был выделен из гемофильтрата, полученного у пациента с терминальной стадией почечной недостаточности. Он в основном экспрессирован в эпидермисе и не подвергается транскрипционной регулировке со стороны агентов воспаления. HBD-1 обладает противомикробным действием против грамотрицательных бактерий и, вероятно, играет определенную роль в дифференцировке кератиноцитов. Второй |3-дефензин человека, HBD-2, был открыт в экстрактах из очагов у пациентов с псориазом. В отличие от экспрессии HBD-1, экспрессия HBD-2 индуцируется микробами, включая Pseudomonas aeruginosa, Staphylococcus aureus и Candida albicans. Экспрессию HBD-2 могут стимулировать не только микробы.
Провоспалительные цитокины, включая фактор некроза опухоли альфа (ФНО-а) и интерлейкин 1 (ИЛ-1), также могут вызвать транскрипцию в кератиноцитах. При проверке антимикробной активности HBD-2 оказался эффективен против грамотрицательных бактерий, таких как Escherichia coli и Р. aeruginosa, но не действовал на грамположительные микроорганизмы, такие как S. aureus. HBD-3 это еще один β-дефензин, впервые выделенный из экстракта, полученного из высыпаний у больных псориазом. Контакт с ФНО-а и с бактериями вызывает экспрессию информационной РНК дефензина HD-3 в кератиноцитах. Кроме того, HD-3 показал высокую антимикробную активность против S. aureus и устойчивых к ванкомицину штаммов Enterococcus faecium. Таким образом, HD-3 относится к первым β-дефензинам кожи, обладающими эффективным противомикробным действием против грамположительных бактерий.
Локализация β-дефензинов человека во внешнем слое кожи и их широкоспекторное противомикробное действие позволяют предположить, что β-дефензины человека являются важной частью врожденного кожного иммунитета. Более того, данные о том, что β-дефензины привлекают дендритные клетки (ДК) и Т-клетки памяти посредством рецептора 6 хемокина СС (CCR6) указывают на наличие связи между врожденным и адаптивным иммунитетом в коже.
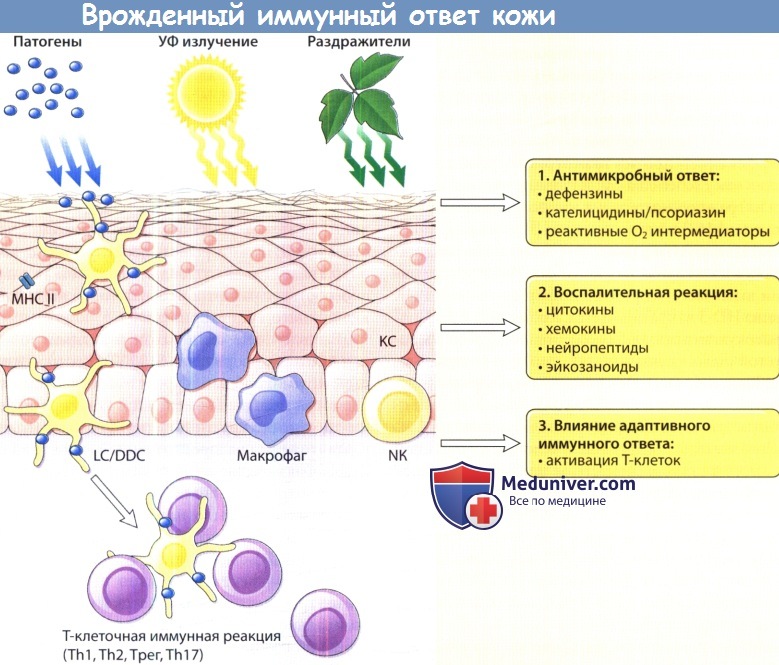
такие как чужеродные патогены, ультрафиолетовое (УФ) излучение и химические раздражители, врожденные иммунные клетки
(гранулоциты, мононуклеарные фагоциты, естественные клетки-киллеры [NK], кератиноциты) генерируют различные типы реакций, включая:
1) высвобождение антимикробных агентов;
2) индукцию медиаторов воспаления, таких как цитокины, хемокины, нейропептиды и эйкозаноиды и
3) инициацию и модуляцию адаптивного иммунного ответа.
DDC = дермальная дендритная клетка; КС = кератиноцит; LC = клетка Лангерганса;
МНС II = главный комплекс гистосовместимости класса II;
Th1, Th2,17= Т-хелпер 2, Th17; Treg = регуляторная Т-клетка.
Кателицидины представляют собой катионные пептиды с вариабельным противомикробным доменом на С-конце. Если у млекопитающих, таких как свиньи или крупный рогатый скот, существуют различные гены кателицидина, то у людей (и мышей) имеется только один ген. Прекурсорный белок человека hCAP18 (противомикробный белок кателицидина человека 18) синтезируется клетками кожи, в том числе кератиноцитами, тучными клетками, нейтрофилами и клетками выводных протоков эккринных желез. Протеиназы нейтрофилов (например, протеиназа-3) трансформируют hCAP18 в эффекторную молекулу LL-37, играющую важную роль в защитном механизме кожи человека благодаря выраженному антибактериальному, противогрибковому" и противовирусному действиям. LL-37 участвует во врожденном иммунитете, привлекая тучные клетки и нейтрофилы посредством формилпептидного рецептора 1 и вызывая высвобождение медиаторов из нейтрофилов с помощью зависимого от протеина G, но не зависимого от иммуноглобулина Е (IgE) механизма. Было показано, что LL-37 секретируется в пот человека, где расщепляется на пептиды RK-31 или KS-30 посредством сериновых протеиназ.
Интересно, что эти компоненты демонстрируют даже более выраженное противомикробное действие, чем целостная молекула LL-37. Один из наиболее важных индукторов экспрессии LL-37 это витамин D, эффект которого может быть запущен толл-подобным рецептором (TLR), активирующим рецептор витамина D и гены витамин-D-1-гидроксилазы, что приводит к усилению противомикробной активности.
При атопическом дерматите активность LL-37 понижена, вероятно, вследствие действия Т2-цитокинов ИЛ-4 и ИЛ-13, что делает атопическую кожу более восприимчивой к кожным инфекциям, например, инфекции S. aureus, вируса коровьей оспы (вакцинальная экзема) или вируса простого герпеса (герпетическая экзема).
Более того у пациентов с розацеа обнаружено высокое содержание неправильно содревших форм белков кателицидина (в результате посттрансляционного процессинга ферментом трипсином рогового слоя), что способствует усилению воспаления в коже. Кателицидин может также образовывать комплексы с собственной ДНК, которые способствуют активации TLR9 на плазмацитоидных дендритных клетках в дерме, что способствует развитию воспаления в коже, вносящего вклад в патогенез псориаза.
Выявлен еще один важный антимикробный пептид человека, псориазин (S100A7), который реализует свой антимикробный эффект путем повышения проницаемости мембраны бактерий. Он секретируется преимущественно кератиноцитами и играет главную роль в уничтожении распространенной кишечной бактерии Е. coli. Фактически лечение кожи человека in vivo антителами псориазина приводит к резкому росту Е. coli.
Кроме того, было показано, что экспрессия псориазина кератиноцитами возникает в результате стимуляции TLR5 флагеллином Е. coli. Помимо антимикробного эффекта псориазин обладает свойствами хемоаттрактанта для CD4 клеток и нейтрофилов. Первоначально РНКаза 7 была выделена из рогового слоя здоровой кожи человека. РНКаза 7 обладает мощной активностью рибонуклеазы, а также широким спектром противомикробных свойств в отношении S. aureus, Р. acnes, Р. aeruginosa, Е. coli и С. albicans. Образование РНКазы 7 в культуре кератиноцитов человека может быть вызвано ИЛ-1β, IFN-γ и бактериальным обсеменением. Интересно отметить, что интенсивная экспрессия РНКазы 7 в коже человека обеспечивает защиту кожи от инфицирования S. aureus. Дермцидин это антимикробный пептид, экспрессирующийся в потовых железах человека. Дермцидин подвергается постсекреторной протеолитической обработке в потовых железах, в результате которой формируются анионные и катионные пептиды дермцидина, выделяющиеся на поверхность кожи.
Эти пептиды дермцидина обладают антимикробными свойствами широкого спектра, и действуют против S. aureus, Е. coli, E.faecalis и С. albicans.Xотя механизм реализации свойств дермцидина неизвестен, он не вызывает образования пор в отличие от других противомикробных пептидов.
3. Паттерн-распознающие рецепторы (или образ-распознающие). Как клетки врожденной иммунной системы распознают чужеродные патогены? Один из путей распознания и уничтожения патогенов врожденной иммунной системой осуществляется посредством рецепторов фагоцитарных клеток. В отличие от адаптивного иммунитета, врожденный иммунный ответ опирается на относительно небольшую группу рецепторов, кодируемых в зародышевой линии, которые распознают эволюционно консервативные молекулярные образы, общие для большой группы патогенов. К ним обычно относятся молекулярные структуры, необходимые для выживания микробов и не подверженные избирательному давлению. Кроме того, патоген-ассоциированные молекулярные образы являются специфическими для микробов и не экспрессируются в системе организма. Таким образом, врожденная иммунная система создала удобный путь распознания «своего» и «чужого» и передает эту информацию адаптивной иммунной системе.
Ключевое значение приобрело и открытие толл-подобных рецепторов (toll-like receptors или TLR), названных так благодаря сходству с геном Toll у дрозофилы, белковый продукт которого участвует во врожденном иммунитете и развитии дорсовентральной полярности фруктовой мухи. Важность сигнальных толл-подобных рецепторов в клетках млекопитающих подтверждается тем фактом, что богатый лейцином трансмембранный белок TLR4 участвует в распознании липополисахарида (LPS).
Кроме TLR существует целый ряд других трансмембранных молекул, которые ощущают присутствие патогенов. К ним относятся триггерные рецепторы, экспрессированные на белках миелоидных клеток (TREM), молекулярное семейство сиглеков и группа лецитиновых рецепторов С-типа. Последние значительно выражены на антиген-презентирующих клетках (АПК) как, например, дектин-1 и DC-SIGN [специфичный для дендритных клеток нонинтегрин, захватывающий молекулу внутриклеточной адгезии-3 (ICAM-3)]. Они способны опосредовать эффективное связывание микроорганизмов, участвуют в реализации фагоцитоза и индуцируют активацию сигнальных путей, приводящую к развитию противомикробного эффекта.
Члены белкового семейства TREM функционируют в качестве катализаторов врожденных реакций. Примерами экстремальных последствий микробной активации белков TREM являются угрожающая жизни септицемия и смертельные геморрагические лихорадки, вызываемые инфекцией вирусов Марбурга или Эбола.
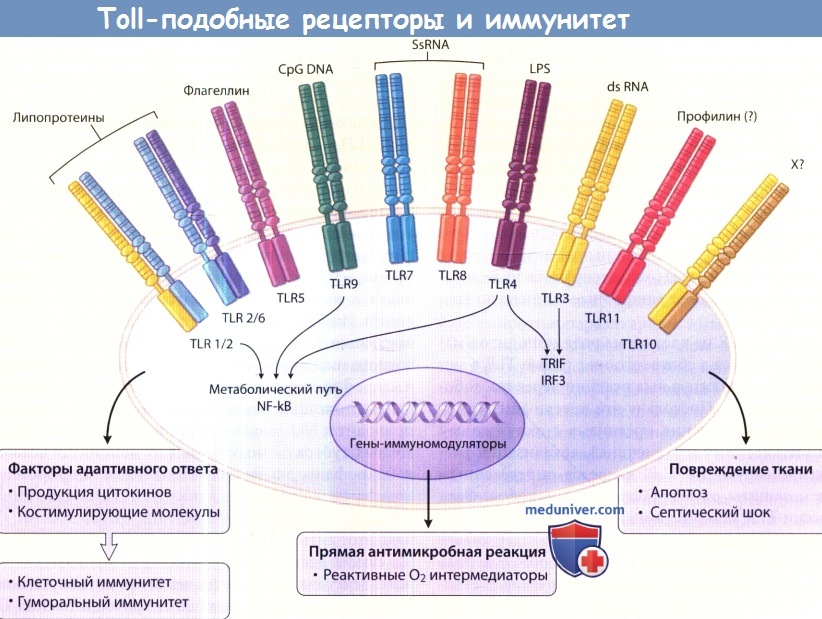
Активация TLR специфическими лигандами вызывает:
1) высвобождение цитокинов и костимулирующих молекул, которые определяют тип адаптивного иммунного ответа;
2) прямую антимикробную реакцию и 3) повреждение ткани.
CpGDNA = иммуностимулирующие, богатые цитозином и гуанином последовательности ДНК;
dsRNA = двухцепочечная РНК; LPS = липополисахарид; NF-kB = ядерный фактор кВ;
ssRHA = одноцепочечная РНК; X = неизвестный лиганд.
4. Толл-подобные рецепторы. В настоящее время получены убедительные данные в поддержку роли толл-подобных рецепторов («toll-like receptors’ или TLR) во врожденном иммунитете млекопитающих. Во-первых, TLR распознают патоген-ассоциированные молекулярные образы, которые присутствуют в различных бактериях, грибах и вирусах. Во-вторых, TLR выражены на участках, которые наиболее подвержены микробным воздействиям. В-третьих, активация TLR индуцирует сигнальные пути, которые, с одной стороны, стимулируют производство эффекторных молекул (реактивных форм кислорода, NO), а с другой — способствуют экспрессии костимулирующих молекул и высвобождению цитокинов, что усиливает адаптивный ответ. В-четвертых, TLR непосредственно активируют защитные механизмы организма, которые затем противостоят чужеродному вторжению.
Первоначально экспрессия TLR была обнаружена во всех лимфоидных тканях, но наиболее сильно они были экспрессированы в лейкоцитах периферической крови, включая моноциты, В-клетки, Т-клетки, гранулоциты и дендритные клетки.
В экспериментах, проведенных в лаборатории Modlin и другими авторами, были получены очень интересные данные о том, что микробные липопротеины инициируют реакцию организма-хозяина посредством TLR2, для активации которого требуется наличие активного ацильного радикала. Впоследствии было обнаружено, что триацилированные липопротеины активируют гетеродимеры TLR2/1,41 тогда как диацилированные липопротеины активируют гетеродимеры TLR2/6.42 Для распознавания бактерий системы TLR-рецепторов достаточно с избытком: TLR9 активируется неметилированными последовательностями ДНК (динуклеотидами CpG), которые обнаруживаются в бактериальной ДНК, a TLR5 активируется флагеллином бактерий. Определенные TLR-рецепторы участвуют в распознавании вирусов: TLR3 активируется вирусной двухцепочечной РНК, a TLR7 и TLR8 — вирусной одноцепочечной РНК. Данные о различной локализации экспрессии толл-подобных рецепторов, в частности, на моноцитах, макрофагах, дендритных клетках, В-клетках, эндотелии и эпителии, указывают на то, что каждый TLR может запускать специфическую реакцию организма-хозяина.
Кроме того, толл-подобные рецепторы экспрессируются в определенных субклеточных компартментах: TLR7,8 и 9 локализуются на эндосомах, где они встречаются с микробными патогенами, поступающими в клетку при эндоцитозе. Другие толл-подобные рецепторы экспрессируются на поверхности клеток и выявляют микробные лиганды во внеклеточной среде.
Экспрессия TLR на клетках из рода моноцитов/макрофагов находится в соответствии с ролью TLR в модулировании воспалительных реакций через высвобождение цитокинов. Поскольку эти клетки мигрируют в места соприкосновения организма с окружающей средой (легкие, кожу и кишечник), локализация клеток, экспрессирующих TLR, является определенным условием защиты от вторгающихся микробов. Факт экспрессии TLR адипоцитами, клетками эпителия кишечника и клетками эндотелия дермы поддерживает представление о том, что TLR играют сторожевую роль в отношении вторгающихся микроорганизмов. Регулировка TLR является важнейшим моментом для осуществления их защитной роли в организме, однако пока идентифицировано мало факторов, модулирующих этот процесс. ИЛ-4 тормозит экспрессию TLR32. Отсюда вытекает предположение, что Т2-хелперные реакции адаптивного иммунитета могут ингибировать активацию TLR.
- Рекомендуем далее ознакомиться со статьей "TOLL подобные рецпторы (TLR) кожи"
Оглавление темы "Иммунитет кожи.":- Болезни волос и кожи при цветной коже
- Рак кожи при цветной коже
- Советы по косметологическим процедурам при цветной коже
- Врожденный и адаптивный иммунитет кожи
- Молекулы врожденной иммунной системы кожи
- TOLL подобные рецпторы (TLR) кожи
- Клетки врожденной иммунной системы кожи
- Лимфоциты адаптивного иммунного ответа кожи
- Наивные Т-лимфоциты кожи
- T-хелперы кожи (Th1, Th2 лимфоциты кожи)

