Генетика в патогенезе псориаза
а) HLA-Cw6 при псориазе. Как показали результаты тонкого картирования, определения генетически сцепленного наследования и исследования связей, HLA-C является ключевым генетическим фактором риска развития псориаза. Поскольку он представляет антигены CD8+ Т-лимфоцитам, HLA-Cw6 — отличный кандидат на то, чтобы играть эту функцию.
Давно известно, что триггером развития псориаза может быть стрептококковый фарингит, и только для этой инфекции была в проспективном исследовании на когорте пациентов подтверждена способность запускать развитие псориаза.
Поскольку Т-клетки миндалин являются CLA-позитивными (содержат кожный лимфоцитарный антиген) и распознают активированные клетки эндотелия кожи, они могут проникать в кожу, что объясняет факт выявления одних и тех же CLA-позитивных клонов Т-лимфоцитов в миндалинах и псориатических очагах. CD8+ Т-лимфоциты составляют не менее 80% от общего числа Т-клеток эпидермиса в псориатическом очаге, и их проникновение в эпидермис соответствует степени прогрессированию очага.
CD8+ Т-клетки селективно транспортируются в эпидермис, поскольку они вырабатывают интегрин α1β1 (также известный как VLA-1), который связывается с коллагеном IV типа в составе базальной мембраны, а также интегрином αЕβ7, который связывается с Е-кадгерином кератиноцитов. Попав в эпидермис, CD8+ Т-лимфоциты «проверяют» пептиды, связанные с HLA-Cw6 на поверхности дендритных АПК и/или кератиноцитов.
При нормальном иммунном ответе CD4+ Т-лимфоциты имеют критическое значение для обработки и представления внутриклеточных вирусных компонентов и опухолевых антигенов в ходе процесса который называется примирование перекрестнореагирующим антигеном» (cross-priming). Хотя CD4+ и CD8+ Т-клетки памяти могут перемещаться между кожей, лимфатическими узлами и кровью, все больше данных свидетельствует о том, что большую часть времени они проводят именно в коже.
Возможно с этим связано характерное распределение псориатических бляшек, которые имеют тенденцию возникать вновь в прежних местах после лечения или спонтанного исчезновения.
Как отмечалось ранее, имеется очень четкая взаимосвязь между HLA-Cw6 и каплевидным псориазом. Эта форма псориаза часто самопроизвольно разрешается, но может прогрессировать в хронический вульгарный псориаз, отличающийся рецидивирующим течением с явлениями воспаления в отсутствие активной стрептококковой инфекции. Переход от каплевидного к хроническому вульгарному псориазу, по-видимому, отражает превращение самоограничивающейся кожной иммунной реакции, вызываемой стрептококками миндалин в каплевидную фазу, в персистирующую неадекватную иммунную реакцию, направленную против белков хозяина в фазу хронического бляшечного поражения.
Механизмы, из-за которых иммунная система перестает нормально отвечать на собственные белки хозяина, остаются не до конца изученными.
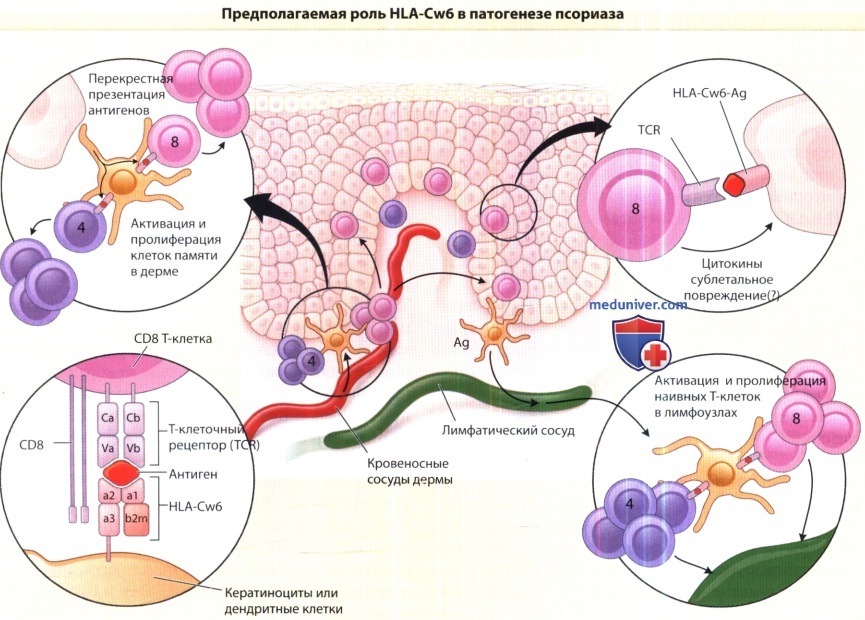
Антиген (Ад) в антиген-связывающем кармане HLA-Cw6 взаимодействует с рецептором Т-клетки. Роль HLA-Cw6 при псориазе, по всей видимости, двоякая.
Молекула HLA-Cw6 обладает способностью к перекрестному представлению пептидов на поверхности дендритных клеток, что обеспечивает активацию и размножение клона антиген-специфических CD8+ Т-клеток.
Этот процесс зависит от участия CD4+ Т-клеток, способствующих перекрестному представлению внутриклеточных антигенов.
Предполагается, что данный процесс происходит и в дерме (активация резидентных Т-клеток памяти), и в региональных лимфатических узлах (активация наивных Т-клеток).
В результате CD8+ Т-клетки приобретают способность мигрировать в эпидермис, где они контактируют с HLA-Cw6 на поверхности кератиноцитов, презентирующих те же самые патогенные пептиды.
Активированные CD8+ Т-клетки способны распознавать пептиды, представленные HLA-Cw6 не поверхности кератиноцитов.
Поскольку эти Т-клетки вырабатывают перфорин, она способны напрямую повреждать кератиноциты по традиционному цитотоксическому механизму.
Актвированные CD8+ Т-клетки могут также запускать местное высвобождение растворимых факторов, включая цитокины, хемокины, эйкозаноиды и/ или медиаторы врожденного иммунитета, которые в свою очередь способны усиливать локальное воспаление и стимулировать пролиферацию кератиноцитов.
В ответ на оба повреждающих воздействия кератиноциты могут выделять аутокринные факторы роста, например фактор роста опухолей-а (TGF-а) и амфирегулин (AREG), поддерживая таким образом собственную пролиферацию и жизнеспособность.
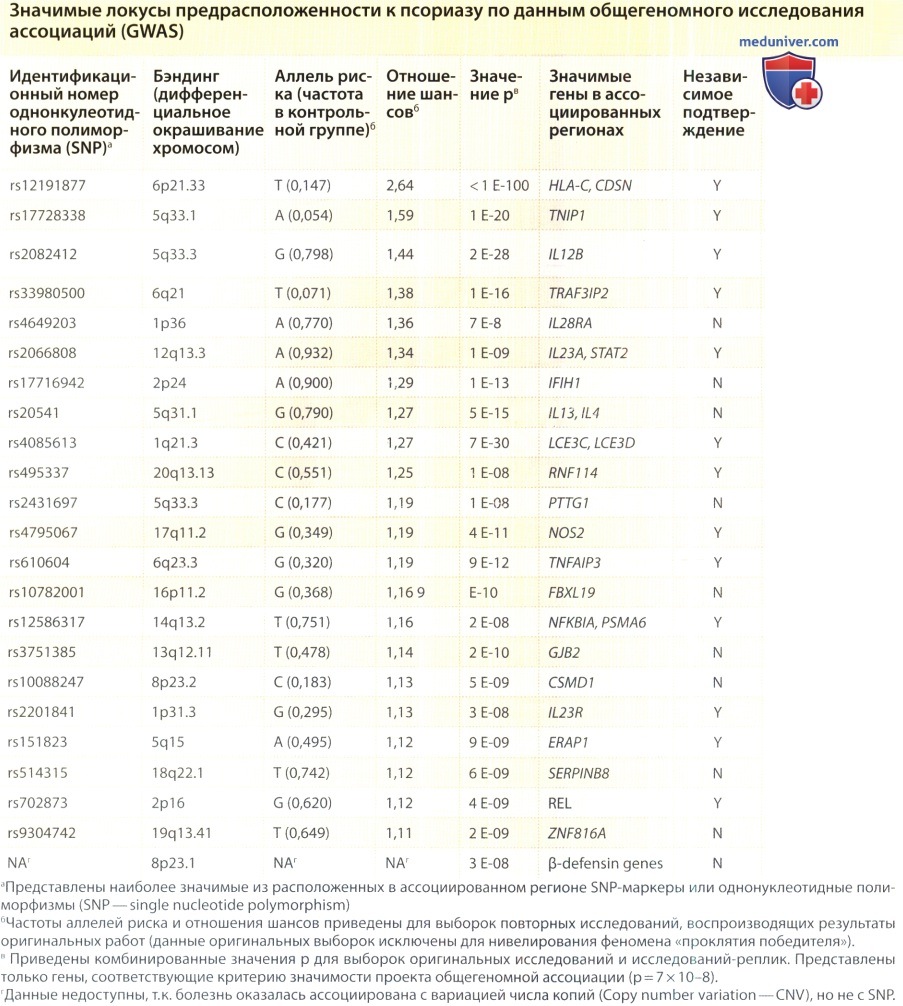
б) Гены, не связанные с МНС при псориазе. Как уже сообщалось ранее, в онлайн-версии книги, с внедрением полногеномного исследования врачи стали выявлять все больше генетических ассоциаций с развитием псориаза, не связанных с МНС. Гены, составляющие участки, для которых показаны эти ассоциации, отлично укладываются в существующие концепции патогенеза псориаза. В пользу этого свидетельствует и то, что биологические агенты, которые обладают специфическим действием на генетически обусловленные механизмы развития болезни, оказывают выраженный эффект при псориазе.
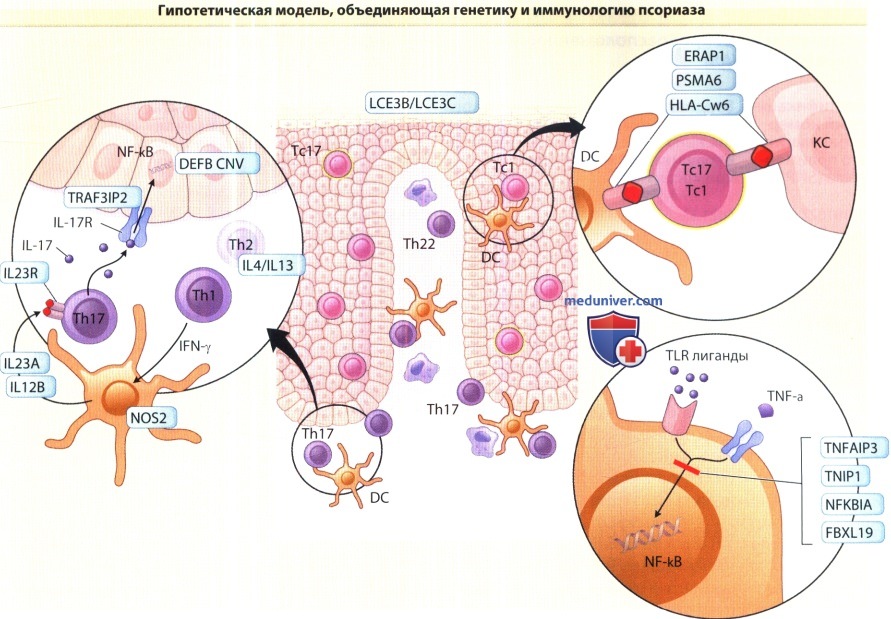
Таким образом, большая часть отличных от МНС связей, выявленных к настоящему времени, относится к четырем взаимосвязанным функциональным системам: (1) сигнальной системе ИФН-у/ИЛ-23/ИЛ-17, (2) сигнальной системе NF-kB, (3) воспалительной функции ДК и (4) дифференцировке кератиноцитов. И хотя фактические генетические вариации, которые лежат в основе этих связей, остаются до конца не изученными, их открытие дает обоснование для анализа этих систем с точки зрения биологии и терапии.
в) Сигнальная система ИФН-у/ИЛ-23/ИЛ-17. Генетическое картирование выявило три участка сильных связей возле генов, вовлеченных в сигнальную систему ИЛ-23: (1) ИЛ 12В (кодирует р40 субъединицу в составе ИЛ-23 и ИЛ-12), (2) ИЛ 23А (кодирует р19 субъединицу в составе ИЛ-23) и (3) ИЛ23R (кодирует субъединицу ИЛ-23 рецептора). В пользу наличия этих связей говорит и впечатляющая эффективность биологических агентов, которые действуют на субъединицу р40, общую для ИЛ-12 и ИЛ-23, а также тот факт, что в псориатических очагах имеет место значительная гиперэкспрессия ИЛ 12В и ИЛ 23А, в то время как для ИЛ 12А это не показано.
ИЛ-23 сигнальная система стимулирует клеточный иммунный ответ благодаря тому, что способствует выживанию и размножению субпопуляции ИЛ-17-экспрессирующих Т-лимфоцитов, которые защищают эпителий от патогенных микроорганизмов. С учетом сходства эпителиальных тканей кожи и кишечника примечательно, что имеется клиническая взаимосвязь между воспалительными заболеваниями кишечника (ВЗК) и псориазом, а также, что одна и та же генетическая вариация в ИЛ23R увеличивает риск обоих заболеваний. Есть и еще одно HLA-класс 1 — ас социированное аутоимунное заболевание, клинически связанное с ВЗК, а генетически — с ИЛ 23R — анкилозирующий спондилит (АС). Псориатический артрит (ПсА) по ряду клинических признаков сходен с АС и генетически связан с ИЛ 12В, ИЛ 23А и ИЛ 23R34.
ИФН-у — главный продукт активированных Тh1-клеток, который стимулирует выработку ИЛ-23ДК. Ряд локусов подверженности псориазу содержит гены, вовлеченные в запуск каскада интерферонов (IFIH1, IL28R и TYK2). Вместе с ИЛ-1, ИЛ-23 стимулирует выживание и пролиферацию ИЛ-17-экспрессирующих Т-клеток (Тh17), что объясняет, почему Тh1 и Тh17 сгруппированы в псориатических очагах и многих других участках воспаления. С учетом хорошо известной реципрокной зависимости между дифференцировкой Тh1 и Th2 примечательно, что другой локус подверженности псориазу содержит гены ИЛ 4 и ИЛ13.
Помимо того, что он смещает дифференцировку Т-лимфоцитов от Th 1 к Th2, ИЛ-4 ингибирует развитие Тh17-клеток. Как ИЛ-4, так и ИЛ-13 вырабатываются в больших количествах при атопическом дерматите, но только в очень небольших при псориазе. Кроме того, применение ИЛ-4 в лечении псориаза привело к значительному клиническому улучшению, которое сопровождалось снижением экспрессии ИЛ-23 (но не ИЛ-12) и уменьшением числа Тh17-клеток.
Тот факт, что имеется выраженное генетическое воздействие с обеих сторон этой системы (ИЛ-23 с одной стороны и ИЛ-4/ИЛ-13 с другой), при этом с вовлечением ИФН-у, позволяет предполагать, что баланс в системе Th1-Th2-Thl7 является важной функциональной и генетической детерминантой псориаза.
Большинство CD8+ Т-клеток (на рис.— сиреневые) расположено в эпидермисе,
тогда как CD4+ Т-клетки (на рис.— синие) наряду с антиген-представляющими (дендритными клетками — DCs),
также окрашенными на рисунке синим цветом, и макрофагами (Mips), окрашенными в голубой, преимущественно локализуются в дерме.
Подтвержденные ассоциативные сигналы показаны с помощью обеспечивающих их вероятных генов-кандидатов.
г) Сигнальная система NF-кВ. По меньшей мере пять ассоциированных с псориазом регионов генома содержат гены, осуществляющие контроль через фактор транскрипции NF-кВ: (1) TNFAIP3, (2) TNIP1, (3) NFKBIA, (4) FBXL19 и (5) TRAF3IP2. ФНО-а — главный активатор сигнальной системы NF-кВ, и эта связь находит клиническое подтверждение в чрезвычайно сильном клиническом ответе пациентов с псориазом на блокаторы ФНО. TNFAIP3 и TNIP1, кодирующие соответственно А20 и AB1N-1, взаимодействуют друг с другом с целью регуляции убиквитин-опосредованного разрушения IKKγ/NEMO, центрального участка сигнальной системы NF-кВ.
TN-FAIP3 генетически связан с ревматоидным артритом (РА), а кроме того, TNFAIP3 и TNIP1 ассоциируются с системной красной волчанкой (СКВ). Генетические полиморфизмы при РА и СКВ никак не ассоциируются с псориазом, что указывает на то, что за развитие каждого из этих сходных аутоиммунных заболеваний отвечают различные варианты гена TNFAIP3. Интересно, что у мышей TNFAIP3 ассоциируется с развитием атеросклероза, который, как известно, является основным сопутствующим заболеванием при псориазе. NFKBIA кодирует IкВа, который ингибирует сигнальную систему NF-кВ путем отделения ее в цитоплазме. FBXL19 и TRAF3IP2 значительно более тесно связаны с ПсА, чем с изолированным кожным псориазом. FBXL19 по своей структуре схож с FBXL11, белком из группы F-box, для которого недавно была показана способность ингибировать активность NF-kB путем деметилирования лизина.
FBXL11 содержит домены, которые требуются для активности деметилаз, а для FBLX19 этого не описано. Поэтому FBXL19 может играть роль доминантного ингибитора активости деметилаз, способствуя тем самым активации NF-kB. TRAF3IP2 кодирует Act1, убиквитинлигазу, которая взаимодействует с TRAF (tumor necrosis factor receptor-associated factors—ФНО-рецептор—ассоциированными факторами) белками и комплексом IKK с целью активации NF-kB. Что интересно, Actl является ключевым компонентом ИЛ-17-опосредованной сигнальной системы, что делает возможным внедрение TRAF6 в сигнальный комплекс рецептора ИЛ-17 с последующей активацией NF-kB. Таким образом, Act1 может служить ключевым передаточным звеном между системой ИФН-у/11-23/1Ь-17 и системой NF-kB.
д) Функция воспалительных ДК. Помимо того, что описанный выше HLA-Cw6 выполняет главную роль, следует отметить, что два других локуса содержат гены, кодирующие вещества, участвующие в презентации антигенов: (1) PSMA6, который кодирует протеосомную субъединицу, участвующую в процессинге антигена МНС класса I, и (2) ERAP1, ИФН-у-индуцируемую аминопептидазу, которая отщепляет фрагменты белка для лучшего связывания с пептидами, образующими складку, в составе МНС класса I. Как было указано выше, воспалительные ДК не только представляют антигены, но и производят большие количества ФНО-а и оксида азота. Поэтому представляется неслучайным, что другой новый локус ассоциации содержит NOS2, который кодирует iNOS, фермент, ответственный за продукцию оксида азота дендритными клетками.
Как результат значительного увеличения числа воспалительных дендритных клеток в составе дермы, характерного для псориатических очагов, отмечается значительная гиперэкспрессия NOS2 в составе очагов. В дополнение к iNOS, эти воспалительные ДК вырабатывают много ФНО-а, который взаимно усиливает действие ИЛ-17, направленное на стимуляцию экспрессии медиаторов врожденного иммунного ответа, таких как hBD2, вырабатываемого кератиноцитами.
е) Дифференцировка кератиноцитов. Учитывая важное значение гиперпролиферации и изменения дифференцировки кератиноцитов в патофизиологии псориаза может показаться удивительным, что в относительно небольшом числе псориаз-ассоциированных участков представлены гены, действующие главным образом на кератиноциты. Лучше всего описан полиморфизм по типу инсерции-делеции для генов позднего ответа LCE3B и LCE3C, кодирующих роговой конверт, которые были независимо обнаружены в европейской и китайской популяциях.
Эти гены локализуются в эпидермальном комплексе дифференцировки и экспрессируются на очень позднем этапе терминальной дифференцировки кератиноцитов. Они вырабатываются в больших количествах при псориазе, заживлении ран и эпидермальном стрессе. Сообщалось также о такой генетической ассоциации с участием кератиноцитов, как увеличение числа копий DEFB4. Независимо от того, будет ли подтвержден этот факт, примечательно, что DEFB4 — один из наиболее гиперэкспрессированных генов в псориатическом очаге. Известно, что TRAF3IP2 работает в клетках эпидермиса, поскольку «нокдаун» TRAF3IP2 под действием короткой шпилечной РНК прекращает ФНО-а и ИЛ-17-опосредованную стимуляцию DEFB4 в кератиноцитах человека.
- Рекомендуем далее ознакомиться со статьей "Клиника и алгоритм диагностики псориаза"
Оглавление темы "Псориаз.":- У кого возникает псориаз? Эпидемиология
- Механизмы развития очагов псориаза. Патогенез
- Клетки участвующие в патогенезе псориаза
- Сигнальные молекулы в патогенезе псориаза
- Генетика в патогенезе псориаза
- Клиника и алгоритм диагностики псориаза
- Все болезни с которыми необходимо дифференцировать псориаз списком
- Осложнения псориаза у пациентов
- Прогноз и течение псориаза

