Факторы роста опухоли и их характеристика
а) Факторы роста. Для пролиферации всем нормальным клеткам нужна стимуляция факторами роста. Большинство растворимых факторов роста синтезируются одним типом клеток и воздействуют на соседние клетки, что индуцирует их пролиферацию (паракринный механизм).
Многие опухолевые клетки способны синтезировать те факторы роста, к которым они чувствительны (аутокринный механизм). Например, многие глиобластомы секретируют PDGF и одновременно экспрессируют рецептор PDGF. Значительное количество сарком синтезируют TGF-a и его рецептор. Считается, что аутокринные петли являются важнейшим элементом патогенеза ряда опухолей.
Однако в большинстве случаев гены факторов роста не подвергаются изменениям и не мутированы. Наиболее часто продукты онкогенов, участвующих в передаче сигналов во многих сигнальных путях, например RAS, вызывают повышение экспрессии генов, кодирующих факторы роста, в результате клетка секретирует большие количества факторов роста, например TGF-a.
Тем не менее увеличенное количество факторов роста не является достаточным условием для опухолевой трансформации. По всей вероятности, усиление пролиферации под действием факторов роста вносит свой вклад в развитие злокачественного фенотипа путем увеличения риска спонтанных или индуцированных мутаций в пуле пролиферирующих клеток.
б) Рецепторы факторов роста. Обнаружен ряд онкогенов, кодирующих образование рецепторов факторов роста. Для того чтобы понять, каким образом мутации влияют на функционирование этих рецепторов, следует напомнить, что рецепторы одного из важнейших классов являются трансмембранными белками, имеющими цитоплазматический тирозинкиназный домен и наружный лигандсвязывающий домен.
При взаимодействии неизмененных рецепторов со специфическими факторами роста происходит временная активация киназного домена, за которой следуют димеризация рецептора и фосфорилирование тирозина ряда субстратов, входящих в каскад сигналов. Рецепторы онкогенного происхождения находятся в состоянии постоянной димеризации и активации без необходимости связывания с фактором роста.
Таким образом, мутантные рецепторы постоянно посылают сигнал клетке в отсутствие фактора роста в ее окружении.
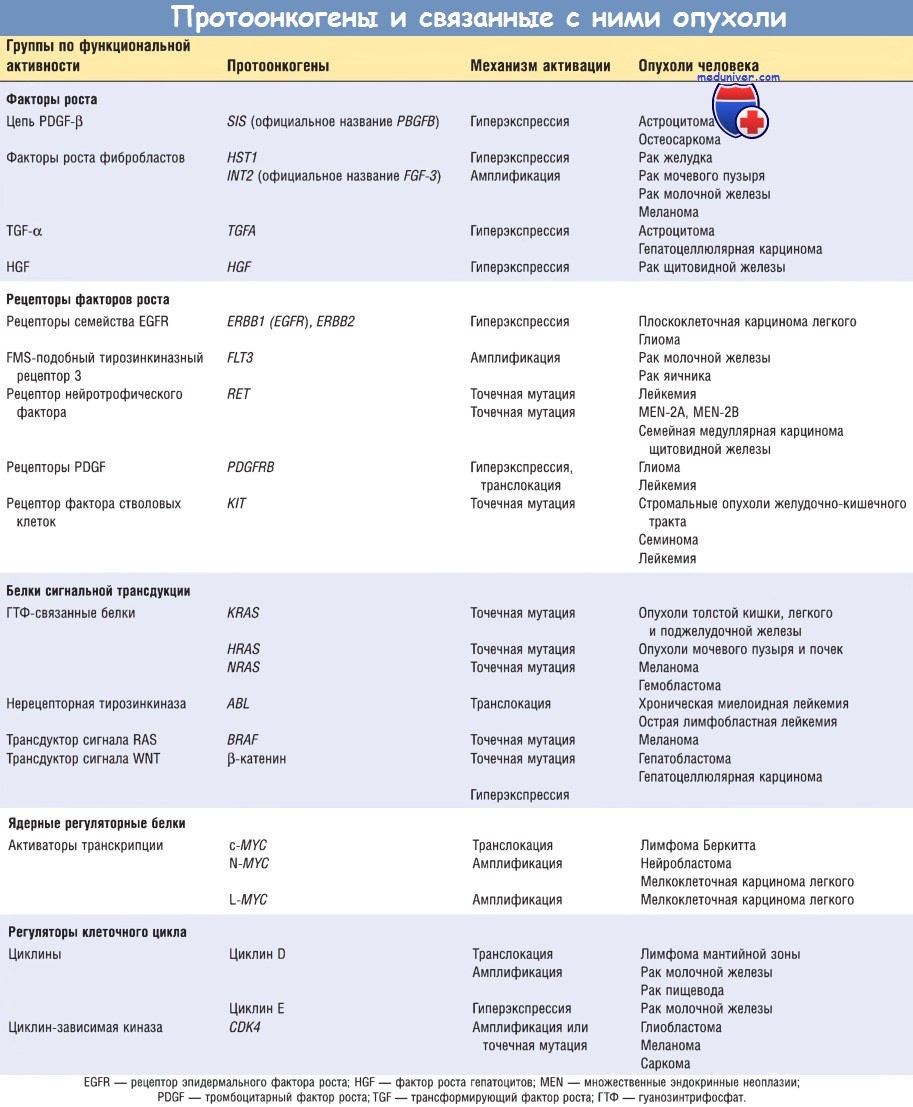
Рецепторы факторов роста в опухоли могут активироваться по нескольким механизмам, включая мутации, перегруппировку генов и повышение экспрессии. Примером онкогенной конверсии в результате мутаций и перегруппировки генов может служить протоонкоген RET, относящийся к рецепторам тирозинкиназного типа.
Белок RET является рецептором нейротрофического фактора, продуцируемого клеточной линией глиальных клеток, и по структуре относится к белкам, поддерживающим жизнеспособность клеток во время развития нервной системы. RET обычно экспрессируется нейроэндокринными клетками — парафолликулярными С-клетками щитовидной железы, мозгового вещества надпочечников и клетками-предшественниками паращитовидной железы.
Точечные мутации протоонкогена RET ассоциируются с доминантными наследственными синдромами MEN-2A и MEN-2B, а также с семейной медуллярной карциномой щитовидной железы. При MEN-2A точечная мутация во внеклеточном домене RET приводит к постоянно совершающимся димеризации и активации рецептора, сопровождающимся развитием медуллярной карциномы щитовидной железы и опухолей надпочечников и паращитовидной железы.
При MEN-2B точечная мутация локализуется в цитоплазматическом каталитическом домене, нарушая субстратную специфичность тирозинкиназы, что сопровождается опухолевым ростом в щитовидной железе и надпочечниках без вовлечения паращитовидной железы. При обоих наследственных синдромах наследуются мутации в RET, развившиеся в герминативных центрах. Спорадическая медуллярная карцинома щитовидной железы развивается с перегруппировкой онкогена RET в соматических клетках, напоминающей таковую при MEN-2B.
Онкогенная конверсия в результате мутации и перегруппировок найдена и в других генах, кодирующих рецепторы факторов роста. Точечная мутация в гене FLT3, кодирующем FMS-подобный тирозинкиназный рецептор 3, формирующий постоянный сигнал, найдена при миелоидной лейкемии.
При хронической миеломоноцитарной лейкемии с транслокацией t(5;12) обнаружено, что цитоплазматический домен рецептора PDGF полностью соединен с сегментом фактора транскрипции из семейства ETS, что обусловливает перманентную димеризацию рецептора PDGF. Более 90% стромальных опухолей ЖКТ имеют активирующую мутацию в рецепторах тирозинкиназы c-KIT или PDGF, которые являются рецепторами для фактора стволовых клеток и PDGF соответственно.
Эти мутации ответственны за специфическое ингибирование тирозинкиназы ингибитором иматиниба мезилатом. Такой тип терапии, направленный на специфическую генетическую поломку в опухолевой клетке, назван таргетной терапией.
Значительно более часто, чем мутации в протоонкогенах, наблюдается повышение экспрессии генов неизмененных рецепторов факторов роста. В ряде опухолей гиперэкспрессия является результатом амплификации гена, однако многие молекулярные механизмы усиленной экспрессии рецепторов еще полностью не изучены. Наиболее хорошо описаны два члена семейства рецепторов EGF. Нормальная форма гена ERBB1 подвергается гиперэкспрессии в 80% случаев плоскоклеточных карцином легкого, более чем в 50% случаев глиобластом и в 80-100% случаев опухолей головы и шеи.
Второй член этого семейства — ERBB2 (называемый также HER2/Neu) амплифицируется в 25% рака молочной железы и в аденокарциномах яичника, легкого, желудка и слюнных желез. На основании характерной гиперэкспрессии ERBB2 в опухолевых клетках разработан новый метод таргетной терапии опухолей с помощью антител к ERBB2, успешно применяемый в клинике.
в) Белки сигнальной трансдукции. Некоторые онкопротеины могут имитировать функции различных нормальных цитоплазматических компонентов внутриклеточной передачи сигнала от рецепторов факторов роста. Большинство белков, участвующих в такой передачи сигнала, связаны с внутренней поверхностью плазматической мембраны, где они получают сигналы извне (от активированных рецепторов факторов роста) и передают их к ядру клетки. С точки зрения биохимического строения белки сигнальной трансдукции гетерогенны. Наиболее хорошо изученным является семейство белков RAS, состоящее из гуанозинтрифосфатсвязывающих белков (G-белков).
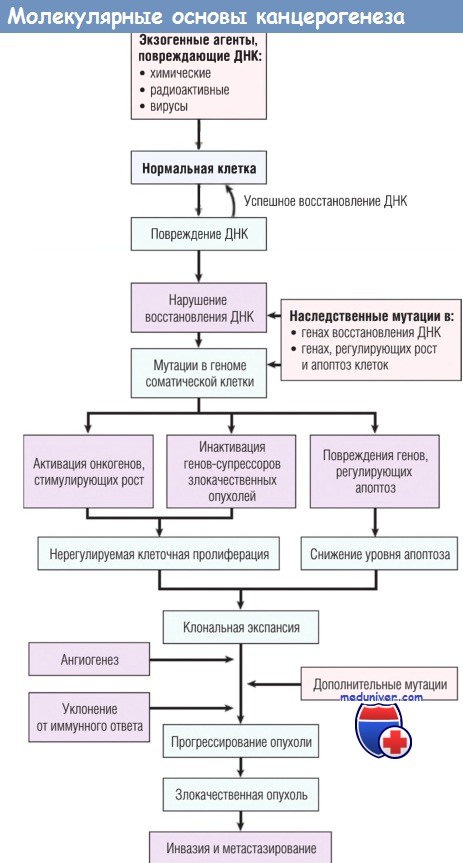
ДНК — дезоксирибонуклеиновая кислота.
- Вернуться в оглавление раздела "Патофизиология"
Оглавление темы "Канцерогенез - патофизиология онкологических заболеваний":- Механизмы и пути метастазирования опухоли
- Как часто встречается рак (злокачественные опухоли)?
- Значение места проживания на риск развития рака
- Влияние возраста на риск развития рака
- Наследственный риск развития рака
- Состояния и болезни приводящие к раку
- Молекулярные механизмы развития опухоли (канцерогенеза)
- Механизмы трансформации клетки в рак (злокачественной трансформации)
- Протоонкогены, онкогены, онкопротеины и их характеристика
- Факторы роста опухоли и их характеристика

