Регуляция пролиферации и гибели клетки - с точки зрения физиологии человека
Оглавление статьи:- Передача сигнала от рецепторов, отвечающих за факторы роста
- Малые G-белки
- Апоптоз и некроз
- Коротко
- Список использованной литературы
а) Передача сигнала от рецепторов, отвечающих за факторы роста.
P.S. Фермент тирозинкиназа проводит сигналы, поступающие от факторов роста.
1. Активация тирозинкиназ. Соединение лиганда с рецептором, отвечающим за фактор роста, например эпидермальным фактором роста (epidermal growth factor, EGF), с EGF-рецептором или антигеном с рецептором Т-клетки, приводит к первичной активации тирозинкиназ (рис. 1).
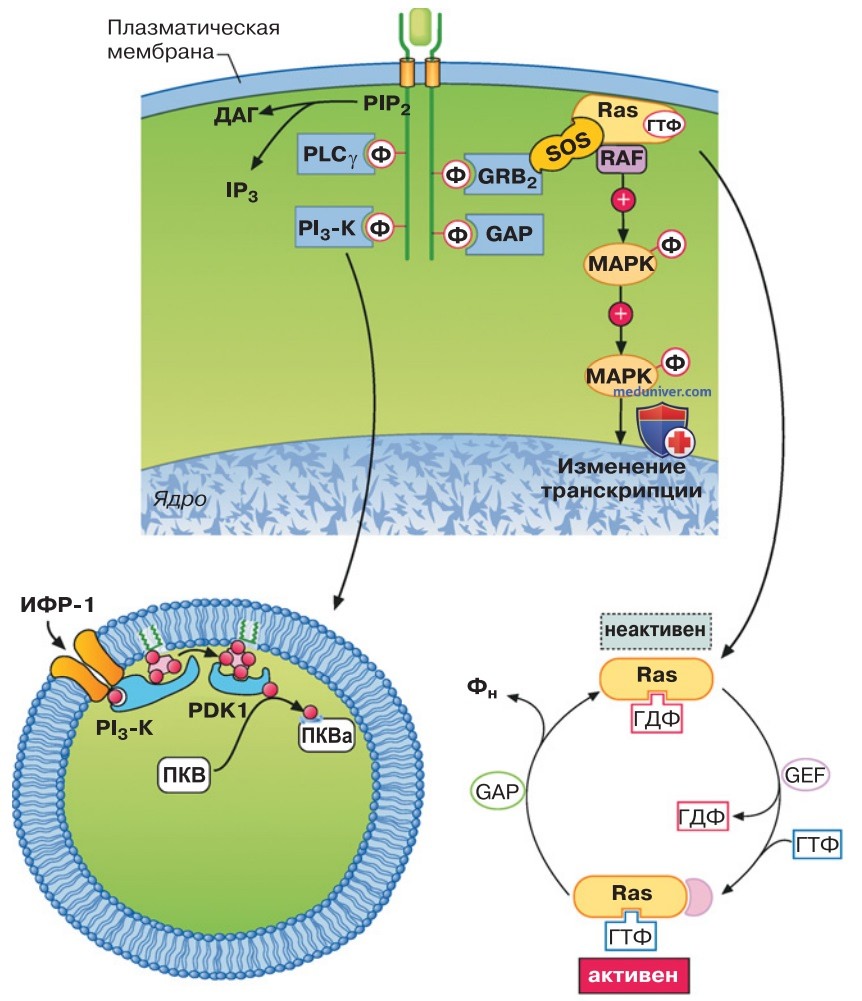
В случае с EGF-рецептором это вызывает фосфорилирование самого рецептора (аутофосфорилирование), в случае с рецептором Т-клетки — фосфорилирование белков, взаимодействующих с рецептором. Оба принципа касаются почти всех рецепторов, отвечающих за факторы транскрипции. Инсулин тоже действует под влиянием тирозинкиназ. Фосфорилирование тирозина прекращается при участии тирозинфосфатазы.
2. Образование полипротеиновых соединений при участии адаптерных белков. Фосфорилированный в рецепторе остаток тирозина или связующие белки служат местом соединения цитозольных белков, способных взаимодействовать только с активированным комплексом рецепторов. К таким белкам относятся в первую очередь адаптерные белки, например Grb-2-белок (рис. 1).
3. Распространение сигнала. Связующие адаптерные белки присоединяют к рецепторному комплексу другие молекулы, благодаря чему усиливается сигнал, возникший при слиянии с лигандом. Путем селективного присоединения и группировки определенных «сигнальных модулей» из некоторых последовательностей сигналов можно получить целый ряд внутриклеточных функций.
Если, например, соответствующий адаптерный белок присоединяет сигнальные молекулы, активирующие сигнальный путь А + С + Е, то возникает сигнал, отличный от того, который образуется, если присоединяются сигнальные молекулы, стимулирующие сигнальные пути А + В + D.
P.S. Малые G-белки регулируют пролиферацию клетки, ее дифференцировку и гибель путем активации киназных каскадов и воздействия на цитоскелет.
1. Активация. Малые G-белки, имеющие молекулярную массу, равную 20-30 кДа, будучи гетеротримерными G-белками, в неактивном состоянии соединяются с ГДФ. При обмене ГДФ на ГТФ малые G-белки активируются (рис. 1). Активация малых G-белков происходит за счет факторов обмена гуаниловых нуклеотидов. Они отделяют ГДФ от малого G-белка, благодаря чему осуществляется присоединение ГДФ, в значительно большей концентрации содержащегося в клетке, чем ГТФ. К наиболее известным факторам обмена относится SOS-белок. Инактивация малых G-белков происходит в результате гидролиза связанного ГТФ (рис. 1).
2. Белок Ras. Самый известный малый G-белок — белок Ras (рис. 1). Он активируется с помощью SOS-белка и среди прочего регулирует пролиферацию клетки. С помощью Raf-киназ Ras приводит в активное состояние МАР-киназы (митоген-активируемые протеинкиназы), которые регулируют синтез новых протеинов или контролируют цитоскелет (рис. 1).
3. Фосфатидилинозитол-3-киназа. Далее Ras активирует фосфатидилинозитол-3-киназу (PI3-К). PI3-К вырабатывает в мембране «заякоренный» фосфатидилинозитол-(3,4,5)-трифосфат, к которому могут присоединяться протеинкиназа В и фосфатидилинозитолзависимая киназа PDK (рис. 1). Таким образом осуществляется взаимодействие обеих киназ, а PDK может фосфорилировать ПКВ и тем самым активировать ее.
Путем фосфорилирования ПКВ активирует NQ-синтазу и благодаря этому может регулировать ширину сосудов. В то же время, ПКВ затормаживает киназу 3 гликогенсинтазы GSK3 и тем самым оказывает влияние на обмен веществ. В результате ПКВ фосфорилирует и инактивирует Bad — белок, способный вызвать апоптоз (см. ниже).
4. Активация других малых G-белков. Наконец, Ras участвует в регуляции других малых G-белков (рис. 1), особенно малых G-белков Rac и Rho. Среди прочего Rac и Rho регулируют цитоскелет и стресс-активируемые киназы, которые передают сигнал через фактор транскрипции АР-1 в ядро. Транскрипция генов и синтез новых белков позволяют клетке реагировать на измененные внеклеточные условия.
P.S. Онкогены. Онкогены — это внедренные в клетки хозяина гены вируса либо измененные в результате мутации клеточные гены, которые повышают пролиферацию клетки или препятствуют апоптозу клетки. Часто они обнаруживаются в опухолевых клетках, развитию которых способствуют. К продуктам онкогенов, в частности, относятся рецепторы тирозинкиназ v-Erb, цитозольные киназы Src и Raf, факторы транскрипции Myc, Jun, Fos и Myb, малый G-белок Ras и антиапоптозный протеин Bcl-2.
Обнаруженные мутации Ras сопровождаются активацией Ras путем задержки отсоединения фосфатной группы от ГТФ и последующей инактивации G-белка.
P.S. При апоптозе активируется внутриклеточная сигнальная программа, приводящая к смерти клетки.
1. Значение апоптоза. В нашем организме благодаря пролиферации постоянно образуются новые клетки, а в процессе апоптоза они удаляются. Посредством пролиферации клетки и апоптоза происходит регуляция количества клеток и приспособление их к функциональным требованиям. Кроме того, количество поврежденных, инфицированных внутриклеточными возбудителями или неконтролируемо размножающихся клеток может уменьшаться в результате апоптоза. Апоптозом называют самоубийство клетки, происходящее в соответствии с определенной программой.
2. Признаки апоптоза. При апоптозе происходят типичные изменения клетки, в частности сжатие ее, фрагментация ДНК, конденсация ядерного хроматина, фрагментация ядра и блокада частей клетки (апоптических телец). При высокой внутриклеточной концентрации Са2+ в клеточной мембране накапливается фосфатидилсерин. На поверхности апоптических клеток фосфатидилсерин соединяется с рецепторами макрофагов, которые фагоцитируют апоптические клетки, а затем разрушают их внутриклеточно. При этом происходит блокада высвобождения внутриклеточных белков, которое иначе могло бы привести к воспалению.
3. Стимулы апоптоза. Апоптоз может быть вызван как рецепторами, например CD95 или рецептором фактора некроза опухоли, так и внешним стрессовым раздражителем, таким как ионизирующие лучи, ультрафиолет, высокая температура или цитостатики (рис. 2).
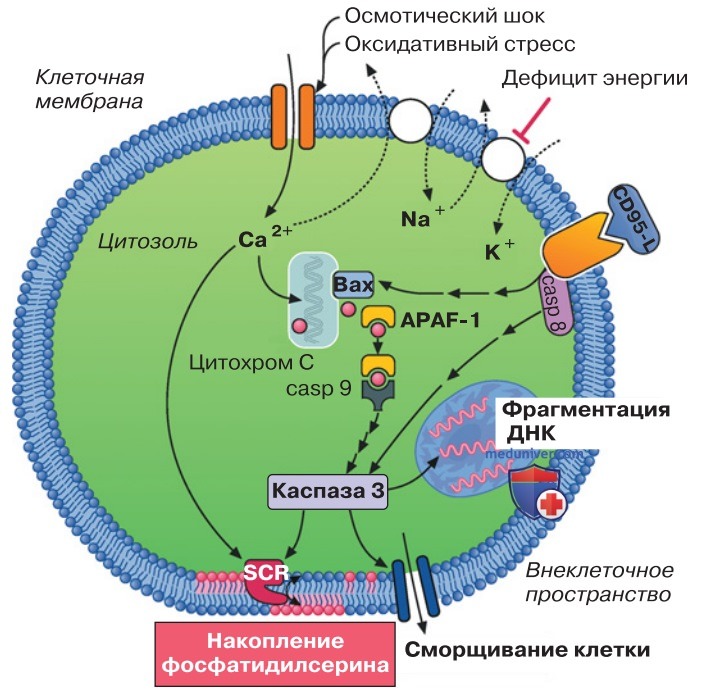
4. Каспазы. Апоптоз возникает в результате активации внутриклеточных протеаз семейства каспаз. Каспазы расщепляют белки между аминокислотами цистеином и аспартатом. Вышеназванные рецепторы или стимулы активируют каспазу 3, фермент, отвечающий за осуществление апоптоза, с помощью различных промежуточных ферментов. Каспаза 3 прямо или косвенно осуществляет расщепление многих клеточных белков, фрагментацию ядерных ДНК, изменения цитоскелета и распад клетки.
5. Митохондрии. Многие проапоптотические стрессовые раздражители действуют в клетке с помощью так называемых Bcl-2-подобных белков, в основном Вах, Bad и Bid, которые передают апоптический сигнал митохондриям (рис. 2). Действие протеинов замедляется белком Bcl-2. Взаимодействие этих белков с митохондриями приводит к деполяризации митохондрий и высвобождению цитохрома С. Цитохром С связывается с адаптерным белком (APAF-1), этот комплекс соединяется с каспазой 9, которая тем самым активируется и индуцирует апоптоз.
6. Некроз. Механические, химические и термические повреждения клетки могут снизить целостность клеточной мембраны, в результате чего электролиты и вода проникают внутрь и клетка лопается. В таких случаях принято говорить о некротической смерти клетки.
При недостатке энергии (например, недостаточном кровоснабжении) градиенты потенциала в электролитах больше не могут передаваться через клеточную мембрану и клетка умирает от некроза.
В отличие от апоптоза при некрозе внутриклеточные белки освобождаются, что приводит к возникновению воспалительной реакции. Иногда при повреждении или недостатке энергии, вызывая апоптоз, клетка стремится избежать некроза.
1. Регуляция пролиферации клетки. Соединение лиганда и рецептора фактора роста вызывает активацию тирозинкиназ. Те в свою очередь приводят либо к фосфорилированию самого рецептора (аутофосфорилирование), либо к фосфорилированию белков, которые затем связываются с рецептором.
Фосфорилированный остаток тирозина служит для соединения с адаптерными белками, возникающими при участии мультиферментных комплексов. Сигнал передается в клетку через киназы, малые G-белки и другие сигнальные молекулы.
2. Малые G-белки. Эти белки активируются в результате обмена ГДФ на ГТФ и инактивируются в процессе гидролиза ГТФ. Они регулируют сигнальные пути, которые приводят к пролиферации и дифференциации клетки. Самым известным малым G-белком является белок Ras. За образование и рост опухолей отвечают активные мутагены Ras.
3. Регуляция гибели клетки. Проапоптические стимулы вызывают апоптоз посредством:
• активации внутриклеточных протеаз, особенно каспаз, и распада клеточных структур;
• изменений в митохондриях;
• сжатия клетки;
• накопления фосфатидилсерина в клеточной мембране.
Апоптоз служит физиологическому обмену между клетками и тканями, без высвобождения внутриклеточных белков и без возникновения воспаления. При некрозе, напротив, возникает набухание клетки, происходит высвобождение клеточных белков и воспаление.
- Рекомендуем ознакомиться далее "Эйкозаноиды - с точки зрения физиологии человека"
Редактор: Искандер Милевски. Дата публикации: 20.8.2024

