Причины и механизм развития пузырчатки
- Выделяют два основных типа пузырчатки: вульгарную пузырчатку и листовидную пузырчатку.
- Вульгарная пузырчатка: эрозии на слизистых оболочках и коже; вялые пузыри на коже.
- Листовидная пузырчатка: кожные очаги с чешуйками и корками.
- Диагноз зависит от результатов гистологии (интраэпидермальный акантолиз) и иммунофлуорисцентного исследования (аутоантитела на поверхности клеток как в коже, так и в крови).
- Вульгарная пузырчатка: супрабазальный акантолиз.
- Листовидная пузырчатка: субкорнеальный акантолиз.
- При прямой иммунофлюоресценции на поверхности кератиноцитов определяется присутствие иммуноглобулина G (IgG); непрямая иммунофлюоресценция выявляет в сыворотке IgG, связывающийся с клеточной поверхностью нормальных кератиноцитов.
- Аутоантигенами являются десмоглеины — трансмембранные молекулы десмосомальной адгезии.
- В лечении используются местные и системные кортикостероиды и иммуносупрессивные препараты.
Пузырчатка, или пемфигус (pemphigus), относится к группе аутоиммунных пузырных заболеваний кожи и слизистых оболочек, гистологической характеристикой которых являются эпидермальные пузыри, обусловленные акантолизом (т.е. отделением эпидермальных клеток друг от друга), а иммунологическим признаком — связанный in vivo циркулирующий иммуноглобулин G (IgG), направленный против клеточной поверхности кератиноцитов. Нозология пузырчатки приведена в отдельном блоке ниже. Выделяют четыре основных типа заболевания: (1) вульгарная, (2) листовидная, (3) паранеопластическая, а также (4) IgA-пузырчатка.
При вульгарной пузырчатке пузыри развиваются в более глубоком участке эпидермиса—непосредственно над базальным слоем, а при листовидной пузырчатке, также известной как поверхностная пузырчатка, пораженным оказывается зернистый слой.
История открытия пузырчатки и ее разновидностей изложена в классической монографии Левера «Pemphigus and Pemphigoid». Как вульгарная, так и листовидная пузырчатка могут проявляться разнообразными патологическими изменениями, которым соответствуют различные наименования. Однако поскольку проявления пузырчатки носят крайне вариативный характер, развитие заболевания в отдельных случаях часто не соответствует принятым условным обозначениям. Так, одна из форм локализованной вульгарной пузырчатки называется вегетирующей пузырчаткой Аллопо (Hallopeau). Однако если у пациентов с данной разновидностью заболевания поражение начинает принимать чуть более распространенный характер, возникает клиническая картина вегетирующей пузырчатки Нойманна (Neumann).
При наиболее тяжелом течении развивается полная форма вульгарной пузырчатки. Аналогичным образом у пациентов с листовидной пузырчаткой может наблюдаться более локализованная форма заболевания в виде эритематозной пузырчатки. Однако в этих случаях болезнь часто трансформируется в более распространенный вариант листовидной пузырчатки. В 1964 г. Beutner и Jordon выявили в сыворотке пациентов с вульгарной пузырчаткой циркулирующие аутоантитела против клеточной поверхности кератиноцитов. Данное открытие явилось первым шагом на пути понимания природы вульгарной пузырчатки как тканеспецифического аутоиммунного заболевания кожи и слизистых.


а) Заболеваемость и распространенность пузырчатки. Результаты ряда перспективных и ретроспективных исследований среди пациентов с пузырчаткой, указывают на то, что эпидемиология пузырчатки зависит как от конкретного географического региона, так и от этнической принадлежности проживающего в данном регионе населения. Вульгарная пузырчатка наиболее часто встречается у евреев и выходцев из стран Средиземноморья и Ближнего Востока. Подобной этнической предрасположенности не наблюдается в случае листовидной пузырчатки, в связи с чем заболеваемость вульгарной пузырчаткой в указанных регионах более высока. Так, в Нью-Йорке, Лос-Анджелесе и Хорватии соотношение случаев вульгарной и листовидной пузырчатки составляет примерно 5:1, а в Иране— 12:1; при этом в Финляндии данный коэффициент равен 0,5:1.
Подобным образом заболеваемость пузырчаткой зависит и от географического региона. В Иерусалиме заболеваемость вульгарной пузырчаткой оценивается как 1,6 случая на 100000 человек в год, в Иране данный показатель составляет примерно 10 случаев на 100000 человек. В других странах Европы заболеваемость ниже и составляет от 0, 7 случая вульгарной пузырчатки на 100000 человек в год в Великобритании до 0,5-1,0 случая на 1 млн человек в год в Финляндии, Франции, Германии и Швейцарии, то есть еще в десять раз меньше.
Распространенность листовидной пузырчатки и соответствующий ей коэффициент заболеваемости в значительной степени зависят от географического региона, что становится очевидным на примере бразильской пузырчатки, а также некоторых других форм эндемичной листовидной пузырчатки, встречающихся в Колумбии и Тунисе.
Впервые эндемическая листовидная пузырчатка была выявлена в Бразилии. В переводе с португальского название заболевания (fogo selvagem) означает «дикий огонь». Его клинические, гистологические и иммунологические признаки аналогичны спорадической листовидной пузырчатке, однако эпидемиология болезни является уникальной. Бразильская пузырчатка—эндемическое заболевание сельских районов Бразилии, наиболее часто встречающееся среди населения, проживающего по берегам рек. Географическая распространенность бразильской пузырчатки совпадает с территорией обитания черной мухи (Simulium nigrimanum), которую местные жители считают переносчиком болезни. Исследования потенциальных внешних факторов риска показали, что случаи укуса черной мухи чаще присутствовали у больных бразильской пузырчаткой, чем у контрольной группы лиц аналогичного возраста, пола и профессии, страдающих другими, не родственными пузырчатке дерматозами. В некоторых индейских резервациях распространенность бразильской пузырчатки составляет 3,4%, а заболеваемость достигает от 0,8 до 4 случаев на 1000 человек в год.
У 55% здоровых лиц в резервации Лимао Верде был выявлен низкий уровень антител IgG1 в качестве ответа на аутоантиген листовидной пузырчатки десмоглеин-1 (см. «Антигены пузырчатки»). При этом у лиц с заболеванием более патогенный эпитоп инициировал ответ IgG4 более высокого титра. Приведенные данные указывают на то, что некий внешний фактор (например, укус насекомого или другой инфекционный патоген) способен вызывать слабый ответ аутоантител, который становится более мощным при внутримолекулярном распространении эпитопа у генетически восприимчивых индивидуумов. Принимая во внимание данную теорию, интересно отметить, что у 40-80% бразильцев с заболеваниями, вызванными укусами насекомых (он-хоцеркоз, лейшманиоз и болезнь Чагаса), определяется наличие небольших концентраций антител к десмогле-ину-1, при том что у пациентов из Бразилии с другими инфекционными заболеваниями подобные антитела выявляются редко.
Бразильская пузырчатка чаще встречается у детей и молодых людей, в отличие от спорадической листовидной пузырчатки, которая регистрируется преимущественно у лиц среднего и старшего возраста. Кроме того, в отличие от спорадической листовидной пузырчатки, бразильская пузырчатка нередко наблюдается у лиц, находящихся в кровном родстве, хотя заболевание не является контагиозным. Данный факт, вероятно, свидетельствует о наличии общего провоцирующего фактора, а также о возможности генетической восприимчивости. Данные о расовой или этнической предрасположенности к бразильской пузырчатке отсутствуют; любой индивидуум, попадающий в эндемический район, может оказаться подверженным этому заболеванию. Наличие провоцирующих факторов в окружающей среде подтверждается тем фактом, что социально-экономическое развитие в сельских районах Бразилии с эндемической пузырчаткой привело к уменьшению частоты заболевания. Данное заболевание, вне всяких сомнений, способно приблизить исследователей к пониманию того, каким образом приводится в действие аутоиммунный ответ.
Соотношение полов. Соотношение полов при заболевании пузырчаткой трудно оценить точно в связи с общей низкой заболеваемостью. Более крупные эпидемиологические исследования (с оценкой более 100 случаев) показали, что женщины среди больных пузырчаткой преобладают над мужчинами в соотношении 1,33 или 2,25 к 1. Заметными исключениями являются значительное преобладание женщин (4:1) в эндемическом очаге листовидной пузырчатки в Тунисе и преобладание мужчин (19:1) в эндемическом очаге листовидной пузырчатки в Колумбии.
Возраст начала пузырчатки у пациентов. Средний возраст начала заболевания также варьирует в зависимости от региона. В Турции, Саудовской Аравии, Тунисе и Иране, средний возраст начала болезни составляет примерно 40 лет. Исследования в Соединенных Штатах и странах Европы указывают на средний возраст начала заболевания между 50 и 70 годами. За исключением эндемических регионов, пузырчатка редко развивается у детей.
б) Этиология и патогенез пузырчатки. Установление того факта, что пузырчатка является органоспецифичной, опосредованной аутоантителами патологией десмосом, является иллюстрацией интеграции клинической медицины и фундаментальных исследований. Развитие методов световой и электронной микроскопии позволило дерматологам изучить морфологию и иммунопатологию заболевания. Сывороточные IgG-антитела больных стали ключевым методом определения антигенов как при листовидной, так и при вульгарной пузырчатке. Клонирование и типирование антигенов привело к последующему развитию иммуноферментных методов диагностики (ИФА), что позволило повысить чувствительность и специфичность диагностики заболевания. Продолжающиеся патофизиологические исследования пузырчатки имеют целью разработку более безопасных и эффективных методов терапии этого потенциально смертельного заболевания.
1. Аутоантигены при пузырчатке. Антигенами при пузырчатке являются десмоглеины — трансмембранные гликопротеины десмосом. Десмоглеины являются представителями суперсемейства кадгеринов, относящихся к кальций-зависимым молекулам клеточной адгезии. Типичные представители этого семейства (например, Е-кадгерин) обнаруживают гомофильные адгезивные свойства (т.е. связываются с подобными им молекулами). Аналогичным образом десмоглеины обнаруживают гомофильные свойства, однако также могут участвовать в гетерофильной адгезии, связываясь с десмоколлинами, еще одной важной группой трансмембранных гликопротеинов десмосом. Антигеном при листовидной пузырчатке (как и при эндемичной форме пузырчатки fogo selvagem) является десмоглеин 1, белок массой 160 кДа. При вульгарной пузырчатке аутоантигеном является десмоглеин 3 (белок массой 130 кДа на 64% сопоставимый и на 46% идентичный по последовательности аминокислот де-смоглеину 1). У всех пациентов с вульгарной пузырчаткой обнаруживаются антитела к десмоглеину 3, а у некоторых из них—антитела к десмоглеину I.
У больных с преобладающим поражением слизистых определяются антитела только к десмоглеину 3, тогда как при кожно-слизистой форме болезни обычно определяются как антитела к десмоглеину 3, так и к антидесмоглеину 1. При листовидной пузырчатке в типичных случаях наблюдаются антитела только к десмоглеину 1. Существует ряд свидетельств того, что антитела к десмоглеину-1 и -3 при пузырчатке непосредственно вызывают формирование пузырей, а поэтому могут рассматриваться в качестве этиологических факторов заболевания. Пассивный перенос IgG-антител от больных вульгарной или листовидной пузырчаткой новорожденным мышам или введение в препараты человеческой кожи приводит к образованию пузырей, которые клинически и гистологически идентичны таковым при соответствующих формах пузырчатки больных.
Антитела к десмоглеинам ответственны за образование пузырей в моделях пассивного переноса, поскольку очищенные антитела к десмоглеинам 1 и 3 вызывают пузыри, характерные для листовидной и вульгарной пузырчатки, соответственно, а абсорбция таких антител приводит к обратному развитию проявлений болезни. Сходные «эксперименты» по пассивной передаче антител описаны и на людях, когда матери даже с легкой вульгарной пузырчаткой передавали IgG-аутоантитела плодам, что приводило к образованию пузырей в ротовой полости и на коже, которые разрешались приблизительно к шестимесячному возрасту по мере элиминации материнских IgG-антител из организма ребенка. Мишенью некоторых антител при пузырчатке также является десмоглеин 4, экспрессирующийся в корковом веществе волос и в поверхностном эпителии. Однако обнаружено, что антитела к десмоглеину 4 при кожно-слизистой форме вульгарной пузырчатки и при листовидной пузырчатке PF являются результатом перекрестного реагирования аутоантител к десмоглеину 1, а вовлечение в процесс десмоглеина 4 не является необходимым или достаточным для развития акантолиза. В качестве иммунологических мишеней пемфигоидных антител также выступают другие молекулы клеточной мембраны, например, рецепторы ацетилхолина и Е-кадгерин, хотя их непосредственное вовлечение в патогенез пузырчатки до сих пор находится под сомнением.
2. Патофизиология акантолиза. В отличие от многих других заболеваний, опосредуемых аутоантителами, таких как пемфигоид и приобретенный буллезный эпидермолиз, при которых необходим постоянный участок антитела для образования пузырей и активизации комплемента или связывания с рецепторами антитела на воспалительных клетках, при пузырчатке для образования пузырей на коже неонатальных мышей или человека достаточно вариабельного участка антитела. По этой причине многие исследования патофизиологии заболевания концентрируются на эпитопах, связываемых патогенными аутоантителами, поскольку эти участки, вероятно, играют решающую роль для поддержания десмосомальной адгезии клеток.
Исследования по картированию эпитопов показали, что патогенные аутоантитела вульгарной и листовидной пузырчатки связываются с кальций-чувствительными, конформационными эпитопами в аминотерминальных внеклеточных доменах десмоглеинов, в то время как непатогенные антитела обычно связываются с более проксимальными по отношению к мембране внеклеточными доменами.
Связываемые патогенными аутоантителами амино-терминальные домены — это те же самые домены, которые, как предсказывают исследования ультраструктуры кадгерина, формируют ключевые молекулярные взаимодействия для демоглеиновой межклеточной адгезии. Этот факт является основой гипотезы «пространственной помехи», согласно которой патогенные антитела непосредственно вмешиваются в адгезивные взаимодействия десмоглеина, что приводит к акантолизу.
Исследования культивированных кератиноцитов показали, что утрата межклеточной адгезии под действием патогенных аутоантител приводит к интернализации и деградации десмоглеинов, следовательно, связывание антител пузырчатки приводит к утрате функции десмоглеина. Если это так, то другие модели с утратой функции десмоглеина должны имитировать пузырчатку.
Действительно, у мышей с генетическим дефицитом десмоглеина-3 развиваются супрабазальные пузыри на слизистой полости рта, гистологически идентичные высыпаниям у пациентов с вульгарной пузырчаткой. Кроме того, расщепление десмоглеина-1 стафилококковым эксфолиативным токсином (при буллезном импетиго или синдроме стафилококковой обожженной кожи) вызывает образование пузырей, гистологически идентичных пузырям, наблюдаемым у пациентов с листовидной пузрчаткой.
Возникает вопрос: если инактивация изоформ десмоглеина приводит к образованию пузырей, то почему при вульгарной и листовидной пузырчатке специфическая локализация пузырей в тканях не всегда соответствует участкам, на которых аутоантитела связываются иммунофлюоресценцией? Например, при листовидной пузырчатке антитела к десмоглеину-1 связываются во всем эпидермисе и слизистых оболочках, однако пузыри образуются исключительно в эпидермисе. Данный парадокс объясняется компенсацией десмоглеина. Концепция компенсации десмоглеина основана на предположении о том, что аутоантитела против определенной изоформы десмоглеина инактивируют лишь эту изоформу. При этом другая изоформа, экспрессированная на том же участке, способна компенсировать адгезию.
Компенсацией десмоглеина объясняется также крайняя редкость листовидной пузырчатки в неонатальном периоде, ведь даже если материнские антитела к десмоглеину-1 проникают через плаценту, де-смоглеин-3, экспрессированный в поверхностном эпидермисе кожи новорожденных (но не взрослых) одновременно с десмоглеином-1, обеспечивает защиту адгезии, основанной на действии десмоглеина-1. Компенсацией десмоглеина объясняется также разница в участках образования пузырей при вульгарной и листовидной пузырчатке как с гистологической точки зрения (напр., супрабазальные или поверхностные), так и относительно анатомической локализации (слизистые оболочки и/или кожные покровы).
Потенциальным возражением гипотезе «пространственной помехи» являются результаты нескольких исследований, которые в модели на неонатальных мышах после пассивного переноса IgG пузырчатки показали, что модуляция клеточных сигнальных путей, в том числе митоген-активируемой протеинкиназы (МАРК) р 8 и р-ГТФазы, может препятствовать образованию пузырей. Спорным является вопрос о восходящем или нисходящем типе сигнализации, касающейся утраты межклеточной адгезии. Тем не менее, в настоящее время достигнут консенсус относительно того, что десмосомальная адгезия является динамическим процессом, который нарушается под действием аутоантител пузырчатки. Следовательно, методы терапии, направленные на усиление адгезии кератиноцитов путем модулирования сигнальных путей, могут оказывать благоприятное действие при пузырчатке независимо от того, является ли клеточная сигнализация первичной патологической причиной заболевания.
3. Генетическая рестрикция иммунного ответа при пузырчатке. По сравнению с контрольной группой, у пациентов с вульгарной пузырчаткой значительно повышена частота некоторых антигенов класса II главного комплекса гистосовместимости. Сопоставление пациентов разных этнических групп показывает, что у евреев ашкенази преобладает серологически идентифицированный гаплотип HLA-DR4, в то время как у представителей других этносов чаще встречается аллель DQ1. Исследование указанных аллелей главного комплекса гистосовместимости на генетическом уровне, установившее последовательности аминокислот кодируемых данными генами молекул клеточной поверхности, привело к поразительным результатам. Большинство пациентов с серотипом DR4 имеют нетипичную аллель DRB1*0402; в свою очередь, практически у всех пациентов с серотипом DQ1 присутствует редкая аллель DQB1*0503. Аналогичным образом, но с меньшей степенью рестрикции, аллели HLA-DR ассоциируются с листовидной пузырчаткой. Белковые цепи, кодируемые этими аллелями, отличаются от белковых цепей, кодируемых аллелями не имеющих заболевания лиц группы контроля с серотипами HLA-DR4 и HLA-DQ1, всего лишь несколькими аминокислотами.
Аллели молекул главного комплекса гистосовместимости (МНС) класса II кодируют молекулы клеточной поверхности, необходимые для презентации антигенов иммунной системе. Поэтому предполагается, что ассоциированные с вульгарной пузырчаткой молекулы МНС класса II способствуют презентации пептидов десмоглеина-3 Т-клеткам. Подтверждением данной гипотезы явился тот факт, что некоторые пептиды десмоглеина-3, соответствующие пептид-связывающему участку DRB1*0402, обладали способностью стимулировать Т-клетки пациентов. Другие исследования подтвердили, что иммунный ответ при пузырчатке ограничен определенными пептидами десмоглеина и аллелями МНС класса II. Однако для исследователей тот факт, что и у здоровых лиц с DRB1*0402 или DQB1*0503, и у пациентов с пузырчаткой реакция Т-клеток на одни и те же пептиды десмоглеина-3 была одинаковой, явился неожиданным. Следовательно, несмотря на то что для стимуляции Т-клеток при пузырчатке необходимы определенные гены иммунного ответа, их наличие, тем не менее, не является достаточным условием. Фактором, обусловливающим развитие пузырчатки, является отсутствие у пациентов тех регуляторных Т-клеток, которые подавляют аутоиммунный ответ у лиц, обладающих соответствующими генами, но не подверженных заболеванию.
Клонирование антител к десмоглеину, полученных от пациентов с вульгарной и листовидной пузырчаткой, показало выраженную рестрикцию использования генов антител десмоглеиновыми антителами, особенно вариабельных участков тяжелых цепей. Эти исследования показывают также, что патогенные антитела у различных пациентов связываются на десмоглеинах с общими эпитопами или вблизи них и могут иметь общие идиотипы. По сравнению с рестрикцией гена вариабельного участка В-клеточных антител, использование вариабельного гена Т-клеточного рецептора у пациентов с пузырчаткой более гетерогенное. Если способ использования генов специфических антител или Т-клеточных рецепторов окажется одинаковым у многих пациентов с пузырчаткой, это может служить маркером для воздействия на специфические для заболевания иммунные клеточные популяции у пациентов с данным заболеванием.

Отсутствие эпидермиса наблюдается практически на всей спине.
Обратите внимание на вялые интактные пузыри у нижней границы эрозивных очагов.
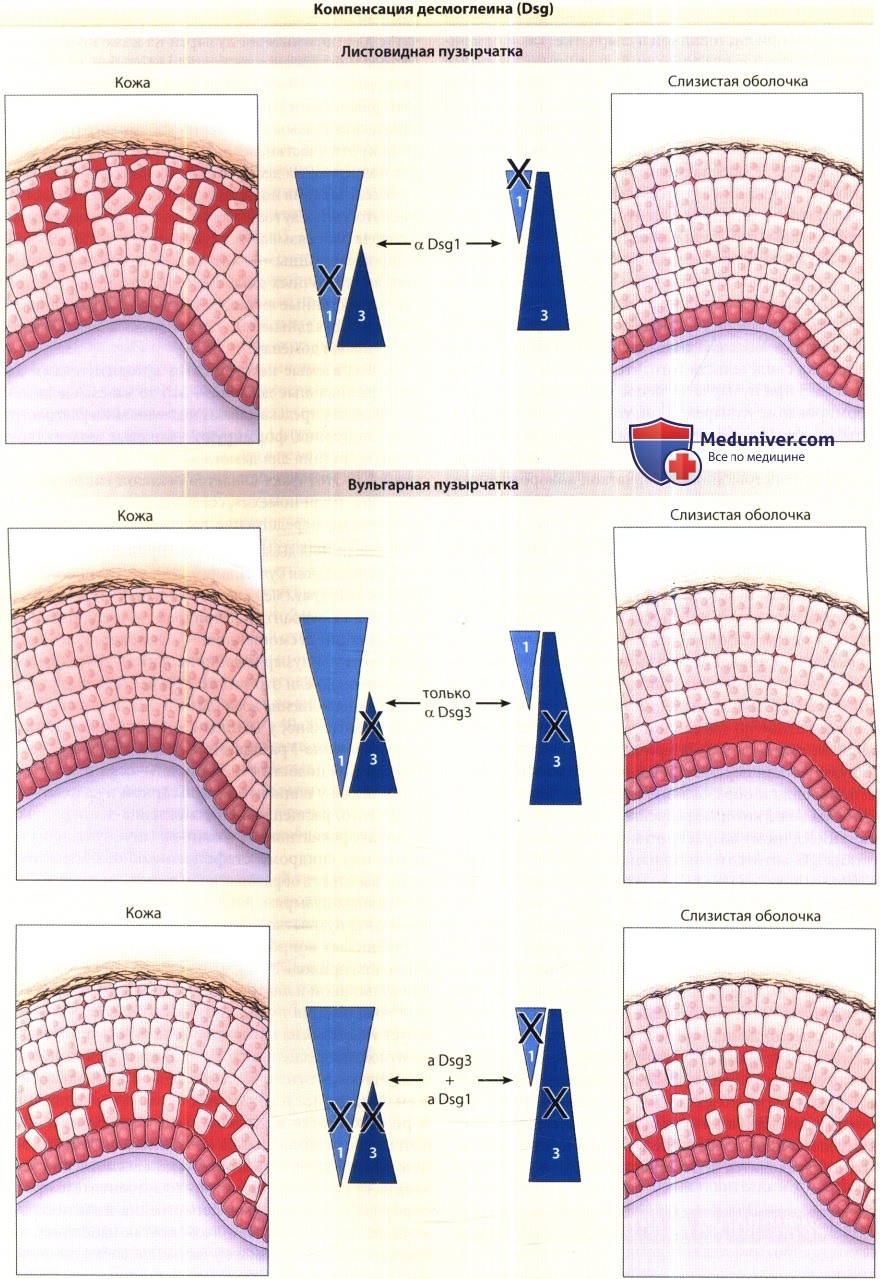
Маркерами показано распределение десмоглеинов-1 и -3 в коже и слизистых оболочках. Антитела к антигену десмоглеина-1 (Dsg 1) при листовидной пузырчатке вызывают акантолиз только в поверхностных слоях эпидермиса.
В глубоких слоях эпидермиса и в слизистых оболочках десмоглеин 3 (Dsg3) компенсирует вызванную антителами потерю функции десмоглеина-1 (Dsg 1).
На ранних стадиях вульгарной пузырчатки наблюдаются только антитела против десмоглеина-3 (Dsg3) — они инициируют пузыри исключительно в глубоких слоях слизистых оболочек, где Dsg3 представлен без компенсаторного Dsg 1.
Однако в случае слизисто-кожной пузырчатки выявляются как антитела против Dsg 1, так и антитела против Dsg3, в связи с чем пузыри формируются и в слизистых оболочках, и в коже.
Пузырь образуется глубоко, вероятно потому, что антитела распространяются по направлению от дермы к эпидермису и первоначально нарушают функцию десмосом у основания эпидермиса.
- Рекомендуем далее ознакомиться со статьей "Симптомы и клиника пузырчатки"
Оглавление темы "Пузырчатка.":
