Механизм развития крапивницы и ангиоотека (патогенез)
а) Тучные клетки и высвобождение гистамина. Тучные клетки являются основными эффекторными клетками для большинства форм крапивницы и ангиоотека, хотя немаловажно здесь участие и других типов клеток. Тучные клетки кожи прикрепляются к фибронектину и ламинину с помощью β1-интегринов «очень поздней активации» (VLA—аббр. от англ. Very late activation), в том числе β1-интегринов VLA-3, VLA-4 и VLA-5, а к витронектину — посредством αvβ3- интегрина.
Тучные клетки кожи высвобождают гистамин в ответ на вещества 48/80, С5а, морфин и кодеин, чего не происходит с тучными клетками других органов. К высвобождению гистамина тучные клетки стимулируются нейропептидной субстанцией Р (SP), вазоактивным интестинальным пептидом (VIP) и соматостатином (в такой роли не могут выступать нейротензин, нейрокиназы А и В, брадикинин или связанный с геном кальцитонина пептид). Исследования микродиализа дермы с введением в кожу SP показали, что SP индуцирует высвобождение гистамина, только достигнув концентрации 10-6 М.
Это означает, что после активации физиологических ноцицепторов SP уже не оказывает заметного влияния на высвобождение гистамина. Однако вещество Р (SP) определяет развитие воспалительной эритемы, индуцированной стимуляцией гистамином афферентных нервных волокон типа С (ответственных за ощущение зуда), что сопровождается высвобождением SP из прилегающих нервных окончаний за счет антидромной нервной проводимости. По имеющимся данным гистамин отвечает за развитие собственно волдырей. Недавно впервые были обнаружены афферентные нервные волокна в спинном мозге, отвечающие за передачу ощущения зуда. Эти волокна отличаются от расположенных в спиноталамическом тракте проводников боли.
Не все потенциально активные биологические продукты синтезируются в результате стимулирования тучных клеток кожи. Например, SP при концентрации выше 10-6 М высвобождает из тучных клеток кожи гистамин, но не индуцирует простагландин D2 (PGD2). Проницаемость сосудов кожи на 85% обусловлена рецепторами гистамина Н1 и лишь на 15% — рецепторами гистамина Н2.
Согласно современной гипотезе о природе клеточной инфильтрации, возникающей вследствие дегрануляции тучных клеток, высвобождение продуктов тучных клеток (гистамина, лейкотриенов, цитокинов, хемокинов) приводит к изменениям проницаемости сосудов, стимуляции молекул адгезии на эндотелиальных клетках, а также «качению» и склеиванию лейкоцитов крови с последующим хемотаксисом и трансэндотелиальной миграцией клеток.
В ходе экспериментального изучения различных форм физикальной крапивницы/ангиоотека велось наблюдение за вызываемым клиническим ответом, проводилось исследование образцов биопсии нормальной и очаговой кожи, анализ выделяемых в кровь или ткани химических медиаторов, также были рассмотрены реакции со стороны периферических лейкоцитов. Внутрикожная инъекция специфического антигена сенсибилизированным лицам послужила экспериментальной моделью для анализа роли иммуноглобулина Е (IgE) и его взаимодействий с тучными клетками.
У многих испытуемых на спровоцированных участках кожи наблюдался двухфазный ответ: за транзиторной, сопровождающейся зудом реакцией в форме волдыря и эритемы развивался болезненный, глубокий, эритематозный, с нечеткими границами отек, который мог персистировать на протяжении суток. Это характерно для ответа поздней фазы, происходящего с привлечением различного числа нейтрофилов, множества эозинофилов, моноцитов, небольших количеств базофилов, а также Т-лимфоцитов популяции CD4+ подкласса Т-хелперов 2 (Th2). Хемокины (хемотаксические цитокины), ассоциированные с преобладанием Т-хелперов 2 типа, включают вещества, взаимодействующие с хемокиновыми рецепторами Т-лимфоцитов CCR3, CCR4, CCR8. К специфическим цитокинам, вырабатываемым Т-хелперами 2 типа относятся интерлейкины (ИЛ) 4,5, 9, 13, 25, 31, 33.
Клеточный инфильтрат, обнаруживаемый в биопсиях при замедленной форме крапивницы, вызванной сдавлением, является вариантом отсроченной реакции («поздней фазы»), тогда как дегрануляция тучных клеток не ассоциирована с поздней фазой при большинстве других видов физической крапивницы.
К последним относятся типичная приобретенная холодовая крапивница, холинергическая крапивница, дермографизм, солнечная крапивница I типа.
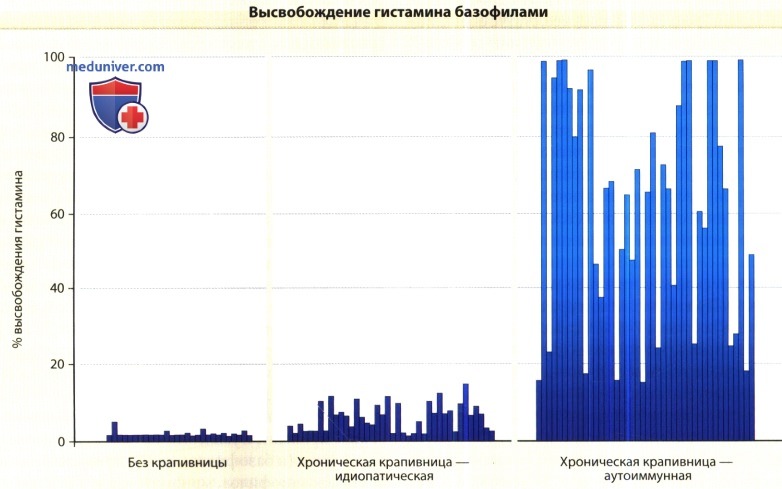
сравнение уровня в сыворотке здоровых испытуемых (N = 35) и больных хронической крапивницей (N = 104).
Показатели при хронической аутоиммунной крапивнице приведены справа.
б) Аутоиммунитет и хроническая крапивница. Поводом к предположению, что больные хронической крапивницей и ангиоотеком имеют аутоиммунный диатез, явился следующий факт: у всех пациентов с данным заболеванием наблюдалось повышенное количество антитиреоидных антител. К таким антителам относятся антимикросомальные (пероксидаза) и антитироглобулиновые антитела, встречающиеся у больных тиреоидитом Хашимото. У пациентов может наблюдаться клинический гипотиреоидизм, однако если воспалительный процесс находится на ранней стадии, лишь у небольшого числа из них отмечается гипертиреоидный статус, когда тиреоидные гормоны выделяются в кровь. Подобную атипичную картину следует отличать от одного из вариантов болезни Грейвса.
Тем не менее, статус большинства больных хронической крапивницей или ангиоотеком — эутиреоидный. Уровень антитиреоидных антител у таких пациентов по данным различных исследований варьирует от 15 до 24% данные последних лет чаще свидетельствуют в пользу большего из этих показателей, подтверждая сегрегацию антитиреоидных антител при хронической аутоиммунной крапивнице, отсутствующую при хронической идиопатической крапивнице. Однако отмеченная связь не является абсолютной. Уровень антитиреоидных антител у пациентов аутоиммунной подгруппы составил 27%, у пациентов с хронической идиопатической крапивницей указанный уровень был равен 11%. При этом в целом среди населения данный показатель составил 7-8%.
Cruber и соавт., полагая, что пациенты могут иметь циркулирующие анти-IgE-антитела, являющиеся функциональными, действительно, обнаружили их у 5-10% обследованных лиц.
Поиск антител, реагирующих с тучными клетками кожи, осуществлявшийся Grattan и соавт. методом кожных проб, дал положительные реакции у 30% больных хронической крапивницей. У здоровых субъектов из группы контроля, а также у пациентов с другими формами крапивницы положительные реакции наблюдались относительно редко. Позже Hide и соавт. показали, что подобная частота положительных реакций является результатом реагирования IgG-антитела с а-субъединицей IgE-рецептора. Кроме того, было убедительно доказано, что уровень функциональных анти-IgE-антител варьирует от 5 до 10%.
в) Клеточный инфильтрат. Дегрануляция тучных клеток инициирует воспалительный процесс при аутоиммунной хронической крапивнице. Предполагается, что аналогичным образом происходит это и при идиопатической хронической крапивнице. В некоторых исследованиях были представлены доказательства роста количества тучных клеток при хронической крапивнице, в то время как другие источники отмечают отсутствие значительных отклонений от нормы. Во всех этих работах, однако, не принимаются во внимание различия между аутоиммунной и хронической формами крапивницы. Тем не менее на сегодняшний день не предложено никаких альтернативных версий механизма дегрануляции тучных клеток при идиопатической крапивнице.
В то же время, гистологическая картина очагов двух указанных форм крапивницы различается только по второстепенным признакам. Общим для обоих биоптатов является окружающий малые венулы в поверхностном и глубоком сосудистом сплетении венул периваскулярный инфильтрат, в котором преобладают Т-лимфоциты популяции CD4+ и моноциты и практически отсутствуют В-клетки. Количество гранулоцитов в биоптатах может варьировать, однако стабильно высоким этот показатель является в том случае, если биопсия выполняется на ранней стадии развития очага. В биоптатах присутствуют как нейтрофилы, так и эозинофилы, хотя уровень скопления эозинофилов может существенно различаться.
Даже если эозинофилы не выявляются, в очагах можно обнаружить главный базовый протеин (как минимум у двух третей пациентов), который, скорее всего, является свидетельством произошедшей дегрануляции эозинофилов. Также было выявлено наличие базофилов, для чего использовалось антитело (ВВ1), специфичное для этого типа клеток. Таким образом, уртикарный инфильтрат похож на инфильтрат аллергической реакции поздней фазы, что соответствует предположениям, высказывавшимся ранее. Об активации эндотелиальных клеток можно судить по наличию молекулы межклеточной адгезии 1 и Е-селектина в биоптатах уртикарных очагов. Источниками хемокинов являются тучные клетки и активированные клетки эндотелия; последние стимулируются не только цитокинами или монокинами, такими как ИЛ-4, ИЛ-1 и фактор некроза опухоли-а (ФНО-а), но и вазоактивными факторами, например, гистамином и лейкотриенами, которые высвобождаются из активированных тучных клеток.
Активация комплемента и высвобождение С5а не только приводит к усилению выброса гистамина из тучных клеток (и базофилов), но и к привлечению нейтрофилов, эозинофилов, моноцитов, для которых С5а является хемоаттрактантом. Присутствие С5а — один из признаков, позволяющих отличить эти высыпания от типичной индуцированной аллергеном отсроченной кожной реакции «поздней фазы». Какие конкретно хемо-кины выделяются при хронической крапивнице, до сих пор неизвестно. Данные о повышении в плазме уровня ИЛ-4 при хронической крапивнице являются косвенным доказательством активации лимфоцитов и/или базофилов. Кроме того, показано, что изолированные от больных CD4+лимфоциты в ответ на стимуляцию фор-болмиристацегатом секретируют значительно большие количества и ИЛ-4, и IFN-y по сравнению со здоровыми испытуемыми контрольной группы.
Прямое сравнение кожных реакций «поздней фазы» и гистологии при хронической крапивнице показало, что клетки инфильтрата обладают свойствами Т-хелперов, как 1 типа, так и 2 типа, поскольку первые вырабатывают IFN-y, а вторые — ИЛ-4 и ИЛ-5. Альтернативным объяснением является вероятность того, что речь идет об активированных Т-хелперах 0 типа (т.е. активированных CD4+лимфоцитах, не дифференцированных ни в Т-хелперы 1 типа, ни в Т-хелперы 2 типа). При сравнении гистологии аутоиммунной и идиопатической хронической крапивницы оказалось, что первая характеризуется более значительным преобладанием в инфильтрате гранулоцитов, тогда как другие клетки инфильтрата совершенно идентичны.
Кроме того, при аутоиммунной форме отмечено небольшое повышение уровня цитокинов, а при идиопатической — более высокая активность триптазы (менее выраженная дегрануляция). Больные с аутоиммунной хронической крапивницей имеют тенденцию к более выраженным клиническим проявлениям по сравнению с пациентами, страдающими идиопатической крапивницей.
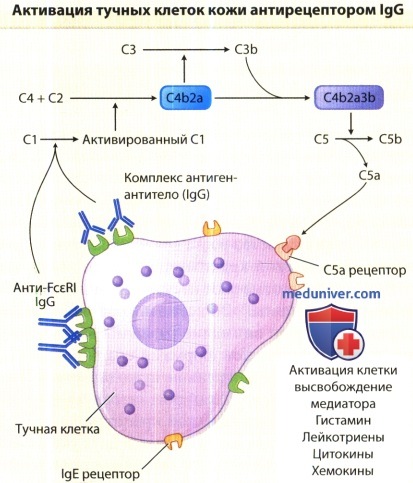
с последующей активацией комплемента, высвобождением С5а и усиленным высвобождением тучных клеток.
г) Дегрануляция базофилов. Исследования показали, что базофилы пациентов с хронической крапивницей гиперчувствительны к анти-IgE. Такое наблюдение было сделано Kern и Lichtenstein задолго до появления каких-либо подходов к пониманию патогенеза этого заболевания. Подтвержденный в дальнейшем, данный факт был соотнесен с базопенией и приписан аутоиммунной форме крапивницы. Одним из очевидных его объяснений является десенсибилизация базофилов in vivo в присутствии рецепторов анти-IgG, циркулирующих в крови. Vonakis и соавт. обнаружили, что гиперреактивность базофилов у больных в отношении анти-IgЕ-антител обусловлена повышенным уровнем SHIP-фосфатазы (SHIP — «srс homology 2-containing inositol phosphatase»), которая блокирует реакции фосфорилирования, облигатные для секреции гистамина. Хотя это патологическое изменение проявляется примерно у половины пациентов с хронической крапивницей (и не накапливается в подгруппах аутоиммунной или идиопатической формы заболевания), оно, по-видимому, вновь возникает при развитии рецидива. Таким образом, этот показатель может служить маркером активности заболевания.
Однако проведенные нами эксперименты, в ходе которых активированные базофилы больного хронической крапивницей были сопоставлены с базофилами здоровых лиц группы контроля, привели к парадоксальному результату. Хотя базофилы пациентов с крапивницей определенно являлись менее чувствительными к анти-IgE, они, тем не менее, усиливали выделение гистамина при инкубации с сывороткой, причем вне зависимости от того, у кого была взята сыворотка: у здоровых лиц, у других пациентов с хронической крапивницей или же она являлась родной (аутологической).
д) Роль внешнего каскада коагуляции. Исследования плазмы при хронической крапивнице показали присутствие д-димера и фрагментов протромбина 1 и 2, что указывает на активацию протромбина путем его превращения в тромбин, а также на разрушение фибриногена тромбином. Реакция не специфична для хронической крапивницы, поскольку имеются аналогичные наблюдения при множестве нестероидных синдромов гиперчувствительности.
Тем не менее, эти данные вызывают большой интерес, и активация каскада коагуляции зависит скорее от тканевого фактора, чем от фактора XII, т.е., внешнего каскада коагуляции. Хотя широко известно, что активированные эндотелиальные клетки являются источником тканевого фактора, патоморфологические исследования указывают на то, что значимым источником также являются эозинофилы. Взаимоотношения этих явлений с высвобождением гистамина базофилами или тучными клетками неизвестно. В свою очередь сообщалось об активации тромбина тучных клеток, однако необходимо большое количество вещества, а наблюдения пока ограничиваются тучными клетками грызунов.
В одной публикации, посвященной высвобождению гистамина эозинофилами, сообщается об обнаружении в сыворотке крови больных хронической крапивницей IgG антител к FceRII, активирующих высвобождение эозинофилами катионных протеинов. Авторы предполагают, что активация базофилов происходит с участием этих катионных протеинов, но не демонстрируют это в эксперименте; тем не менее, они предлагают рассматривать этот феномен как еще один механизм высвобождения гистамина базофилами и возможно тучными клетками.
е) Роль брадикинина при ангиоотеке. Кинины относятся к группе пептидов с низким молекулярным весом, которые участвуют в воспалительных процессах из-за своей способности активировать эндотелиальные клетки и, как следствие, способствовать расширению сосудов, увеличению их проницаемости, синтезу оксида азота и мобилизации арахидоновой кислоты. Кинины также стимулируют окончания сенсорных нервов, вызывая дизестезию по типу жжения. Таким образом, все классические параметры воспаления (покраснение, жар, отек и боль) могут быть связаны с образованием кининов. Наиболее известным из этой группы вазоактивных пептидов является брадикинин.
Существуют два основных пути синтеза брадикинина. Наиболее простой из них включает лишь два компонента: (1) тканевый фермент калликреин и (2) плазменный субстрат киноген с низким молекулярным весом. Тканевый калликреин выделяется многими клетками тела, однако некоторые ткани производят особенно большие количества этого фермента. К ним относятся железистые ткани (слюнные и потовые железы и экзокринные клетки поджелудочной железы), а также легкие, почки, кишечник и мозг.
Второй путь образования брадикинина — гораздо более сложный — представляет собой часть механизма инициации, посредством которого активируется внутренняя коагуляция. Фактор XII является инициирующим белком, который связывается с определенными участками негативно зараженных макромолекул и самоактивируется (подвергается автолизису), образуя фактор ХIIа — синоним фактора Хагемана, как он обозначен на рисунке. Существуют два плазменных субстрата фактора ХПа: (1) прекалликреин и (2) фактор XI, причем каждый из них циркулирует в комплексе с кининогеном, имеющим высокий молекулярный вес (НК).
Эти комплексы также прикрепляются к инициирующим поверхностям, и основные области их прикрепления расположены на двух из доменов НК, которые размещают и прекалликреин, и фактор XI в оптимальной конфигурации для их расщепления, ведущего к образованию калликреина (плазменный), и фактора ХIа соответственно. Важно отметить, что калликреин плазмы и калликреин ткани являются отдельными генными продуктами и имеют незначительную гомологию последовательностей аминокислот, хотя и выполняют родственные функции (т.е. расщепление кининогенов). Тканевый калликреин предпочитает кининоген с низким молекулярным весом, но способен расщеплять и кининоген с высоким молекулярным весом (НК), в то время как калликреин плазмы расщепляет только НК. Два этих кининогена имеют идентичную аминокислотную последовательность, которая начинается на N-конце и продолжается на 12 аминокислот далее структуры брадикинина, однако они имеют различия в доменах С-концов из-за альтернативного сплайсинга на уровне транскрипции.
Фактор XII и высокомолекулярный кининоген связываются с эндотелиальными клетками (которые могут выполнять функцию «естественной» поверхности в присутствии физиологических концентраций ионов цинка), таким образом, активация может происходить на поверхности клеток. Ферменты, разрушающие брадикинин, включают кининазы I и II. Кининаза I также известна как карбоксилпептидаза N плазмы крови, которая удаляет аргинин с С-конца молекулы брадикинина или каллидина с образованием соответственно брадикинина или каллидина без аргинина на С-конце. Тот же фермент удаляет аргинин с С-конца молекулы анафилотоксинов комплемента СЗа и С5а. Кининаза II идентична ангиотензин-превращающему ферменту (АПФ). Кининаза II является дипептидазой, отщепляющей с С-конца молекулы брадикинина фенилаланин и аргинин с образованием гептапептида, который снова расщепляется с удалением серина и пролина и формированием пентапептида арг-про-про-гли-фен.
Если аргинин с С-конца молекулы брадикинина вначале удаляется кининазой I, то АПФ функционирует как трипептидаза и удаляет последовательность сер-про-фен с образованием выше указанного пентапептида. Брадикинин и каллидин стимулируют постоянно образующиеся В2 рецепторы, тогда как дез-арг-брадикинин и дез-арг лиз-брадикинин стимулируют В1 рецепторы, экспрессия которых индуцируется в результате воспаления. К стимуляторам транскрипции В1 рецепторов относятся ИЛ-1 и ФНО-а.
- Рекомендуем далее ознакомиться со статьей "Варианты клиники крапивницы и ангиоотека"
Оглавление темы "Крапивница и ангиоотек.":
