Симптомы нестабильности генома и диагностика нарушения репарации ДНК
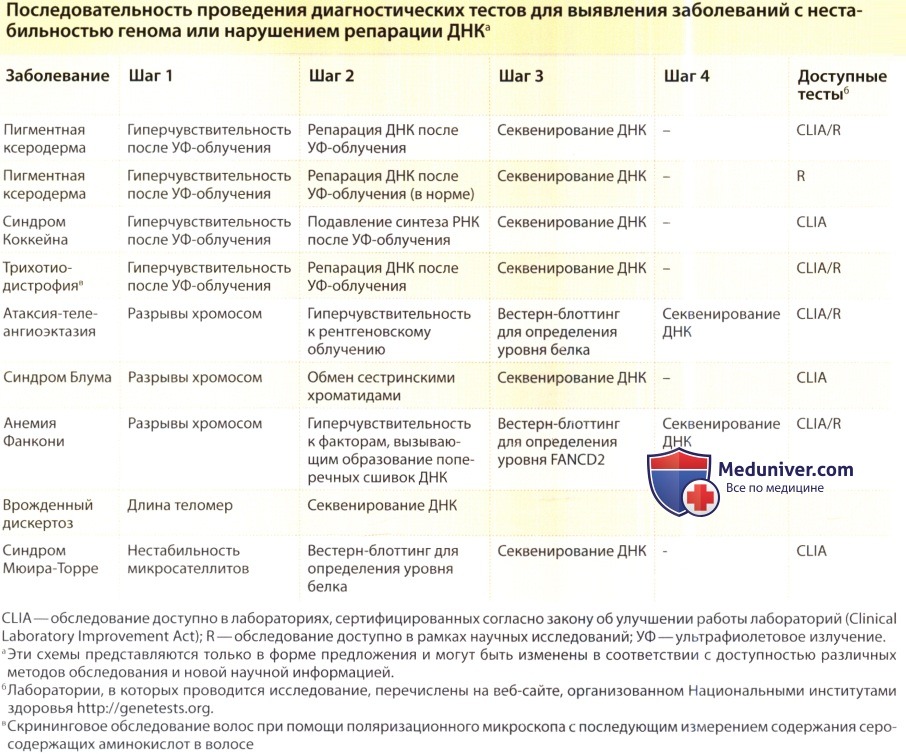
При подозрении на наличие заболевания, сопровождающегося нестабильностью генома, перед клиницистом стоит задача выбора правильного лабораторного обследования для надежного определения диагноза и для разработки рекомендаций для пациента и его родственников. В таблице ниже перечислены некоторые ключевые клинические симптомы, которые могут указывать на наличие таких заболеваний, и должны служить сигналом для врача о необходимости обследования. Различные лабораторные анализы для определения геномной нестабильности, репарации ДНК и реакции на физические и химические факторы приведены в таблице ниже.

а) Использование культивированных клеток. Клетки, полученные непосредственно от пациентов и выращенные в культуральной среде, называются первичными культурами. Дермальные фибробласты в целом легко растут в культуре и, в принципе, могут быть легко выделены из стерильного образца кожи размером 2-4 мм, полученного при помощи дерматома.
Было доказано, что внутренняя поверхность руки является подходящим местом для биопсии, так как эта область быстро заживает с образованием малозаметного шва, кожа защищена от УФ-облучения и попытки выращивания культуры этой кожи были в целом успешны. Ткань помещается в стерильную культуральную среду (или стерильный физиологический раствор) с антибиотиками и транспортируется в лабораторию для выращивания клеточных культур при комнатной температуре.
Культуры человеческих клеток стали доступными для исследований благодаря созданному Национальным институтом здоровья хранилищу генетически мутировавших клеток человека.

б) Тесты для диагнотсики нестабильности генома и нарушения репарации ДНК. Тесты для оценки нестабильности генома и/или способности к репарации ДНК можно разделить на тесты, направленные на оценку сохранности функции клетки, и тесты, направленные на определение целостности и разрывов хромосом в ответ на воздействие повреждающих ДНК факторов. Другие анализы оценивают механизм нарушения такой функции клетки как репарация ДНК, а также характеризуют или определяют экспрессию дефектных генов.
I. Анализы для определения сохранности функции клетки. Тесты для оценки сохранности функции клетки позволяют определить способность интактной клетки восстанавливаться после повреждения ДНК. Эти анализы не дают информации о специфическом типе повреждения, приводящем в результате к повреждению клетки, или о механизме восстановления клетки, но они формируют основу для выявления клеток с повышенной чувствительностью к факторам, повреждающим ДНК, и нередко используются в качестве скрининговых тестов.
1. Число клеток или встраивание тимидина. Один из простейших тестов, проводимых после воздействия УФ- или рентгеновского облучения, является оценка скорости роста в культуре клеток при помощи микроскопа или автоматического счетчика клеток, или при помощи измерения встраивания радиоактивного тимидина во вновь синтезированную ДНК.
2. Способность формировать колонии. Тест на способность формировать колонии позволяет достоверно оценить способность одной клетки к пролиферации в степени, достаточной для формирования видимой колонии.
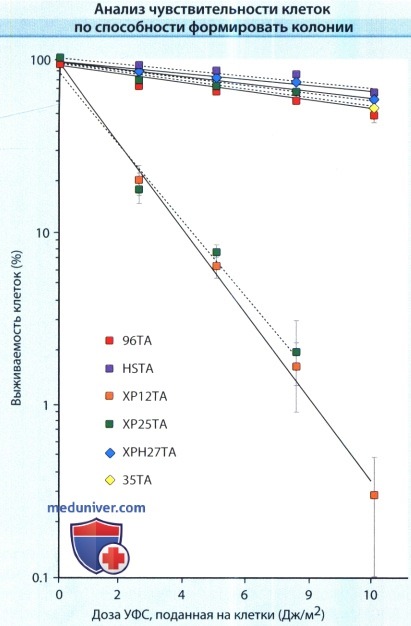
Фибробласты двух больных пигментной ксеродермой братьев (ХР12ТА и ХР25ТА), их отца (ХРН27ТА) и здорового брата (35ТА),
а также фибробласты здорового человека (96ТА и HSTA) были обработаны ультрафиолетовыми лучами спектра С (УФС) с длиной волны 254 нм, после чего оценивалась способность формировать колонии.
Полученные колонии фибробластов ХРС (пигментная ксеродерма, комплементационная группа С),
были значительно более чувствительны по сравнению с колониями клеток от здоровых пробандов и обнаруживали сходную гиперчувствительность после облучения УФС.
Клетки, полученные от непораженного брата и клинически здорового отца, гетерозиготного носителя дефекта пигментной ксеродермы, отличались нормальной выживаемостью после облучения УФС.
II. Анализы для определения целостности и хрупкости хромосом. Хрупкость хромосом обычно оценивается в первичных культурах лейкоцитов периферической крови после стимуляции митогенеза или в долгосрочных культурах фибробластов или лимфобластоидных клеточных линий. Развитие клеточного цикла останавливается в фазе митоза путем обработки ингибитором митоза, таким как колхицин. В ходе этой процедуры 23 пары хромосом, выделенных из одной клетки, дискретно распределяются по предметному стеклу и окрашиваются (обычно по методу Гимзе).
При микроскопическом исследовании можно установить количество хромосом в каждую метафазу, морфологию отдельных хромосом, а также наличие прикреплений или перегруппировку хромосом.
1. Обмен сестринскими хроматидами. В процессе репликации ДНК хроматиды случайно меняются местами вдоль одного плеча хромосомы. Этот обмен сестринскими хроматидами можно выявить при помощи выращивания клеток в течение нескольких клеточных циклов в среде, содержащей аналог нуклеиновой кислоты — бромодеоксиуридин. Считается, что обмен сестринскими хроматидами происходит при рекомбинационной репарации ДНК, хотя значение этого процесса до сих пор неясно.
2. Длина теломер. Укороченные теломеры характерны для клеток пациентов с врожденным дискератозом. Для измерения длины теломер применяются несколько методов, в том числе анализ терминальных фрагментов рестрикции (TRF) методом Саузерн блоттинга, флуоресцентная гибридизация in situ (FISH) и иммуноокрашивание, полимеразная цепная реакция в реальном времени с количественной оценкой (ПЦР), анализ длины единичной теломеры и метод проточной цитометрии с флуоресцентной гибридизацией in situ. Эти анализы обычно проводятся на свежих изолированных эритроцитах, но не на культивированных клетках.
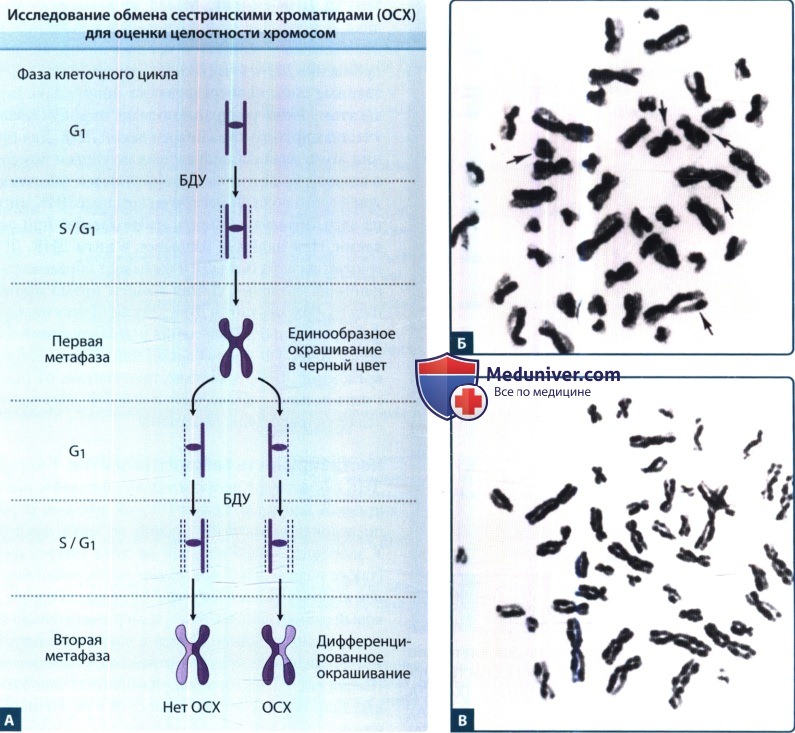
После первого цикла репликации ДНК вновь синтезированной цепи помечается бромодеоксиуридином (БДУ), при этом более «старая» цепочка остается непомеченной.
Такие хромосомы при окрашивании по методу Гимза выглядят единообразно, окрашиваясь в черный цвет.
После второго цикла репликации в среде, содержащей БДУ, одно плечо хромосомы будет содержать две помеченные хроматиды, тогда как другое плечо будет содержать одну помеченную и одну непомеченную хроматиду.
Плечо с двойным замещением будет окрашиваться светлее, тогда как плечо с одним замещением будет окрашиваться в темный цвет.
Если обмен сестринскими хроматидами произошел во время репликации, часть каждого плеча хромосомы будет дважды замещена, а оставшаяся — однократно замещена БДУ.
Б. В культуре неповрежденных клеток лимфоцитов периферической крови здорового человека определяется примерно 10 OCX в каждую метафазу.
В. В культуре лимфоцитов периферической крови пациента с синдромом Блума выявляется многократное увеличение числа OCX.
III. Анализы для определения репарации ДНК:
1. «Внеплановый» синтез ДНК. Одним из наиболее часто используемых тестов для оценки репарации с удалением нуклеотида является «внеплановый» синтез ДНК. Этот анализ использовался для оценки репарации ДНК в интактной коже человека, в культуре клеток эпидермиса и дермы, клеток крови, а при проведении пренатальной диагностики используются клетки амниотической жидкости. В анализе «внепланового» синтеза ДНК оценивается связанный с репарацией синтез ДНК в клетках, находящихся в G1 и G2 фазах (которые обычно не синтезируют ДНК).
Клетки обрабатываются УФ-лучами или другими повреждающими ДНК факторами и затем инкубируются в среде, содержащей радиоактивный тимидин. В ходе репарации с удалением нуклеотида поврежденный участок восстанавливается и радиоактивный тимидин встраивается в восстановленный участок. Клетки обрабатываются фиксирующим веществом, покрываются специальной эмульсией и хранятся в течение заданного времени, после чего эмульсия проявляется. УФ- облучение нормальных фибробластов приводит к значительному увеличению числа зерен, наблюдаемых в ядрах. Значимые отличия наблюдаются после облучения фибробластов, полученных от пациентов с пигментной ксеродермой, которые не могут репарировать поврежденную ДНК, и в них выявляется лишь очень небольшое количество зерен.
2. Ингибирование синтеза РНК. Здоровые клетки после УФ-облучения временно уменьшают синтез РНК с активных генов. Синтез возобновляется после репарации поврежденного участка. Это возобновление синтеза РНК задерживается в клетках пациентов с синдромом Коккейна и некоторыми формами пигментной ксеродермы.
3. Реактивация клетки-хозяина. Анализ реактивации клетки-хозяина основывается на том факте, что плазмиды не обладают способностью восстанавливать повреждение собственной ДНК и зависят от системы репарации клетки. Таким образом, при трансфецировании плазмид с повреждением ДНК в клетки хозяина, ферментам репарации ДНК этих клеток нужно восстановить повреждение до того, как будут экспрессированы плазмидные гены. Поэтому ожидается, что поврежденные плазмиды будут усиленно синтезироваться в клетках с нормальной способностью к репарации. Широко используются нереплицирующиеся плазмиды, содержащие ген фермента светлячков люциферазы, созданные для получения экспрессии в клетках человека; генерация света представляет собой количественную конечную точку его репарации.
4. Метод ДНК-комет. Метод ДНК-комет — это методика, основанная на исследовании одиночных клеток, позволяющая выявить и количественно оценить повреждение ДНК, в частности разрывы нитей ДНК, вызванные либо непосредственно повреждающим ДНК агентом, либо репарационными эндонуклеазами на участках другого типа повреждений ДНК. Для проведения этого анализа поврежденные клетки помещаются в агарозу, лизируются и подвергаются действию электрического поля. В электрическом поле ДНК мигрирует из ядра, образуя «комету», наблюдаемую при окрашивании. При наличии разрывов в нити ДНК, ДНК мигрирует из ядра быстрее и вызывает образование более длинной «кометы».
Длина кометы прямо пропорциональна фрагментации ДНК. Эту методику нельзя модифицировать для определения разрывов одной или двух цепей ДНК, УФ-повреждения или окислительного повреждения ДНК. В клетках, полученных от пациентов с пигментной ксеродермой, после УФ-облучения определяется нарушение репарации.
5. Нестабильность микросателлитов. В нормальной ДНК существуют десятки тысяч областей с повторяющимися динуклеотидами СА или другими короткими последовательностями длиной до пяти нуклеотидов. У здоровых людей каждый из этих микросателлитов (также называемых простыми последовательностями или короткими тандемными повторами) имеют одинаковый размер. Однако этот размер значительно отличается у разных индивидуумов и часто используется для так называемого «снятия отпечатков пальцев» с ДНК. Появление патологически удлиненных или укороченных простых последовательностей в различных тканях или опухолях у пациентов называется нестабильностью микросателлитов. Она может быть связана с дефектом генов репарации неправильного соединения в пары нуклеотидов.
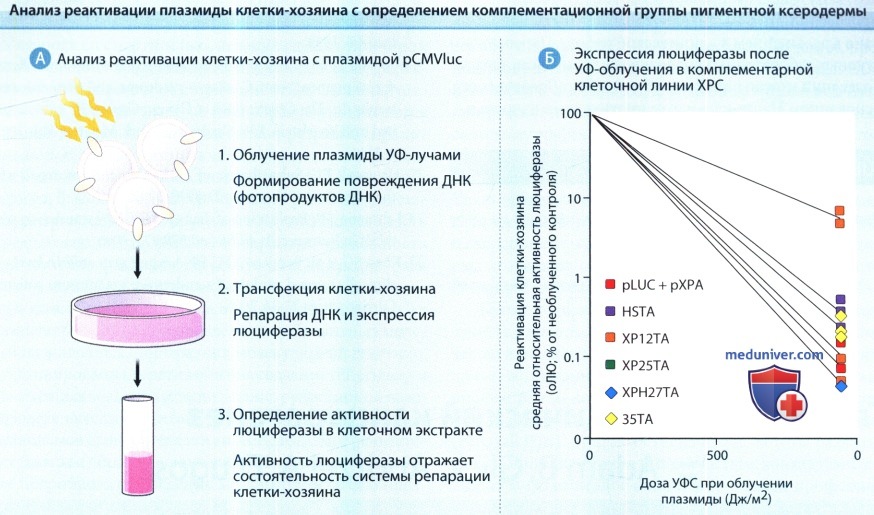
А. Плазмида повреждена ультрафиолетовым (УФ) облучением и введена в культивируемые клетки человека при помощи техники трансфекции.
Ферменты клетки, репарирующие ДНК, восстанавливают поврежденный участок аналогично репарации ДНК клетки.
Затем восстановленная ДНК будет функционировать и начнется транскрипция кодируемого плазмидой гена люциферазы в человеческой клетке.
Таким образом, степень активности люциферазы в пределах клетки-хозяина будет отражать состоятельность клеточной системы репарации ДНК.
Этот анализ также может быть использован для определения комплементационной группы путем ко-трансфекции обработанных УФ-лучами плазмид и плазмид, экспрессирующих дикий тип комплементарной ДНК при ПК (кДНК).
Б. Результаты экспериментов по реактивации плазмид клетки-хозяина и определение комплементационной группы в XP46DC клетках с недостаточностью эксцизионной репарации.
Обработанные УФ-лучами плазмиды продемонстрировали низкую экспрессию в клетках XP46DC, которая увеличилась только при одновременном введении (ко-трансфекции) с плазмидой, экспрессирующей кДНК дикого типа пигментной ксеродермы, относящегося к комплементационной группе С (ХРС).
Этот результат показывает, что клетки ХР65ВЕ относятся к комплементационной группе пигментной ксеродермы (ХРС). rLU—относительные световые единицы; pCMVIuc и pLUC—плазмиды, содержащие ген люциферазы; pXPA-pXPG—экспрессирующие плазмиды комплементационных групп пигментной ксеродермы A-G.
IV. Характеристика и экспрессия дефектных генов:
1. Полимеразная цепная реакция в режиме реального времени. Многие вызывающие заболевания мутации, в т.ч. ответственные за нестабильность генома, нарушают функцию генов, меняя в них последовательность аминокислот. В некоторых генах нестабильности генома в результате мутации появляются стоп-кодоны для синтеза белков. Эти мутации приводят к снижению синтеза информационной РНК (мРНК) для продукта гена в результате процесса, называемого нонсенс-опосредованное нарушение передачи. Уровень мРНК можно точно измерить при помощи полимеразной цепной реакции в режиме реального времени с обратной транскриптазой. Например, низкий уровень мРНК ХРС был обнаружен у всех пациентов с пигментной ксеродермой с дефектом этого гена.
2. Вестерн-блоттинг. Некоторые мутации приводят к уменьшению уровня или размера кодируемых белков, часто путем создания преждевременных стоп-кодонов. Уменьшение уровня белка чаще всего выявляется при помощи вестерн-блоттинга. Клетки при этом лизируются, белки экстрагируют и выделяют при помощи электрофореза в геле. Выделенные белки переносят на мембрану и обрабатывают антителами, специфически связывающимися с искомым белком. Интенсивность окрашивания при присоединении антител отражает количество белка в клетках, и его расположение на мембране указывает на размер молекул белка. В большинстве клинических форм пигментной ксеродермы в клетках пациентов присутствуют неопределяемые или низкие уровни полимеразы белка типа «эта».
4. Секвенирование ДНК. Прямое секвенирование дефектного гена является золотым стандартом для выявления мутации. Заключительным шагом в подтверждении диагноза может быть секвенирование ДНК для определения мутации, лежащей в основе заболевания. По определению, вызывающие заболевание мутации влияют на функции генов. Однако не каждое нарушение последовательности гена влияет на функцию кодируемого белка. В геноме человека существуют миллионы вариантов полиморфизма по одному нуклеотиду, или изменения одного нуклеотида, которые не связаны с заболеванием и могут даже не влиять на аминокислотную последовательность кодируемого белка.
При рецессивных заболеваниях у каждого из клинически здоровых родителей есть один нормальный аллель и один аллель, содержащий мутацию, потенциально способную вызвать заболевание. Больной ребенок получает от каждого родителя аллель с мутацией, вызывающей развитие заболевания. Эти две мутации должны содержаться в каждом гене, хотя они не обязательно должны быть идентичными друг другу.
в) Резюме. Диагностика заболеваний, сопровождающихся нестабильностью генома или нарушением репарации ДНК часто представляет собой многостадийный процесс. Предполагаемая последовательность этих этапов приведена в таблице-рисунке ниже. По мере разработки новых тестов и получения новой информации об этих заболеваниях процедура обследования может соответствующим образом изменяться. Кроме того, решение об объеме проводимого обследования может приниматься с учетом стоимости анализов и их влияния на терапевтическую тактику. Например, секвенирование ДНК редко требуется для диагностики пигментной ксеродермы у ребенка с классической клинической картиной, в клетках которого обнаруживается нарушение репарации ДНК и повышенная чувствительность к УФ, и которые погибают после облучения.
Но если в семье есть больной пигментной ксеродермой ребенок и планируется следующая беременность, то секвенирование ДНК может дать возможность пренатальной диагностики при помощи секвенирования биоптата трофобласта. Генетическая консультация является важным этапом при ведении пациентов с этим заболеванием. Эта функция может выполняться лечащим врачом или специально обученным генетиком-консультантом.
В США эти специализированные анализы в рамках ведения пациентов могут проводить только лаборатории, сертифицированные в соответствии с законом об улучшении работы лабораторий (Laboratory Improvement Act, CLIA). Анализы, проводимые в исследовательских лабораториях, в целом находят ограниченное применение в клинической практике. Однако исследовательские лаборатории могут выявить мутацию, вызывающую заболевание, которая в последующем может быть подтверждена в лаборатории, сертифицированной для проведения этих анализов, что может быть использовано в дальнейшем в клинической работе.
- Рекомендуем далее ознакомиться со статьей "Химический канцерогенез рака кожи. Окружающая среда как причина рака"
Оглавление темы "Канцерогенез рака кожи.":- Канцерогенез рака кожи. Факторы риска рака кожи
- Повреждение ДНК кожи и ее репарация. Гены репарации ДНК
- Регуляция клеточных реакций на повреждение ДНК
- Симптомы нестабильности генома и диагностика нарушения репарации ДНК
- Химический канцерогенез рака кожи. Окружающая среда как причина рака
- Онкогены, гены-супрессоры роста опухоли и наследственные причины рака
- Модели рака кожи на животных для изучения онкогенеза

