Иммунитет кожи под действием ультрафиолета (фотоиммунология кожи)
Рак кожи часто вызывается прямым повреждением ДНК и появлением специфических генных мутаций. Тем не менее для развития явных клинических симптомов рака кожи необходим второй УФВ-индуцированный механизм, названный УФВ-индуцированной иммуносупрессией. Связь между солнечным облучением и раком кожи была впервые выявлена в начале прошлого века, когда врачи наблюдали проявления рака кожи преимущественно на областях, широко подверженных солнечному облучению.
В 1970-х годах в основополагающем исследовании Kripke была обнаружена связь между иммуносупрессией и фотокарциногенезом. В сериях экспериментов было показано, что УФ-индуцированные опухоли, которые пересажены изогенным мышам-реципиентам, отторгались, если мыши не подвергались действию УФВ. Этот результат дает понять, что УФ-индуцированные опухоли обладают высоко антигенным фенотипом и могут быть отторгнуты нормально работающей иммунной системой. Лечение определенными иммуносупрессивными препаратами или облучение низкими дозами УФ останавливали отторжение опухоли, что явилось открытием.
Оба явления (выраженная антигенность УФ-индуцированных опухолей и иммуносупрессия под действием УФВ) запустили интенсивный поток исследований в области, ныне называемой фотоиммунологией. В многочисленных исследованиях была предпринята попытка выявить клеточные и молекулярные механизмы этих реакций. Это оказалось в высшей степени сложным. Результаты иногда получались противоречивыми, главным образом в связи с различиями в использовании экспериментальных методов и моделей.
а) Модели для иммуносупрессии, индуцированные ультрафиолетом. Стандартными моделями для изучения УФВ-индуци-рованной иммуносупрессии являются гиперчувствительность замедленного типа (DTH) на антиген и контактная реакция гиперчувствительности. Способность УФВ-излучения прерывать либо индукцию, либо развитие аллергической сенсибилизации можно оценить количественно. Обычно на кожу наносят такие гаптены, как динитрофлуоробензин или оксазолон, в качестве стимулятора, затем измеряют область отека ткани и оценивают интенсивность соответствующей иммунной реакции.
DTH стала моделью выбора для изучения иммуносупрессивного влияния УФВ излучения, поскольку антигены УФВ-индуцированных опухолей изучены слабо, и оценка DTH требует меньше времени и лабораторных анализов, чем изучение фотокарциногенеза.
Также было показано, что УФВ-излучение влияет на иммунные реакции, вовлеченные в патогенез вирусных, паразитарных, грибковых и бактериальных инфекций. Выделяют два типа УФВ-обусловленной иммуносупрессии:
1) местная иммуносупрессия, при которой не развивается иммунная реакция на антиген, нанесенный на область облучения,
2) системная иммуносупрессия, при которой иммунная реакция на антиген, нанесенный на необлученные области, также нарушена.
Тем не менее замечено, что некоторые мыши, имеющие генетические локусы для липополисахаридов (Lps) и фактора некроза опухоли (TNF), оказывающих значительное влияние на иммунный ответ, более восприимчивы к УФВ-индуцированной иммуносупрессии.
б) Молекулярные мишени при фотоиммуносупрессии. ДНК является хромофором для УФВ-излучения и может служить прямой мишенью. УВФ излучение генерирует разнообразные фотопродукты, чаще всего CPDs (циклобутил-пиримидиновые димеры) и другие фотопродукты. Непосредственной причиной УФ-индуцированной иммуносупрессии является образование димера пиримидина. Клетки опоссума Monodelphis domestica содержат эндогенные фотореактивные ферменты, которые способны нейтрализовать CPD, и УФВ у этих животных не вызывает иммуносупрессии на фотостимулирующий свет сразу после облучения. У мышей также выявлена корреляция между CPD и УФВ-индуцированной системной иммуносупрессией.
УФВ вызывает образование CPD в антиген-презентирующих клетках (АРС) и повреждение их антиген-презентирующего свойства. Повреждающий эффект длится несколько дней, и такие клетки мигрируют из кожи в лимфатические узлы. Лечение области УФВ облучения с помощью липосом, содержащих ДНК-восстанавливающий фермент Т 4-эндонуклеазу V, предотвращает повреждение антиген-презентирующей функции. Роль повреждения ДНК при УФВ-индуцированной иммуносупрессии также была подтверждена на коже человека, когда местное нанесение липосом, содержащих фотолиазу, на области облучения УФВ предотвращало УФВ-индуцированную иммуносупрессию.
Помимо прямого повреждения ДНК, в фотоиммуносупрессию наиболее вероятно вовлечено образование ROS. Соответственно местное нанесение на кожу мыши полифеноловой фракции, выделенной из зеленого чая, до и после облучения УФВ защищает от УФ-индуцированной иммуносупрессии. Данный эффект скорее всего вызван антиоксидантом эпигал-локатехин-3-галат, компонентом экстракта, способным снизить оксидативный стресс, воспалительные реакции и рак кожи. Следует отметить, что такие вторичные растительные вещества влияют на сигнальную систему клетки, поэтому защиту от УФВ-индуцированного повреждения можно объяснить не только их антиоксидантным действием.
Клеточная мембрана иммунокомпетентных клеток кожи является еще одной мишенью для УФ-излучения. Важной функцией клеточной мембраны является передача сигналов извне внутрь клетки через мембранные рецепторы. Действие УФВ в отсутствие связывающих лигандов приводит к образованию скоплений и погружению поверхностных клеточных рецепторов для эпидермального фактора роста, TNF и IL-1. Образование скоплений вызывает выраженную активацию стресс-индуцированных c-Jun NFE-терминальных киназ, которые входят в группу митоген-активированных протеинкиназ. Можно представить, что такое патологическое скопление рецепторов может нарушить механизмы сигнальной системы клетки, используемые факторами роста и цитокинами, которые, вероятно, участвуют в иммунологических реакциях.
Хромофором в случае этих УФВ-индуцированных изменений мембраны является триптофан цитоплазмы. Образовавшиеся фотопродукты триптофана связываются с транскрипционным фактором, арилгидрокарбоновым рецептором (AhR), который в неактивной форме является частью цитоплазматического комплекса, включающего c-src и белок теплового шока Hsp90. После связывания фотопродукта триптофана с AhR комплекс разлагается, и AhR транслоцируется в ядро, в то время как c-src транслоцируется в клеточную мембрану, где затем вызывает упоминавшуюся ранее активацию клеточной мембраны/поверхностных рецепторов.
УФВ-излучение может вызвать окисление липидов, в том числе мембранных. Фосфатидилхолин, основной липид мембраны, в результате окисления может образовывать вещества, подобные фактору активации тромбоцитов (PAF), которые соединяются с рецепторами PAF и активируют синтез цитокинов. Роль УФВ-индуциро-ванного синтеза PAF в развитии фотоиммуносупрессии предположена при наблюдении за мышами. Сравнительная иммуносупрессия может быть вызвана у мышей при их облучении УФВ после введения им карбамил-PAF или фосфатидилхолина, который до этого был облучен УФВ в атмосфере кислорода.
Иммуносупрессивные свойства всех трех методов лечения были в равной степени заблокированы специфическими антагонистами рецепторов РАЕ Это указывает на то, что УФВ-индуцированные PAF-подобные липиды могут активировать рецепторы PAF, как это делает сам РАЕ В свою очередь активация этих рецепторов вызывает различные каскадные реакции, включая реакцию активации митоген-активированной протеинкиназы и синтез иммуносупрессивных цитокинов. Интересно, что индуцированная УВФ-облучением иммуносупрессия, как и образование PAF усиливались у мышей, неспособных к усвоению осмолита таурина. Таким образом, как и при эксцизионной репарации нуклеотидов, поглощение таурина активно участвует в защите кожи от вызванной ультрафиолетом В иммуносупрессии.
Уроканиновая кислота (UCA) является внеклеточным хромофором, который регулирует УФВ-индуцированную иммуносупрессию. УФ излучение вызывает дозозависимую изомеризацию транс-UCA до цис-UCA, до достижения сбалансированного фотостационарного состояния. В ряде независимых исследований была подтверждена важность цис-UCA в УФВ-индуцированной иммуносупрессии, хотя до сих пор конкретный механизм действия неясен.
в) Внутриклеточные реакции при иммуносупрессии. Облучение кератиноцитов УФВ изменяет экспрессию их поверхностных молекул и запускает синтез и секрецию целой группы растворимых иммуномодулирующих факторов, включая IL-1, IL-6, IL-8, TNF-a и PGE2. Доказательство иммуносупрессивных свойств факторов, выделяемых кератиноцитами, получено из экспериментов на мышах, показывающих, что подавление реакций гиперчувствительности происходило под влиянием либо сывороточных факторов у УФВ-облученных мышей, либо от надосадочной жидкости над УФВ-облученными мышиными эпидермальными клетками.
Соответственно, выявлено, что УФВ-облученными кератиноцитами также синтезируются TNF-a и IL-10, два потенциально иммуносупрессивных цитокина. IL-10 тоже выделяется в коже человека макрофагами CD11b+. Введение TNF-a имитирует УФВ-индуцированные повреждения клеток Лан-герганса (LC). Добавление антител, нейтрализующих TNF-a до облучения, препятствует УФВ-индуцирован-ному образованию скоплений дендритных клеток (DC) в промежуточных лимфатических узлах (DLN) и подавлению контактной гиперчувствительности. Особенно важным в местной иммуносупрессии является выделение TNF-a, и, как было сказано выше, ген TNF-a участвует в сенсибилизации к УФВ.
IL-10 является цитокином Т-хелперов 2 типа (Тх2) и прерывает синтез цитокинов Тх1, особенно интерферона- γ (IFN- γ).УФВ-стимулированный синтез IL-10 в ке-ратиноцитах мышей или макрофагах кожи человека изменяет иммунный ответ с Тх1 -типа на Тх2. Этим объясняется, почему клеточные иммунные реакции, обусловленные Тх1, нарушаются при облучении УФ.
Взаимодействие между различными цитокинами не до конца понятно, но определенно известно, что IL-10 играет основную роль. Например, анти-IL-10 антитела нейтрализуют подавляющее действие продуктов, синтезированных в УФВ-облученных кератиноцитах у DTH-мышей. Основным механизмом действия IL-10, возможно, является подавление антиген-презентирующей функции клеток Лангерганса. В то же время УФВ-облученные кератиноциты выделяют PAF и PAF-подобные липиды, которые взаимодействуют с рецептором PAF, как описано в выше в пункте «Молекулярные мишени при фотоиммуносупрессии». Предположительно, PAF и его рецептор усиливают продукцию циклооксигеназы-2, PGE2, IL-4 и IL-10.
Синтез последнего может быть обратим благодаря IL-12. Иногда IL-12 может восстанавливать CHS. Введение IL-12 мышам после УФВ облучения предотвращало УФВ-индуцированную иммуносупрессию и подавляло частично УФВ-индуцированную устойчивость при повторной сенсибилизации через 14 дней после УФ-облучения. Это действие IL-12 скорее всего связано с его свойством ускорять восстановление фотопродуктов ДНК после УФВ-облучения, которые являются молекулярной основой синтеза IL-10 облученными кератиноцитами.
г) Клеточные медиаторы фотоиммуносупрессии: клетки Лангерганса, макрофаги и Т-клетки. Клетки Лангерганса (КЛ) составляют 2-5% эпидермальных клеток, относятся к подтипу отростчатых клеток (DC), происходят из костномозговых клеток-предшественников и рассеяны в эпидермисе. Это специализированные, кожные антиген-презентирующие клетки, локально поглощающие антиген, но не имеющие достаточного ко-стимулирующего свойства. После поглощения антигена КЛ перемещаются в промежуточный лимфатический узел (DLN), где созревают до потенциальных стимуляторов антиген-специфических Т-клеток, экспрессируя на своей поверхности большое количество молекул главного комплекса гистосовместимости, ко-стимулирующих молекул В7.1 и В7.2 и молекул межклеточной адгезии-1.
В 1980-х гг. было показано, что эпидермальные КЛ играют основную роль в запуске и регуляции контактной реакции гиперчувствительности (CHS). Плотность КЛ является важным фактором запуска этих реакций, а УФ-облучение приводит к исчезновению КЛ из областей облучения. В этих исследованиях проводили сенсибилизацию мышей нанесением гаптена динитрофлуоробензина на кожу с обычным содержанием КЛ и на кожу с дефицитом КЛ. У мышей с недостаточным содержанием КЛ в коже отмечали значительно нарушенную CHS. Оказалось, что временное истощение LC в коже является важным свойством УФВ-излучения. Более того, воздействие УФ приводит к уменьшению поверхностной экспрессии ко-стимулирующих молекул Iа, В7.1, В7.2 и молекулы-1 межклеточной адгезии. Истощение этих молекул может быть причиной или участником иммуносупрессии.
Уменьшение КЛ кожи сопровождается увеличением отростчатых клеток в лимфатических узлах. Изотиоцианат флуоресцеина + Iа + CPD + клетки в лимфатических узлах были обнаружены после нанесения на кожу изотиоцианата, флуоресцеина и последующего облучения-УФ. Это свидетельствует, что КЛ действительно покидают кожу после воздействия-УФ. Возможно, УФВ запускает перемещение КЛ при отсутствии экзогенного антигена, хотя эффект перемещения усиливается при сенсибилизации к антигену. В процессе исследования находится конечная судьба хронически облучаемых КЛ. Миграция КЛ под действием УФВ также наблюдалась в коже человека in vivo.
Помимо уменьшения числа КЛ в коже, УФВ-излучение влияет на функционирование этих клеток, нарушая их антиген-презентирующую способность в реакциях гиперчувствительности замедленного типа и контактной гиперчувствительности. УФВ-облученные LC активируют преимущественно CD4+ Тх2-клетки. И напротив, они не активируют CD4+ Т-клетки Тх1-подтипа, но вызывают клональную анергию. Другим участником УФ-индуцированной иммуносупрессии является макрофаг СD11b+, инфильтрирующий УФВ-облученную кожу человека. Эти клетки выделяют IL-10, и их устранение с помощью антител приводит к тому, что у УФ-облученных мышей вновь развивается реакция гиперчувствительности.
В дополнение к отсутствию иммунологической реакции на гаптен, нанесенный на кожу после облучения, также пропадает и гаптен-специфическая невосприимчивость (то есть повторная сенсибилизация тем же гаптеном в более поздние промежутки времени), вызванная облучением УФВ. В экспериментах с адоптивным иммунитетом (пассивный перенос иммунологически компетентных противоопухолевых клеток в организм реципиента) было показано, что УФВ активирует Т-супрессорные клетки. Elmets и соавт. приготовляли суспензию из клеток селезенки и лимфатических узлов, полученных от УФВ-облученных мышей с введенным гаптеном. Клеточная суспензия была введена обычной мыши.
После сенсибилизации мыши-реципиента и введения ей того же гаптена, использовавшегося у мышей-доноров, было показано значительное усиление реакции гиперчувствительности.
Фенотип регуляторных Т-клеток и их механизм действия недостаточно понятны. Полученные результаты сравнивать трудно. Различия в экспериментальных установках приводили к частично противоречивым результатам. Есть основание полагать, что CD8+ Т-клетки являются важными медиаторами в УФВ-индуцированной иммуносупрессии. К тому же Т-клетки (без уточнения CD4 или CD8), которые экспрессируют цитотоксический Т-лимфоцитарный антиген (CTLA)-4 на своей поверхности, передают УФ-индуцированную невосприимчивость. Оказалось, что именно CTLA-4 выполняют эту функцию, поскольку введение in vivo анти-CTLA-4-антител блокирует развитие супрессии. Физиологическая функция CTLA-4 заключается в прекращении иммунных реакций путем инактивации Т-клеток, поэтому CTLA-4 играет важную роль в иммунной регуляции.
В ответ на стимуляцию антиген-содержащими дендритными клетками CTLA-4+ Т-клетки выделяют большое количество IL-10, трансформирующего фактора роста-β, IFN-γ (интерферона-γ), немного IL-2 и совсем не синтезируют IL-4. В других исследованиях показано, что CD4+ Т-клетки от УФ-облученных мышей способны подавлять реакции гиперчувствительности у обычных мышей-реципиентов. Эти CD4+ Т-клетки синтезируют IL-10, но не выделяют IL-4 и IFN-γ в АРС-ко-культуре, а также подавляют синтез IL-12 в АРС.
Кроме регуляторных CD4+ Т-клеток, при УФВ-ин-дуцированной иммуносупрессии были обнаружены Т-клетки- естественные киллеры с регуляторными свойствами. В частности, были описаны CD3+, CD4+, DX5+ CD1-естественные киллеры Т-клетки, которые выделяют IL-4 и могут, при переносе в другой организм (адаптивно) вызывать подавление противоопухолевого иммунитета и DTH.
д) Воздействие ультрафиолетов облучения на врожденный иммунитет. Вдобавок к медленным, но специфическим адаптивным иммунным ответам, в коже может также генерироваться более примитивный врожденный иммунный ответ. Важными компонентами врожденного иммунного ответа являются нейтрофилы, эозинофилы, естественные клетки-киллеры, тучные клетки, цитокины, комплемент и особенно противомикробные пептиды и белки. Важно отметить, что иммуносупрессивные свойства УФ-облучения относятся исключительно к адаптивному иммунному ответу. Было показано, что УФ-облучение скорее инициирует, а не подавляет врожденный иммунный ответ, увеличивая выработку противомикробных пептидов β-дефензина человека (HBD)-2, -3, рибонуклеазы 7 и псориазина в кератиноцитах и коже человека in vitro и in vivo.
Этим возможно объясняется, почему под действием УФ подавляются опосредуемые Т-клетками иммунные реакции, но не защитные реакции организма против бактериальных атак.
е) Особенности. УФ излучение постоянно присутствует в окружающей среде, и во всех живых организмах развиты защитные реакции против его повреждающего действия. Можно предположить, что фотоиммуносупрессия несет физиологическую роль адаптивного ответа кожи на УФ-индуцированные изменения белков и иммунный ответ на так называемые нео-антигены и, как следствие, хроническое воспаление. В этих условиях оказывается, что более высокий риск рака кожи, сопровождающий УФ-индуцированную иммуносупрессию, является менее значимым с точки зрения эволюции, поскольку рак кожи развивается обычно в более позднем возрасте, после репродуктивного периода.
Тем не менее, с практической точки зрения, фотокарциногенез является серьезной проблемой для здоровья. Соответственно, современные методы предотвращения УФ-индуцированной иммуносупрессии включают УФ фильтры широкого спектра, липосомы с ферментами для восстановления ДНК, антиоксиданты и осмолиты.
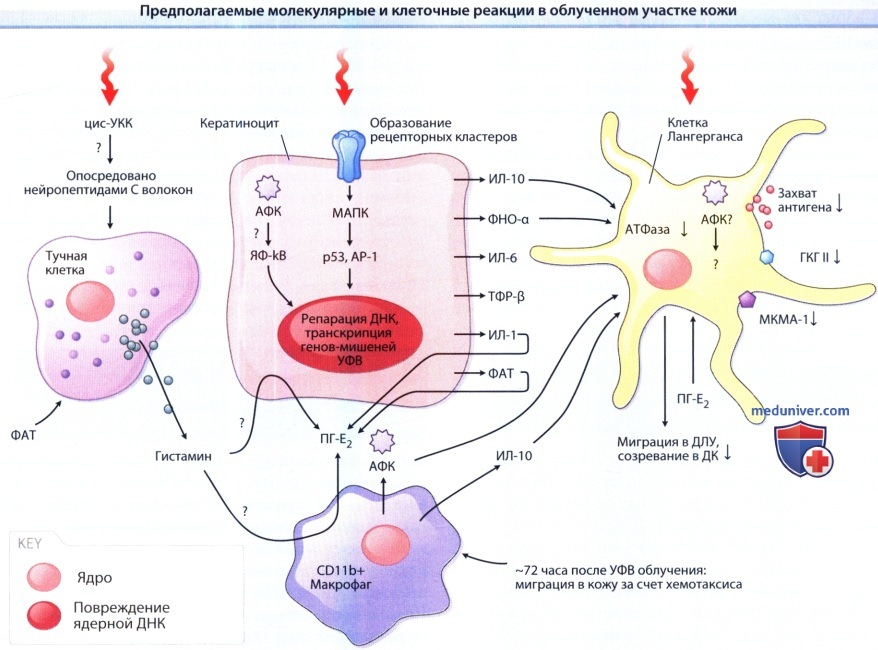
АТФаза — аденозинтрифосфатаза; ДК — дендритная клетка, ДЛУ—дренируемый лимфатический узел,
ИЛ—интерлейкин, МКМА—-межклеточная молекула адгезии, МАПК—митоген-активированная протеинкиназа,
ГКГ—главный комплекс гистосовместимости, ЯФ-кВ — ядерный фактор кВ, ФАТ—фактор активации тромбоцитов,
ПГ-Е2—простагландин Е2, АФК—активные формы кислорода, ТФР—трансформирующий фактор роста, ФИО—фактор некроза опухоли, УКК—уроканиновая кислота.
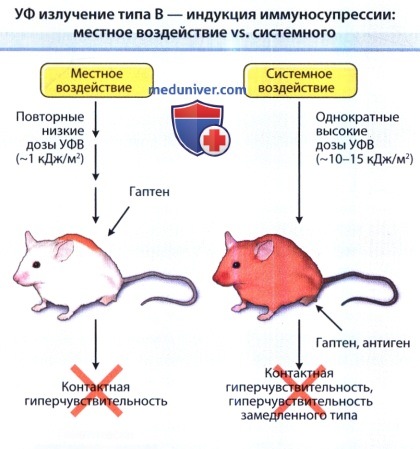
местное и системное воздействие (ФНО—фактор некроза опухоли).
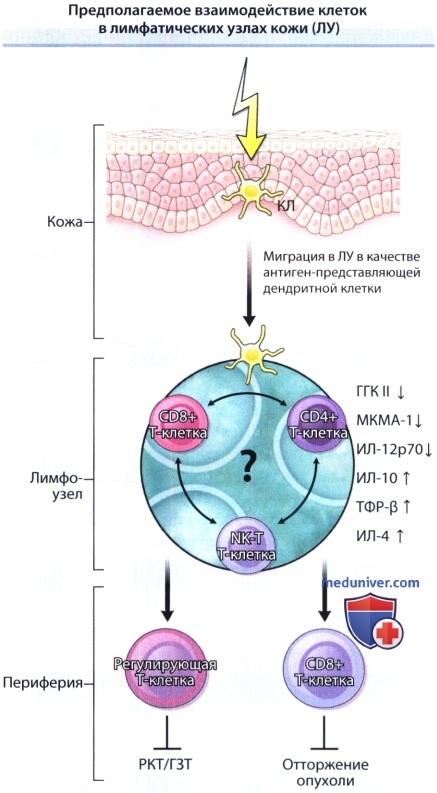
иллюстрация предполагаемого взаимодействия клеток в лимфатических узлах кожи.
РКГ—реакция контактной гиперчувствительности, ДК—дендритная клетка, ГЗТ—гиперчувствительность замедленного типа,
МКМА — молекула межклеточной адгезии, ИЛ — интерлейкин, КЛ — клетка Лангерганса,
ГКГ —главный комплекс гистосовместимости, NK-T клетка — клетка типа естественного киллера, ТФР — трансформирующий фактор роста.
- Рекомендуем далее ознакомиться со статьей "Патологические реакции на ультрафиолетовое излучение"
Оглавление темы "Болезни кожи от ультрафиолета света.":- Механизм образования витамина D в коже
- Потребность организма в витамине D. Оптимальные уровни витамина D
- Иммунитет кожи под действием ультрафиолета (фотоиммунология кожи)
- Патологические реакции на ультрафиолетовое излучение
- Полиморфная световая сыпь (полиморфный фотодерматоз) - причины, диагностика, лечение
- Актиническое пруриго (АП) - причины, диагностика, лечение
- Световая оспа (СО) - причины, диагностика, лечение
- Хронический актинический дерматит (ХАД) - причины, диагностика, лечение
- Солнечная крапивница (СК) - причины, диагностика, лечение
- Болезни провоцируемые ультрафиолетом (фотоиндуцированные дерматозы)

