Цитокины семейства интерлейкинов-1: ИЛ-1, ИЛ-18, ИЛ-33
ИЛ-1 — это прототип цитокина, который был неоднократно открыт в процессе различных биологических исследований, а и β-формы интерлейкина-1 человека кодируются различными генами, причем на уровне аминокислот гомологичность составляет только 26%. Обе формы ИЛ-1 транслируются как молекулы с молекулярной массой 31 kd, у которых отсутствует сигнальный пептид, причем обе они находятся в цитоплазме.
Такая форма ИЛ-1а биологически активна, а форма ИЛ-1β с молекулярной массой 31 kd для получения активной молекулы требует расщепления каспазой-1 (первоначально называвшейся «фермент, конвертирующий интерлейкин- 1β»).
В целом ИЛ-1β является доминантной формой ИЛ-1, которая синтезируется моноцитами, макрофагами, клетками Лангерганса и дендритными клетками, в то время как ИЛ-1а преобладает в эпителиальных клетках, включая кератиноциты. Это, вероятно, связано с тем фактом, что эпителиальный ИЛ 1-а накапливается в цитоплазме клеток, которые контактируют с окружающей средой.
При повреждении такие клетки высвобождают биологически активный ИЛ 1-а массой 31 kd и, таким образом, они инициируют воспаление.
Однако при повреждении эти клетки дифференцируются и, в итоге, выделяют содержащийся в них ИЛ-1 в окружающую среду. Лейкоциты, включая дендритные клетки и клетки Лангерганса, несут содержащийся в них ИЛ-1 внутрь организма, где его высвобождение, при отсутствии регулировки, могло бы вызвать значительное повреждение тканей. Поэтому высвобождение из клеток биологически активного ИЛ 1-β контролируется на нескольких уровнях: транскрипции гена ИЛ-1β, транскрипции гена каспазы-1 и наличия адаптерных белков ASC и Ipaf, которые взаимодействуют с каспазой-1 в инфламмасоме, способствуя выработке зрелых ИЛ-1β.
Роль ИЛ-1β в миграции клеток Лангерганса из эпидермиса во время инициации контактной гиперчувствительности является переломной для выхода клеток Лангерганса из эпидермиса и успешной сенсибилизации. Результаты исследований мышей с дефицитом генов ИЛ-1α и ИЛ-1β указывают на то, что обе молекулы важны для контактной гиперсенсибилизации, при этом роль ИЛ-1а более важная.
Активные формы ИЛ-1 связываются с рецептором ИЛ-1R или рецептором ИЛ-1 типа I. Это единственный рецептор передачи сигнала для ИЛ-1, и его цитоплазматический домен мало гомологичен другим цитокиновым рецепторам, наибольшая степень гомологичности отмечается с продуктом Толл-гена, идентифицированного в Drosophila. Второй белок на поверхности клетки, вспомогательный белок ИЛ-1R или ИЛ-1RAcP, для передачи сигнала должен связываться с ИЛ-R1. Когда ИЛ-1 задействует комплекс ИЛ-1R/ИЛ-1RАсР, рекрутируется адаптер MyD88, после чего происходят взаимодействия с одной или более киназой IRAK. Эти киназы в свою очередь взаимодействуют с TRAF6. Ступенчатая активация и рекрутирование дополнительных сигнальных молекул индуцируют активность IKK. Итоговым результатом является активация серии генов, регулирующих NF-kB.
Молекула, известная как антагонист рецептора ИЛ-1 или ИЛ-1ra, может связываться с ИЛ-1R1, но не сигнализирует посредством этого рецептора. Молекула ИЛ-1ra существует в трех подвергшихся альтернативному сплайсингу формах, но только изоформа, производимая моноцитами,является единственным лигандом для ИЛ-1R1, который содержит и сигнальный пептид, и секретируется из клеток.
Две другие изоформы ИЛ-1ra не имеют сигнальных пептидов и содержатся в эпителиальных клетках. ИЛ-1ra — это чистый антагонист лиганда ИЛ-1, связывающегося с ИЛ-1R1, причем связывание ИЛ-1ra с ИЛ-1R1 не вызывает мобилизации ИЛ-1RAcP. Следовательно, хотя и ИЛ-1α/β и ИЛ-1ra связываются с ИЛ-1R1 с эквивалентной аффинностью, связь ИЛ-1R1 с ИЛ-RlacP многократно увеличивает аффинность для ИЛ- 1α/β, не влияя на аффинность для ИЛ-1ra.
Этот факт соответствует данным о том, что для полной антагонизации действия ИЛ-1 требуется огромный молярный избыток ИЛ- 1ra. Биологическая роль ИЛ- 1га, вероятно, состоит в подавлении опосредуемых ИЛ-1 воспалительных реакций, при этом у мышей с дефицитом ИЛ-1 га наблюдаются избыточные и стойкие воспалительные реакции.
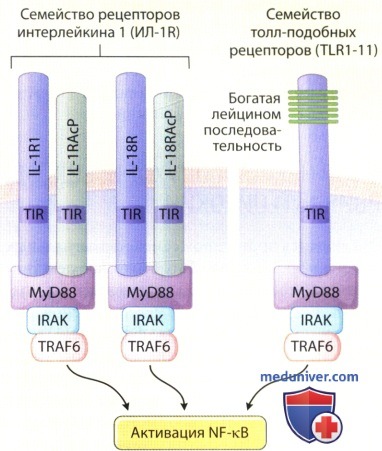
TLR используют общий межклеточный сигнальный путь.
Рецепторы цитокинов в семействе ИЛ-1 (типичные представители—рецепторы ИЛ-1 и ИЛ-18) имеют общий сигнальный домен cTLR (ot TLR1 до TLR11), который называется домен рецептора Toll/ИЛ-1 (TIR).
Рецепторы домена T1R взаимодействуют с содержащими домен TIR адаптерными белками, такими как MyD88,
которые соединяют связывание лигандов с активацией киназы, ассоциированной с ИЛ-1R (IRAK) и в итоге с активацией нуклеарного фактора кВ (NF-kB).
ИЛ-1 RAcP - вспомогательный белок ИЛ-1 R;
TRAF = фактор, ассоциированный с рецептором ФНО.
Вторым средством антагонизации активности ИЛ-1 является второй рецептор для ИЛ-1, а именно IL1-R2, имеющий короткий цитоплазматический домен и эффективно связывающий ИЛ-1α/β, но не ИЛ-lra. Данный рецептор с молекулярной массой 68 кДа отщепляется от клеточной поверхности неизвестной протеазой и высвобождается в форме стабильной молекулы с молекулярным весом 45 кДа, которая сохраняет функцию связывания авидного ИЛ-1.
Связывая функциональные лиганды для ИЛ-1Rl, ИЛ-1R2 служит для ингибирования опосредуемых ИЛ-1 реакций. Вероятно, ИЛ-1R2 ингибирует активность ИЛ-1 другим способом, то есть, посредством связывания с ИЛ-1RAcP на поверхности клетки, удаляя и секвестрируя его из пула, имеющегося в распоряжении для связывания с ИЛ-1R1. Таким образом, растворимый ИЛ-1R2 связывается со свободным ИЛ-1, в то время как ИЛ-1R2 на клеточной поверхности секвестрирует ИЛ-1RAcP. Экспрессия ИЛ-1RAcP может быть усилена рядом стимулов, включая кортикостероиды и ИЛ-4.
Однако ИЛ-1R2 может также индуцироваться воспалительными цитокинами, включая ИНФ-у и ИЛ-2, вероятно, в качестве компенсаторного сигнала, предназначенного для ограничения масштаба и длительности воспалительного ответа. Выработка ИЛ-1R2 делает продуцирующую клетку и окружающие ее клетки резистентными к опосредуемой ИЛ-1 активации. Интересно, что некоторые из наиболее эффективно производящих ИЛ-1 клеток являются лучшими продуцентами ИЛ-1R2.
ИЛ-18 был впервые идентифицирован на основании его способности индуцировать ИНФ-γ. Первоначально этому цитокину было присвоено название IL1 у из-за его гомологичности с ИЛ-1α и ИЛ-1β. Подобно ИЛ-1β, он транслируется как неактивная прекурсорная молекула весом 23 kd и расщепляется каспазой-1 на активные единицы весом 18 kd. ИЛ-18 синтезируется многими типами клеток кожи, включая кератиноциты, клетки Лангерганса и моноциты. ИЛ-18 вызывает пролиферацию, цитотоксичность и производство цитокинов посредством ТЫ и естественных киллерных (ЕК) клеток, часто синергично с ИЛ-12. Рецептор ИЛ-18 имеет поразительное сходство с рецептором ИЛ-112. Связующая цепь (ИЛ-18Л) является гомологом ИЛ- 1R1, исходно клонированным как ИЛ-1Rrp1.
С другой стороны, ИЛ-18R является низкоаффинным рецептором, который должен рекрутировать ИЛ-18RAcP (гомолог ИЛ-1 RAcP). Что касается ИЛ-1, то для передачи сигнала требуются обе цепи рецептора ИЛ-18. Хотя ИЛ-18 не имеет гомолога ИЛ-1га, молекула, известная под названием «связывающий ИЛ-18 белок», связывается со зрелым растворимым ИЛ-18 и мешает ему связываться с комплексом ИЛ-18R.
Недавно стало известно, что существует семейство рецепторов, гомологичных молекулам ИЛ-1R1 и ИЛ-18R, которые имеют общий мотив TIR. Все эти молекулы используют одни и те же аналоговые сигнальные пути, инициируемые адаптерными молекулами MyD88. Один из этих рецепторов, первоначально известный как ST2, был вначале определен как ген, экспресируемый клетками Th2, но не Th1.
Описание природного лиганда для ST2, который был обозначен как ИЛ-33, добавило еще один новый член к семейству ИЛ-1, который обладает теми же характерными чертами, что и другие цитокины этого семейства, в частности, необходимостью каспазы-1 для переработки и выделения зрелой формы лиганда. Стимуляция клеток Th2 посредством ИЛ-33 способствует производству характерных для Th2 цитокинов: ИЛ-4, ИЛ-5 и ИЛ-10. ИЛ-1Rl, ИЛ-18R, ИЛ-33R (ST2), толл-подобные рецепторы и их лиганды лучше всего рассматривать как элементы системы врожденного иммунитета, которые сигнализируют о присутствии опасности или травмы.
Когда производимый эпидермисом ИЛ-1 впервые идентифицировали, была отмечена его значительная активность и в интактном эпидермисе, и в роговом слое, что дало основание для предположения о том, что эпидермис является щитом из секвестрированного ИЛ-1, окружающего организм и ждущего своего высвобождения в случае травмы. Недавно было установлено, что высокие уровни ИЛ-1ra в кератиноцитах сосуществуют; однако, повторные эксперименты показывают, что практически во всех случаях количество присутствующего ИЛ-1 достаточно для преодоления любого ингибирующего потенциала, опосредуемого ИЛ-1ra. Недавно было показано, что при механическом стрессе кератиноцитов высвобождается большое количество ИЛ-1.
Высвобождение ИЛ-1 индуцирует экспрессию эндотелиальных молекул адгезии, включая Е-селектин, ICAM-1 и VCAM-1, а также хемотаксические и активирующие хемокины. Это привлекает не только моноциты и гранулоциты, но и специфическую субпопуляцию Т-клеток памяти, которые несут на своей клеточной поверхности кожный лейкоцитарный антиген. Т-клетки памяти, положительные для кожного лимфоцитарного антигена, в избытке присутствуют в воспаленной коже, составляя большинство из присутствующих в ней Т-клеток. Поэтому любая травма кожи, какой бы тривиальной она ни была, высвобождает ИЛ-1 и привлекает эту популяцию Т-клеток памяти. Если здесь они сталкиваются со своим антигеном в данной микросреде, их активация и последующее производство цитокинов способствуют усилению воспалительного ответа.
Данное явление рассматривается в качестве основного субстрата клинической картины воспаления в ответ на травму, известного как реакция Кебнера.
Разработано несколько биологических агентов, которые действуют путем ингибирования ИЛ-1. К ним относятся рекомбинантный антагонист рецепторов ИЛ-1 (анакинра), антитела к ИЛ-1β (канакинумаб) и IgG Fc гибридный белок, который содержит два домена, связывающиеся с рецепторами ИЛ-1 первого типа и вспомогательным белком этого рецептора (рилонацепт, также известный как ИЛ-1 trap). Все эти вещества эффективно подавляют воспаление, опосредованное ИЛ-1 и лежащее в основе группы редких аутоиммунных заболеваний, которые также называются криопирин-ассоциированными синдромами (CAPS). Анакинра была изначально одобрена FDA для лечения ревматоидного артрита у взрослых. Ингибирование функции ИЛ-1 для лечения подагры, воспалительного артрита, в основе которого лежит вызванная мочевой кислотой активация инфламмосом, которые синтезируют ИЛ-1, до сих пор остается объектом исследований.
- Рекомендуем далее ознакомиться со статьей "Цитокин фактор некроза опухоли (ФНО) и его рецепторы"
Оглавление темы "Цитокины иммунологии кожи.":- Пути передачи сигнала цитокинами кожи
- Нуклеарный фактор кВ (NF-kB), ингибитор кВ и первичные цитокины кожи
- Участие белков JAT и STAT в пути сигнала
- Цитокины семейства интерлейкинов-1: ИЛ-1, ИЛ-18, ИЛ-33
- Цитокин фактор некроза опухоли (ФНО) и его рецепторы
- Цитокины семейства ИЛ-17
- Семейство рецепторов гемотопоэтина (семейство рецепторов хемокинов класса I)
- Цитокины интерлейкин-2 (ИЛ-2) и интерлейкин-15 (ИЛ-15)
- Цитокины интерлейкин-4 (ИЛ-4) и интерлейкин-13 (ИЛ-13)
- Цитокины интерлейкин-9 (ИЛ-9) и интерлейкин-21 (ИЛ-21)

