Бактериальные инфекции кожи: причины, механизмы развития
Бактериальные инфекции кожи - краткий обзор:
- Бактерии вызывают заболевание за счет прямой инвазии в ткани, секреции токсинов и стимуляции иммунологического ответа, который приводит к развитию заболевания.
- Врожденный иммунитет играет ключевую роль в обеспечении адекватного ответа на внедряющиеся через кожу бактерии.
- Вирулентность и патогенность бактерий связаны с их способностью препятствовать активации врожденной иммунной системы или противостоять действию эффекторных клеток иммунной системы, направленному на уничтожение бактерий.
- Иммуносупрессия, особенно нейтропения, ставит организм в условия высокого риска бактериальных инфекций; некоторые инфекции возникают редко и лишь исключительно у лиц с иммуносупрессией.
- Учет особенностей организма и вирулентости возбудителя играет решающую роль для выбора безопасной и эффективной терапии бактериальных инфекций.
- Многие неинфекционные заболевания могут имитировать клиническую картину бактериальных инфекций. При проведении дифференциальной диагностики необходимо внимательно подойти к исключению неинфекционных заболеваний.
- Использование современных компьютерных ресурсов, касающихся тенденций развития устойчивости к антибиотикам, а также лучших практических рекомендаций имеет большое значение для выбора эмпирической противомикробной терапии.
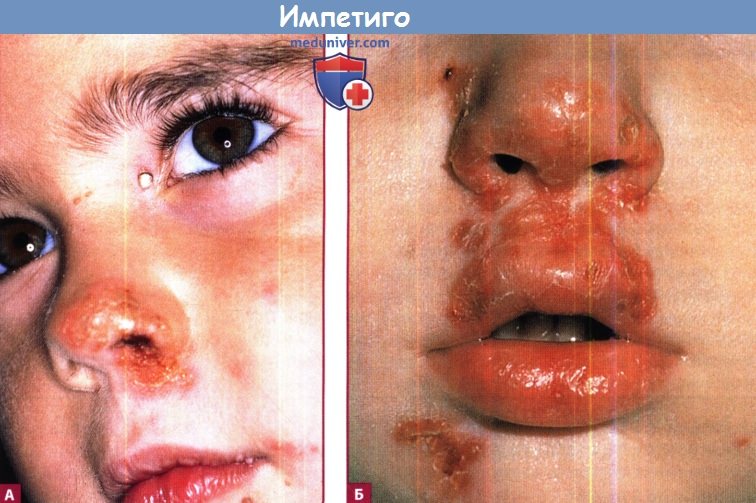
Эритема и корочки в области носа и рта (А), которые могут распространяться на центральную область лица (Б).
Совокупность микробов, живущих на теле и внутри тела человека, принято называть микробиомом человека. Одни виды микробов взывают заболевания, а другие (комменсалы) не являются болезнетворными. Микробном кожи представляет собой сложную и многообразную популяцию организмов, в которую входят многочисленные бактерии, как комменсальные,так и патогенные. Проект «Микробном человека» включает недавнее исследование с применением метагеномного секвенирования, которое описывает микробном кожи в непредставимых ранее подробностях. Многочисленные факторы, в том числе секреция кожного сала, анатомический участок тела, содержание жиров, уровень pH и секреция пота существенно влияют на рост бактерий на коже. Кожные болезни, такие как псориаз, также отражаются на составе микробиома кожи. Стало ясно, что на нашей коже в норме живет намного больше бактерий, чем считалось ранее.
Понимание факторов, влияющих на здоровье и патологию кожи, приведет к улучшению методов терапии и профилактики кожных инфекций и, возможно, многих других неинфекционных заболеваний кожи.
Бактериальные инфекции кожи можно разделить на четыре основные категории:
1) первичные инфекции кожи,
2) вторичное инфицирование первичных кожных поражений (например, инфицированный атопический дерматит),
3) кожные поражения, являющиеся проявлениями первичной инфекции в какой-либо другой системе органов, чаще всего крови, и
4) кожные реакции, обусловленные бактериальной инфекцией (например, узловатая эритема, связанная со стрептококковым фарингитом).
Таким образом, болезненное состояние кожи зависит от баланса иммунитета и размножения кожных бактерий. Конт ролируя такие заболевания как атопический дерматит, можно, несомненно, уменьшить количество кожных инфекций, развивающихся в поврежденной коже. С другой стороны, контроль инфекций кожи путем нанесения на нее антисептических средств и мази мупироцина, также может привести к ликвидации вспышки атопического дерматита.
При обследовании пациента важно помнить, что не все кожные инфекции являются гнойными, многие могут представлять собой реактивные ответы (напр., узловатая эритема). Также следует учитывать,что не все гнойные кожные проблемы являются первичными кожными инфекциями (напр., гнойный гидраденит). Кроме того, многие эритематозные кожные очаги вовсе не являются инфекционными (напр., застойный дерматит). Нельзя переоценить значение кожи как «зеркала» системной инфекции, особенно у пациентов с иммунодефицитом, у которых классические клинические симптомы могут быть искажены. Своевременное распознавание кожных проявлений бактериемии может явиться ключом к раннему распознаванию угрожающих жизни инфекций, обусловленных такими микроорганизмами, как Pseudomonas aeruginosa, Vibrio vulnificus, Salmonella typhi, Staphylococcus aureus и Neisseria meningitidis
Патогенез бактериальных кожных инфекций. Развитие и эволюция бактериальной инфекции определяются тремя основными факторами: 1) входными воротами; 2) защитными силами организма и воспалительным ответом на микробную инвазию; 3) патогенными свойствами микроорганизма.
а) Входные воротка бактериальной инфекции. Нормальная, интактная кожа у ребенка и взрослых людей относительно резистентна против инфекции, большинство инфекций возникают на фоне нарушения кожного барьера. Мацерации, повреждения, связанные с бритьем, хронические раны, расчесы зудящих укусов насекомых и разрушение эпидермального барьера под влиянием других патогенов служат основными причинами проникновения бактерий через кожный барьер. Например, травма кожи, мацерация в межпальцевом пространстве или дерматофития стоп могут быть предрасполагающими факторами целлюлита голеней у в остальном здоровых людей, не страдающих венозной недостаточностью нижних конечностей или язвой голени.
Характер кожного воспалительного ответа на бактерии оказывает влияние на процесс попадания микроорганизмов в пораженные области. Различные бактериальные инфекции кожи часто сопровождают местное воспаление и нагноение. При септицемии сосудистая стенка часто является основным очагом кожного поражения. Первыми проявлениями этого процесса являются кровоизлияния и тромбоз с инфарктами. Некоторые бактерии могут обусловливать бактериемию или поражения в отделенных очагах, не вызывая видимого воспалительного ответа во входных воротах [например, Yersinia pestis, Streptobacillus moniliformis (болезнь от укуса крыс)] даже у лиц с нескомпрометированной иммунной системой.
б) Природная резистентность кожи к инфекции. Нормальная кожа у здоровых лиц обладает высокой резистентностью против инвазии огромного количества бактерий, воздействию которых она постоянно подвергается. При интактных кожных покровах локализованная инфекция, такая как импетиго, фурункулез или целлюлит, как правило, не развивается. Обычно патогенные микроорганизмы, такие как S. pyogenes (стрептококк группы А, СГА) и S. aureus, вызывают появление характерных поражений — целлюлита и фурункулеза у лиц с нормальным иммунитетом при разрушении нормального кожного барьера. Для S. aureus наличие шелковых швов в 10000 раз снижает количество микроорганизмов, необходимое для формирования абсцесса в коже человека.
Бактерии не способны проникать через кератинизированные слои нормальной кожи, и при попадании на ее поверхность их количество быстро уменьшается. Мацерация и окклюзия, обусловливающие повышение pH, высокое содержание диоксида углерода и воды в эпидермисе приводит к драматическому увеличению количества бактериальной флоры. Некоторые бактерии, например, грамотрицательные бактерии, можно обнаружить лишь в таких измененных участках кожи, что свидетельствует о том, что нормальное состояние кожи предотвращает ее колонизацию. Относительная сухость нормальной кожи способствует значительному ограничению роста бактерий, особенно грамотрицательных палочек.
Липиды, имеющиеся на поверхности кожи, обладают антибактериальными свойствами. Уменьшение количества липидов на поверхности кожи под действием местных растворителей приводит к увеличению выживаемости S. aureus на поверхности кожи. Свободные жирные кислоты, линолевая и линоленовая, обладают большей ингибирующей активностью в отношении S. aureus, чем в отношении коагулозо-отрицательных стафилококков — компонента нормальной микрофлоры кожи. Было показано, что сфингозин, глюкозилцерамиды и цис-6-гексадеконевая кислота обладают антимикробной активностью против S. aureus. Конкурентное ингибирование, которое характерно для бактерий (супрессивный эффект одного вида бактерий на колонизацию другого вида), оказывает важное влияние на состав микрофлоры кожи.
Микроорганизмы, которые обычно выживают и размножаются в различных экологических нишах кожи, формируют «нормальную микрофлору кожи». В качестве примера можно привести данные о различном распределении разных видов коагулозо-отрицательных стафилококков в разных анатомических областях и зависимость их о тносительного числа от возраста. У взрослых S. epidermidis является основным видом стафилококков, который выделяется с волосистой части кожи головы, лица, груди и подмышечных областей. Исследование микробиома кожи взрослых людей показывает, что свыше 98% кожных бактерий принадлежит к четырем отделам, таким как: (1) актинобактерии (51,8%), (2) фирмикуты (24,4%), (3) протеобактерии (16,5%) и (4) бактероидеты (6,3%).
Хотя 205 родов были идентифицированы только у 20 человек, три из них ассоциировались с более чем 62% последовательностей: (1) Corynebacteria (22,8% актинобактерий), (2) Propionibacteria (23,0% актинобактерий), и (3) Staphylococci (16,8% фирмикутов).
1. Пептиды с антимикробными свойствами. Кожа человека содержит большое разнообразие белков, которые от природы обладают антимикробными свойствами. Эти антимикробные пептиды (АМП) имеются на поверхности кожи, а также присутствуют в экзокринных потовых железах и слюне. АМП синтезируют активированные кератиноциты. Образовавшиеся в кератиноцитах АМП доставляются на поверхность кожи пластинчатыми тельцами, и их появление на кожной поверхности тесно связано с процессом синтеза липидов рогового слоя в нормальной коже. Характерным свойством этих низкомолекулярных белков является амфифильная структура, которая определяет их характерные физические свойства. Одна часть молекулы АМП является катионом и может связываться с микробными мембранами, а другая часть является гидрофобной и обеспечивает проникновение в липидную мембрану бактерий.
Проникновение в мембрану приводит к ее разрушению и гибели микробов. Второй характерной особенностью АМП является то, что после попадания на поверхность кожи они метаболизируются за счет ферментов.
В результате образуются многочисленные пептиды, обладающие разной активностью и воздействующие на различные мишени. Третьей особенностью АМП является то, что они не просто напрямую убивают микробы, но также являются мощными активаторами иммунного ответа организма. На коже находятся десятки АМП, обладающих активирующим действием. К настоящему времени было изучено два основных вида АМП, присутствующих на поверхности кожи, — (1) кателициджины (LL-37) и (2) дефенсины. Выраженное снижение содержания этих молекул на воспаленной коже у пациентов с атопическим дерматитом объясняет подверженность инфекциям, вызываемых S. aureus,вирусом простого герпеса и вирусом осповакцины. Цитокины Т-хелперов 2 типа специфически подавляют продукцию этих АМП, что объясняет, почему при псориазе содержание АМП на коже в норме или повышено, и она при этом менее подвержена бактериальным и вирусным инфекциям.
2. Специфические особенности воспалительного ответа организма при инфекциях кожи. Адаптивный иммунный ответ, который требует для своего развития наличия клеток-мишеней и формирования антител, является высоко эффективным для защиты человека от инфекций, если произошло формирование эффекторных клеток и антител. Однако этот процесс занимает несколько дней, а для размножения и вторжения бактерий нужно несколько часов. Теория «врожденного» иммунитета объясняет способность организма обеспечивать эффективный и целенаправленный иммунный ответ в отношении микробов до того, как в действие вступит адаптивная иммунная система. Врожденный иммунитет имеется у растений, беспозвоночных и позвоночных. Эта система работает за счет «рецепторов, распознающих сигнал», узнающих «характерные для патогена молекулярные структуры», которые в «самом» организме отсутсвуют.
Связывание рецепторов, распознающих сигнал с характерными для патогена молекулярными структурами, приводит к опсонизации и активации системы комплемента, а также к индукции воспалительного сигнального молекулярного механизма. Этот процесс включает как минимум три рецептора, распознающих сигнал:
1) АМП, описанные в разделе по антимикробным пептидам,
2) Toll-подобные рецепторы (TLR) и
3) систему комплемента.
Эти три системы воспринимают бактерии при их попадании на кожу и за счет взаимодействия между ними, а также при участии сигнальных нейтрофилов и других иммунных клеток, которые выполняют незаменимую функцию, заключающуюся в доставке к месту инфицирования клеток, необходимых для разрушения патогенов.
TLR представляют собой целый спектр рецепторов, распознающих сигналы. Они экпрессируются на мембранах клеток и распознают некоторые экзогенные лиганды, характерные исключительно для вторгающихся микроорганизмов и отсутствующие в организме. Они играют ведущую роль в качестве первичных сенсоров, воспринимающих вторгающиеся патогены. Например, TLR распознают флагеллин, характерный исключительно для жгутиковых бактерий, a TLR2 распознают пептидогликан на поверхности грамположительных бактерий. Эти структурные элементы вторгающихся микроорганизмов являются ключевыми факторами, обеспечивающими их патогенность, поэтому с эволюционной точки зрения их элиминация является сложной задачей. TLR не только связывают возбудителя, но также определяют, как именно тип иммунного ответа будет формироваться против специфического патогена. Это достигается за счет того, что TLR инструктируют антиген-презентирующие клетки, чтобы те создавали необходимую иммунологическую среду и генерировали последующий адаптивный иммунный ответ. Другие каскадные сигнальные пути могут приводить к формированию различных иммунных ответов при вовлечении одинаковых TLR.
Активация комплемента происходит при взаимодействии маннин-связывающего лектина с набором углеводов на поверхности бактерий, за счет чего активируются компоненты С2 и С4. Активация С3 приводит к высвобождению С3а и С3b. С3b на мембранах вызывает опсонизацию и активацию фагоцитоза. Кроме того, расщепление С5 обеспечивает образование С5а — мощного активатора нейтрофилов и стимулятора провоспалительных цитокинов, включая интерлейкин-1 (ИЛ-1) и ИЛ-8. «Мембран-атакующий комплекс» формируется при активации каскада комплемента и убивает вторгающиеся микроорганизмы. Неудивительно, что компоненты комплемента также модулируют иммунный ответ и влияют на некоторые активирующие сигнальные пути, стимулируемые TLR. За счет обширного репертуара возможных исходов человеческий организм способен вырабатывать специфичный в отношении конкретного микроорганизма ответ при встрече с огромным разнообразием инфекционных агентов, с которыми организм прежде не сталкивался.
Кроме того, врожденный иммунитет за счет системы комплемента и TLR управляет адаптивным иммунным ответом и обеспечивает адекватную реакцию на вторгающийся микроб. Такой тонкий механизм врожденного иммунного ответа объясняет разнообразие клинических ответов на разные бактериальные инфекции. Инфекционный агент, анатомическая область, которая подверглась инфицированию, и характер возникающего воспалительного ответа формируют спектр клинических проявлений.

в) Патогенность микроорганизмов. Для того чтобы эффективно внедриться в организм, микроорганизм должен получить к нему доступ. S. aureus обладает тейхоевой кислотой и другими поверхностными белками, которые способствуют адгезии к слизистой оболочке носа. Бактерии могут контаминировать любые места кожных повреждений, связываясь с фибронектином в ранах. Способность бактерий вызывать заболевание объединено в понятие «вирулентность». Генетический материал, кодирующий факторы вирулентности и токсины, содержится в подвижных генетических элементах, которые носят название «островков патогенности». Бактериофаги переносят генетические элементы от одной бактерии к другой (например, лейкоцидин Пантона-Валентина). Лейкоцидин Пантона-Валентина представляет собой цитотоксин, направленный против иммунных клеток человека. Он ассоциируется с глубоко расположенными и интенсивно воспаленными фурункулами, а сейчас обнаружена корреляция этого цитотоксина с устойчивым к метициллину золотистым стафилококком S. aureus (MRSA).
Важно отметить, что до 37% пациентов с гнойными внебольничными инфекциями MRSA колонизированы микроорганизмом на другом анатомическом участке. Кроме того, многие виды бактерий содержат элементы ДНК в своем собственном геноме, которые обладают специфической способностью уклоняться от воздействия врожденного иммунного ответа организма, инактивировать или подавлять его. В частности, это достигается за счет обеспечения резистентности против нейтрофилов-киллеров и экскретируемых продуктов. Эти генные элементы, отвечающие за резистентность к атакам иммунитета организма, обычно обусловливают формирование состоящего из двух белков каскада, включающего белок-сенсор и белок, обеспечивающий ответ. Эта система носит название двухкомпонентной генной регуляторной системы. В случае S. aureus имеются многочисленные специфические вещества, направленные против каждого атакующего элемента врожденной иммунной системы организма. Стафиллокиназа (САК) инактивируют дефенсины. Аэролизин А расщепляет LL-37. Ген oatA кодирует мембранный белок, который обеспечивает резистентность лизосом. S. aureus является каталозо-положительным микроорганизмом, желтый пигмент S. aureus (каротеноиды) защищает его от гибели под действием окислительных реакций, обусловленных нейтрофилами. САК также активирует образование плазмина из плазминогена. Плазмин на поверхности клетки расщепляет С3b и иммуноглобулин G, за счет чего происходит удаление важных опсонизирующих молекул с бактериальной поверхности. Белок S. aureus, ингибирующий хемотаксис, связывается с С5а, что приводит к блокированию активации нейтрофилов.
Ингибитор системы комплемента стафилококка связывается с С3-конвертазой на поверхности бактерий, что предотвращает образование С3 и активацию каскада системы комплемента. САК, белок S. aureus, ингибирующий хемотаксис, и стафилококковый ингибитор комплемента закодированы в одних и тех же островках патогенности.
Хотя различать заболевание, связанное с токсинами, и заболевание, связанное с прямой инвазией и факторами вирулентности, достаточно важно, большинство бактериальных инфекций обусловлены сочетанием инвазивных и токсигенных свойств организма. В качестве примера инфекций, при которых локально секретируемые токсины являются инструментом для формирования характерных поражений, можно привести инфекции, вызванные S. aureus (буллезное импетиго), Corynebacterium diphtheriae и Bacillus anthracis. Системные проявления секреции токсина наблюдаются в случае стафилоккового ожогоподобного кожного синдрома и столбняка. В случае С. perfringens выработка различных внеклеточных токсинов и ферментов (а-токсин или лецитиназа, протеазы, коллагеназы),по всей видимости, играет важную роль в формировании быстро распространяющихся кожных повреждений и в появлении системных проявлений обусловленного клостридиями некроза миоцитов.
S. pyogenes, в частности СГА, также содержит многочисленные гены, которые помогают ему уклоняться от воздействия иммунной системы. Эти гены могут быть расположены в самом геноме, например, М протеин, который предотвращает фагоцитоз, обеспечиваемый нейтрофилами, или передаваться профагами, как, например, в случае эндотоксина А. Синтез ДНК-азы SdaD2 защищает СГА от гибели под действием внеклеточных механизмов, регулируемых нейтрофилами в экстрацеллюлярных нейтрофильных ловушках, что играет важную роль в прогрессировании кожных инфекций. Тканевая инвазия и системное распространение патогена усиливаются стрептокиназой. Стрептокиназа СТА обладает активностью только в отношении человеческого плазминогена, что может быть критичным для ограничения инфекции, вызванной СГА в организме человека. Тенденция к наличию общего генетического материала, содержащего эти факторы вирулентности, у разных штаммов стрептококков привела к тому, что ограничения некоторых проявлений заболевания для различных типов стрептококков стали нечеткими. Например, в настоящее время в ряде регионов стрептококки группы G являются основной причиной фарингита и содержат такие же гены вирулентности, которые обусловливают способность СГА вызывать это состояние.
Грамотрицательные бактерии (Escherichia coli, S. typhi, N. Meningitidis, N. Gonorrhoeae, Brucella melitensis и др.) содержат эндотоксин, комплекс фосфолипидно-полисахаридных макромолекул [липополисахариды (ЛПС)], который является интегральной частью клеточной стенки бактерий. Эндотоксины в отличие от экзотоксинов высвобождаются только после разрушения стеки бактерии. Их токсичность, вероятно, обусловлена, прежде всего, липидной фракцией, в то время как их антигенные детерминанты являются свойством полисахаридного компонента. К настоящему времени было получено большое количество информации о механизмах реализации биологических эффектов ЛПС при системных инфекциях, вызываемых грамотрицательными бактериями, или при тяжелых локализованных инфекциях, которые также могут вызвать септический синдром. Эти эффекты являются как токсическими, так и иммунологическими. Активированные под действием ЛПС, макрофаги синтезируют два цитокина, которые играют наиболее важную роль в развитии токсических и провоспалительных эффектов ЛПС: (1) фактор некроза опухолей (ФНО) и (2) ИЛ-1. ФНО является инициатором каскада провоспалительных цитокинов. ФНО ак тивирует систему свертывания крови за счет влияния на эндотелий сосудов и снижает артериальное давление и тканевую перфузию вследствие снижения сократительной способности миокарда и расслабления гладких мышц. Высокие циркулирующие уровни ФНО выявляются у пациентов с менингококцемией и другими формами тяжелого сепсиса.
Инфузия только высоких концентраций очищенного ФНО может привести к развитию шока и к смерти. Считается, что способность ЛПС посредством продукции ФНО индуцировать адгезию лейкоцитов к эндотелию капилляров и отложение фибрина лежат в основе формирования геморрагических некротических изменений кожи (с или без прямой бактериальной инвазии), что иногда наблюдается на фоне бактериемии, обусловленной грамотрицательными палочками, и в частности характерно для менингококцемии. Фульминантная пурпура развивается у 10-20% пациентов при тяжелом менингококковом сепсисе. В тяжелых случаях возможно развитие тромбоза крупных сосудов и инфарктов пальцев.
г) Изменяющиеся характеристики бактериальных инфекций кожи. Три фактора привели к увеличению распространенности и вирулентности бактериальных инфекций. Во-первых, появились новые патогены, такие как Bartonella sp., которые ранее не были известны как возбудители болезней человека. Во-вторых, бактериальные инфекции стало сложнее лечить вследствие приобретения ими новых факторов вирулентности и резистентности к антибиотикам. В-третьих, наблюдается постоянное увеличение числа пациентов с имуносупрессией в связи с увеличением популяции пожилых людей, ослабленных лиц и ВИЧ-инфицированных, а также лиц с ятрогенной иммуносупрессией. Помимо обычных патогенов, различные «непатогенные» члены микрофлоры кожи могут вызывать заболевания у ослабленных индивидов и лиц с нарушенными гуморальными или клеточными механизмами защиты. Например, гангренозная эритема, связанная с местной или системной деструктивной инвазией кожи, практически всегда наблюдается в условиях нейтропении. При наличии иммуносупрессии транзиторный самоограничивающийся фолликулит вызывается тем же самым микроорганизмом. В. henselae вызывает болезнь кошачьих царапин — самоограничивающееся расстройство, которое возникает в организме со скомпрометированной иммунной системой.
У пациентов с прогрессирующим СПИДом (CD4 < 50), B. henselae вызывает развитие бациллярного ангиоматоза и системное поражение, которое при отсутствии лечения приводит к летальному исходу.
д) Влияние гиперчувствительности к бактериальным антигенам на воспалительный ответ в коже. Способность бактерий индуцировать иммунологические реакции в различных частях организма объясняет некоторые синдромы. Обострения атопического дерматита, связанные с S. aureus, могут быть обусловлены изменениями цитокинового профиля в кожных поражениях, индуцированных бактериальной инфекцией. Аналогичным образом стрептококковая инфекция зева может вызывать иммунологический ответ, который служит триггером для псориаза за счет активации иммунной системы.
е) Состояние нейтрофилов как проявление кожного ответа на системную инфекцию. Воспалительные изменения вокруг мелких кровеносных сосудов кожи могут иметь место при многих инфекциях, сопровождающихся бактериемией, при отсутствии явной колонизации бактерий в этих участках.
В качестве примера можно привести папулярные и петехиальные элементы при хронической менинкококцемии, диссеминированной гонококковой инфекции, возникновение лейкоцитокластического васкулита после адекватно пролеченного эндокардита (вероятно, обусловленного циркулирующими иммунными комплексами). Поражения при синдроме Свита и ранняя узловатая эритема могут возникать на фоне выраженной тканевой нейтрофилии, хотя очаг исходной инфекции (например, стрептококковый менингит) может быть расположен далеко. Узелки Ослера и петехии при подостром бактериальном эндокардите, вызванном зеленящим стрептококком, возможно, являются самым лучшим примером этой связи между васкулитом мелких сосудов и бактериемией. Гистологически эти поражения в большей степени можно описать как связанные с васкулитом, чем с эмболией. Случаи возникновения распространенных поражений такого типа на нижних конечностях подтверждают скорее концепцию кожного сосудистого воспаления и не свидетельствуют в пользу эмболизации.
- Рекомендуем далее ознакомиться со статьей "Классификация бактериальных инфекций кожи и их диагностика"
Редактор: Искандер Милевски. Дата публикации: 18.3.2019

