УЗИ при чрескожной лазерной абляции (ЧЛА) щитовидной железы
Чрескожная лазерная абляция (ЧЛА) и радиочастотная абляция (РЧА) — минимально инвазивные процедуры, предназначенные для гипертермического разрушения узлов и опухолей ЩЖ без их хирургического удаления. Степень термических повреждений ткани зависит как от достигнутой в ткани температуры, так и от продолжительности воздействия.
К примеру, нагрев ткани до 50-60 °C на протяжении 4-6 мин приводит к необратимым изменениям клеток и их гибели; нагрев до 60-100 °C — к практически мгновенной коагуляции тканей с необратимыми повреждениями клеток и их ферментного аппарата; при температурах свыше 100-110 °C вся жидкость из ткани испаряется и ткань карбонизируется.
Потенциальные преимущества in situ абляции опухолей: снижение стоимости лечения, уменьшение частоты возникновения осложнений, возможность лечения пациентов в амбулаторных условиях, а также возможность провести лечение пациентам с противопоказаниями к хирургическому вмешательству: преклонного возраста, с сопутствующими заболеваниями и большими опухолями. Все виды абляции ЩЖ проводя г под контролем УЗИ в режиме реального времени.
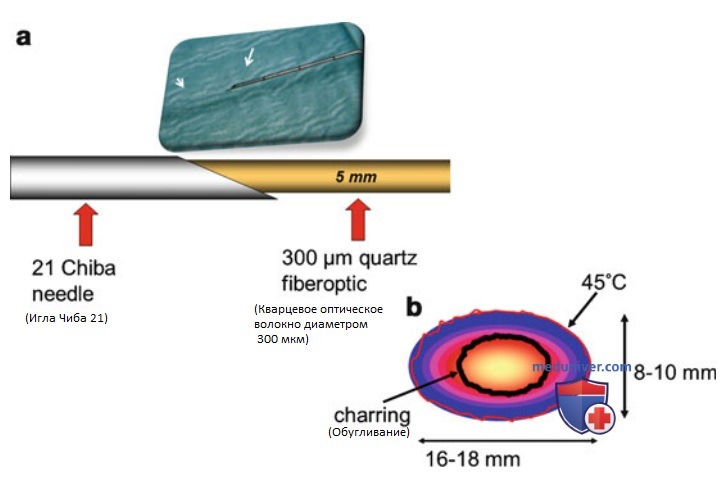
а) Лазерная абляция. Аббревиатура LASER расшифровывается как Light Amplified Stimulated Emission of Radiation, то есть усиление света посредством вынужденного излучения. Устройство генератора лазерного излучения продемонстрировано на рис. 1. При абляции тканей лазерным излучением последнее направляют непосредственно в ткани через оптоволокно. Лазер позволяет прецизионно и контролируемо доставлять пучок высокоэнергетичных фотонов в четко определенную зону (рис. 2). В настоящее время доступно множество источников лазерного излучения с различными длинами волн, оптоволоконными световодами, модифицированными наконечниками световодов и аппликаторами.
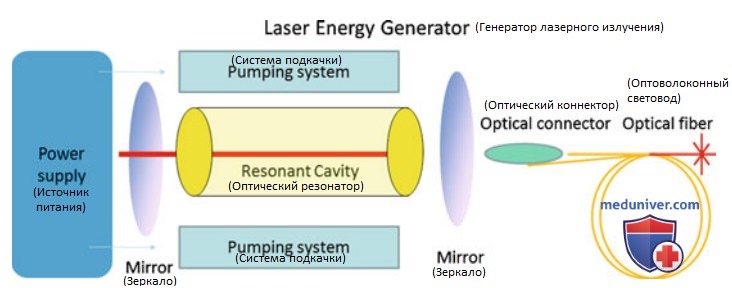
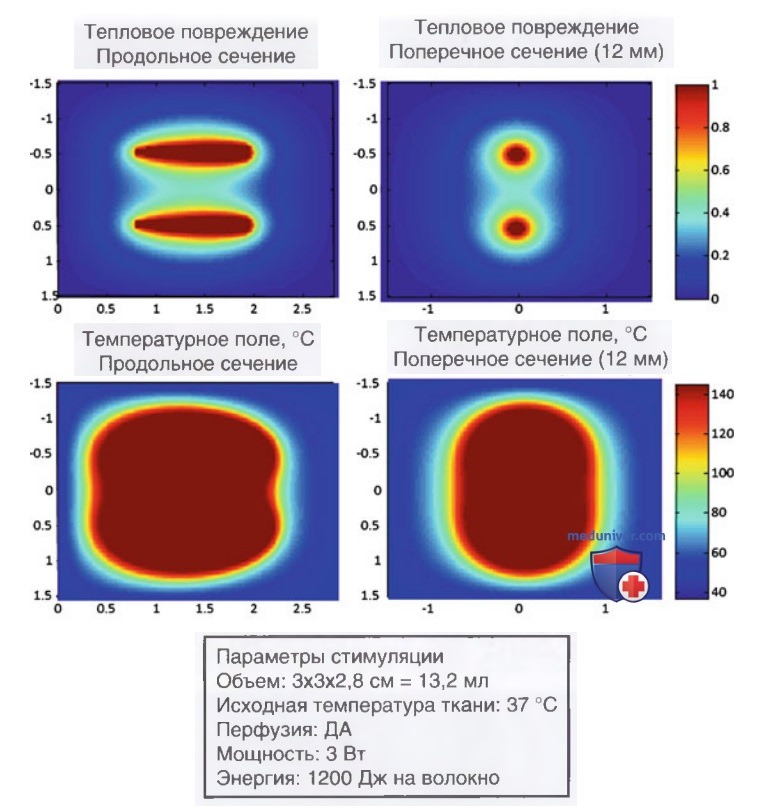
Поскольку проникающая способность лазерного излучения оптимальна в ближнем ИК-диапазоне, для ЧЛА используют лазеры на лигированном неодимом алюмоиттриевом гранате (Nd:YAG), а также диодные твердофазные лазеры с длиной волны 820-1064 нм. Высокоэнергетичные фотоны разрушают ткань посредством испарения и обугливания в непосредственной близости от излучающего торца оптоволокна с формированием зоны коагуляции (УЗ-картина представлена на рис. 3). Поглощение тепла максимально в точке приложения его источника; по мере удаления от нее тепловая энергия быстро рассеивается в окружающих тканях.
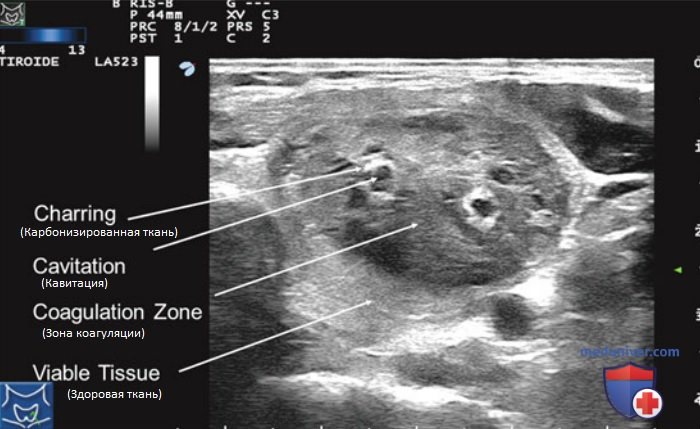
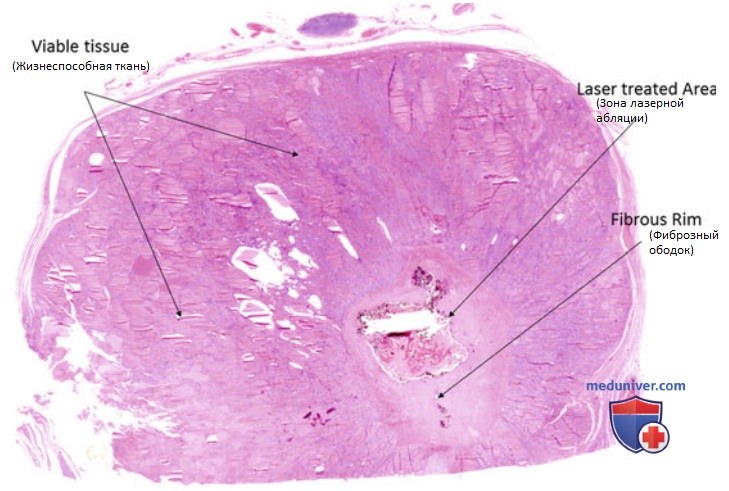
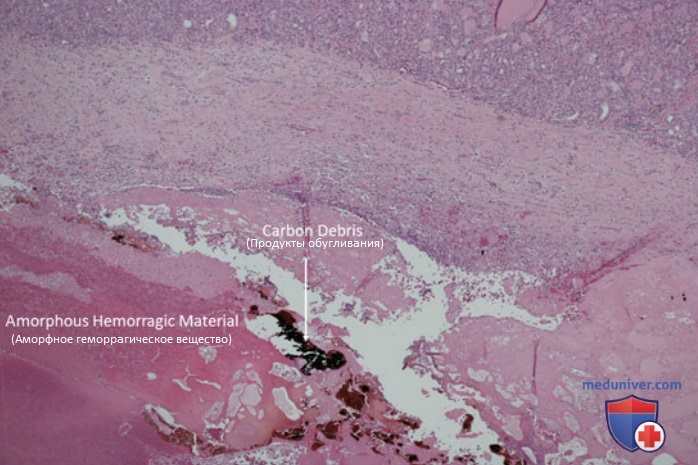
Процесс гибели клеток в подвергнутом лазерной абляции очаге может продолжаться на протяжении 72 ч после окончания процедуры за счет продолжающейся коагуляции капилляров и ишемического некроза. Микроскопически зона коагуляции окружена ободком тканей с обратимыми повреждениями, который отделяет некротизированную и жизнеспособную ткани. На рис. 4 показан рассеченный макропрепарат узла, удаленного спустя 1 мес после ЧЛА. Определяются зоны обугливания и коагуляции. Медленная реабсорбция зоны коагуляции с последующим развитием фиброза обусловливает уменьшение размеров узла после ЧЛА.

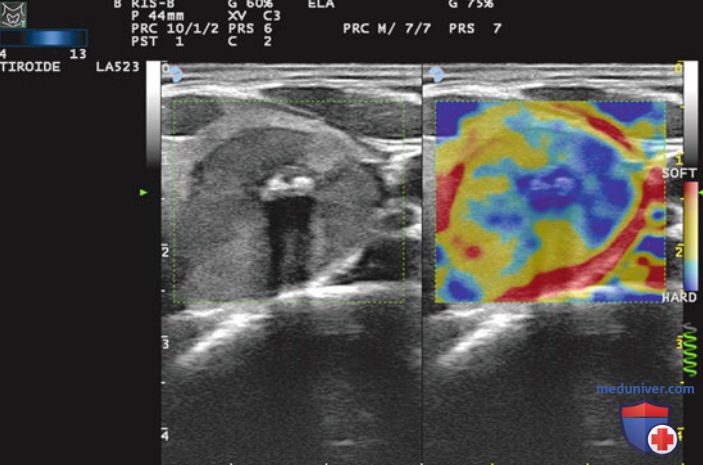
Авторы данной статьи на сайте описали микроскопические особенности доброкачественных узловых поражений ЩЖ после ЧЛА. На рис. 5 и 6 продемонстрирована микроскопическая картина зон абляции — аморфных участков с некротическим и геморрагическим содержимым, четко отграниченных от окружающей ткани фиброзной капсулой. Патологических изменений в окружающей паренхиме ЩЖ не выявляется. Эластографически фиброзные изменения визуализируются как участки ткани повышенной жесткости (рис. 7).
Обугливание является основной причиной снижения теплопроводности ткани, что в свою очередь приводит к уменьшению размеров зоны коагуляции. Также следует отметить, что коагуляционный некроз снижает проникающую способность лазерного излучения приблизительно на 20% и в нормальной, и в опухолевой ткани. Световоды с оголенным оптоволокном позволяют полностью некротизировать сферические участки тканей диаметром 12-16 мм. Размеры зоны некроза можно увеличить за счет одновременного введения нескольких волокон вокруг опухоли, но не перемещением одного волокна, как ранее предполагали некоторые авторы.
б) Лазерная абляция при лечении заболеваний щитовидной железы. В качестве альтернативы традиционной операции для лечения доброкачественных солидных образований ЩЖ могут использоваться амбулаторные интервенционные процедуры под контролем УЗИ. Их использование стало возможно благодаря развитию техники УЗИ-ТАБ, что кардинально снизило необходимость в диагностических операциях на ЩЖ для исключения злокачественного поражения. Согласно рекомендациям АТА 2009 г. по узловому зобу и высокодифференцированному раку ЩЖ, в зависимости от размеров, скорости роста узла и наличия компрессионных симптомов методом выбора при лечении доброкачественных солидных образований ЩЖ может быть наблюдение, гемитиреоид- или тиреоидэктомия.
Рекомендации объединенного экспертного сообщества ААСЕ, Итальянской ассоциации клинических эндокринологов и Европейской тиреоидологической ассоциации 2010 г. впервые ввели интервенционные процедуры под контролем УЗИ в качестве одного из вариантов лечения доброкачественных узловых поражений ЩЖ. Основная цель локальных малоинвазивных вмешательств — вызвать уменьшение размеров солидного узла ЩЖ с использованием для разрушения ткани энергии, генерируемой различными физическими процессами. Несмотря на то что методом выбора при лечении кистозных образований ЩЖ по-прежнему является чрескожная склеротерапия этанолом (ЧСЭ) под контролем УЗИ, для лечения солидных узлов данный метод более не рекомендуется. Абляция узлов ЩЖ при помощи высокочастотного ультразвука была успешно опробована на овцах; в отношении патологии ЩЖ человека был опубликован единичный случай использования этого метода для лечения функционально-автономного узла щитовидной железы (ФАУ ЩЖ).
Впервые проведенная Пацелла (Pacella) и соавт. ЧЛА исторически стала первым методом термической абляции. С тех был проведен ряд исследований (в том числе контролируемых) эффективности ЧЛА в лечении «холодных», «горячих» и кистозных образований ЩЖ. Проведенные исследования продемонстрировали эффективность и безопасность ЧЛА в лечении вышеперечисленных узловых образований ЩЖ (табл. 1). Авторы этой статьи используют ЧЛА у пациентов с доброкачественными «холодными» узловыми поражениями ЩЖ с 2002 г. (Реджо-Эмилия, Италия).
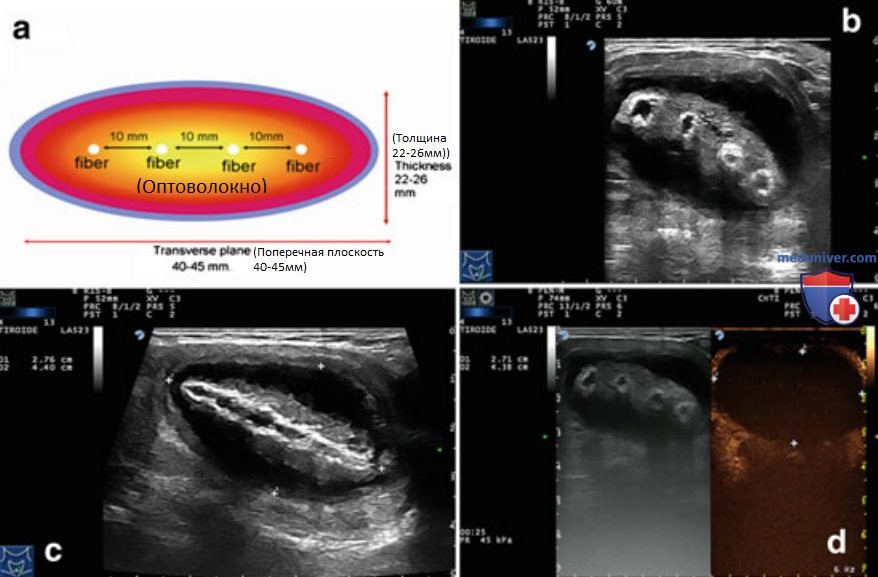
в) Техника проведения чрескожной лазерной абляции. ЧЛА выполняется амбулаторно натощак. ЧЛА с использованием плоского наконечника предложена и разработана Пацелла и соавт.. Оптическое волокно диаметром 300 мкм с плоским наконечником вводят через просвет биопсийной иглы 21 G типа Чиба таким образом, что формируется 5-миллиметровая зона непосредственного контакта оголенного наконечника оптоволокна с тканью ЩЖ (рис. 8). При абляции узловых образований ЩЖ эллипсоидную (то есть соответствующую по форме большинству узлов ЩЖ) зону деструктивных изменений формируют, вводя в железу в краниокаудальном направлении несколько оптоволокон на расстоянии 10 мм друг от друга (рис. 9).
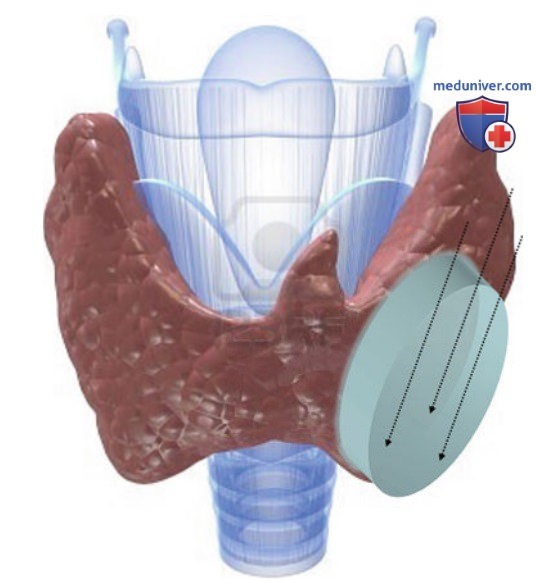
При абляции узлов ЩЖ можно использовать модификацию стандартной методики абляции образований печени, когда световоды располагаются в виде квадрата; в зависимости от формы и размера узла ЩЖ для достижения максимального эффекта световоды необходимо располагать в виде треугольника или линии. Использование четырех оптических волокон в сочетании с устройствами для протяжки оптоволокна позволяет достичь объема абляции до 30 мл за один сеанс (рис. 10).
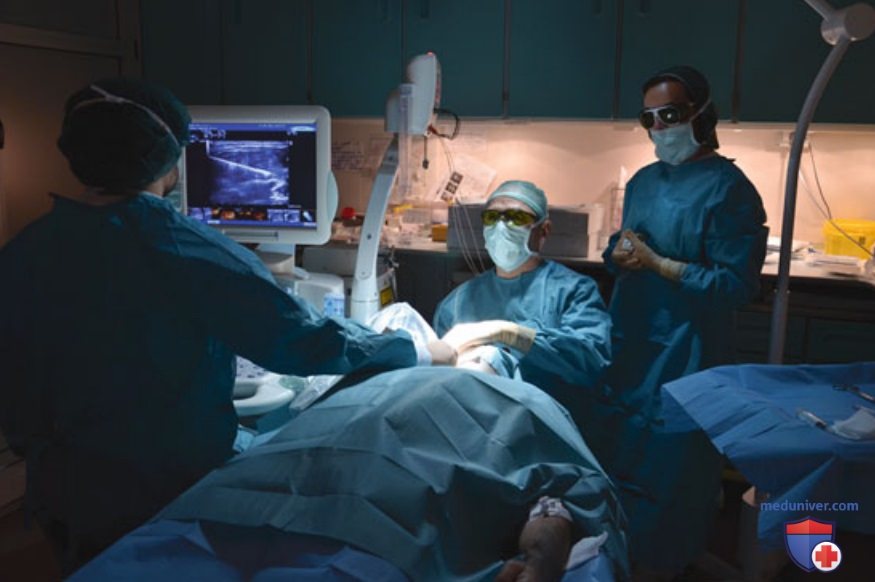
г) Проведение процедуры абляции узловых образований щитовидной железы. Цель процедуры ЧЛА — достижение максимального объема абляции за один сеанс в амбулаторных условиях. Пациента укладывают на операционный стол в положении лежа на спине с запрокинутой головой. Врач располагается за головой пациента, контролируя проведение процедуры в режиме реального времени на мониторе, закрепленном на стойке у ног пациента. Настройку режима УЗИ и манипуляции датчиком выполняет ассистент, стоящий по правую руку пациента. Вспомогательные функции в процессе проведения процедуры выполняет медсестра. Абляцию проводят в темноте; бестеневая лампа используется только для введения игл (рис. 11).
УЗИ в режиме реального времени используется для мониторинга процедуры на всех ее этапах. С 2002 по 2008 г. в Реджо-Эмилия (Италия) авторы использовали для ЧЛА лазер на лигированном неодимом алюмоиттриевом гранате с длиной волны 1064 нм, оснащенный светоделительной призмой на 4 оптоволокна (DEKA M.E.L.A., Флоренция, Италия). С 2009 г. авторы перешли на новую систему EcholaserX4® (Elesta, Флоренция, Италия), в которой лазерные и УЗИ-модули интегрированы в единую установку, сцециально предназначенную для проведения лазерной абляции под контролем УЗИ. EcholaserX4* позволяет использовать до четырех независимо настраиваемых и активируемых источников излучения. Это позволяет легко подогнать размеры и форму зоны абляции к размерам и форме узла (рис. 12).

Для определения объема зоны абляции до и после процедуры проводят УЗИ с контрастным усилением и использованием Sonovue (микропузырьки гексафторида серы), который вводят при болюсной внутривенной инъекции (рис. 13). Это исследование противопоказано пациентам с ишемической болезнью сердца, во всех остальных случаях побочные эффекты возникают крайне редко.
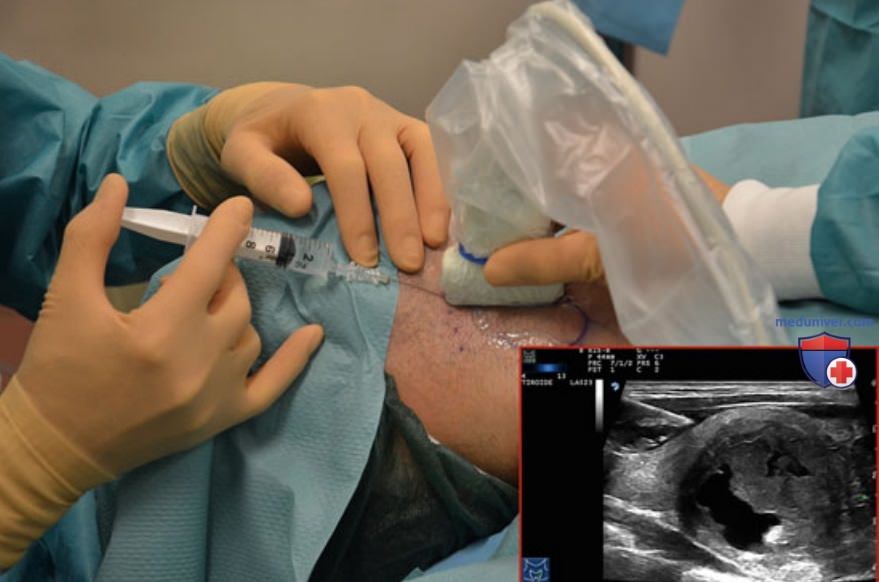
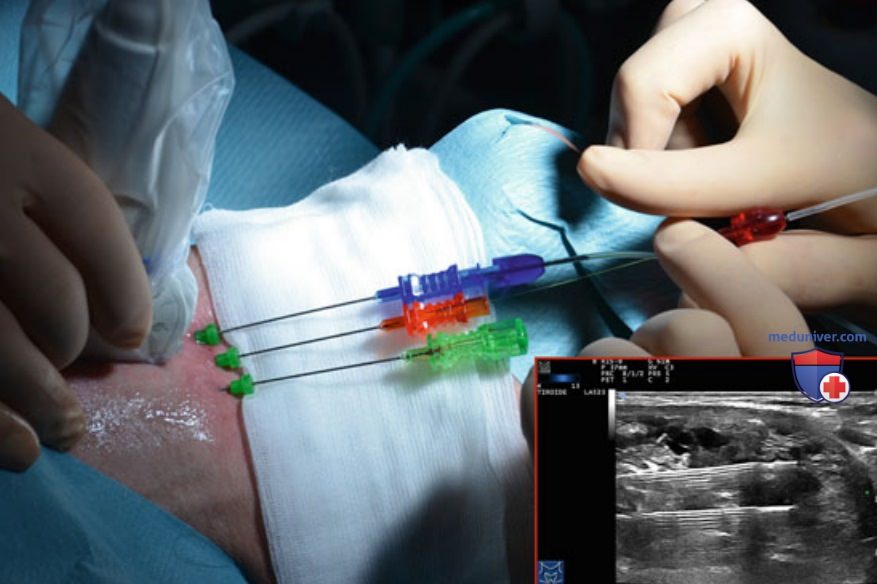
Для седации пациента при сохраненном сознании используется внутривенное болюсное (фракционированное) введение мидазолама (2-5 мг). В операционной должны быть приготовлены все препараты и оборудование, необходимые для реанимационных мероприятий, в том числе дефибриллятор. Несмотря на то что присутствие анестезиолога в большинстве случаев не требуется, процедуру ЧЛА рекомендуется проводить в стационарах с отделениями реанимации и интенсивной терапии и хирургии органов головы и шеи. Местное обезболивание проводят путем инфильтрационной анестезии 2-5 мл 2% раствора гидрохлорида (Ропивакаин) подкожно и под капсулу ЩЖ с использованием тонкой иглы (27 G), обезболивание проводят под контролем УЗИ (рис. 14). Биопсийные иглы 21 G типа Чиба вручную вводят вдоль длинной краниокаудальной продольной оси узла на расстоянии 10 мм друг от друга таким образом, чтобы суперпозиция зон абляции каждого волокна максимально соответствовала размерам и форме узла (рис. 15). Сразу после введения волокон включают лазер.
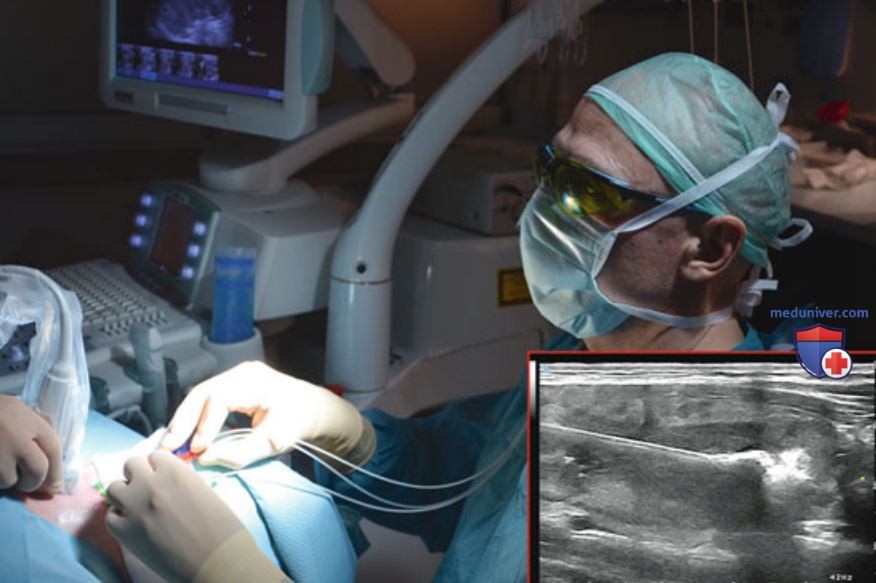
Абляцию проводят при начальной энергии 1200-1800 Дж/волокно и средней выходной мощности 3 Вт (диапазон от 2 до 4 Вт) с нижнего полюса узла на расстоянии 10 мм от его границы. После возбуждения лазера нагрев тканей и испарение жидкости приводят к формированию зон резко повышенной эхогенности, постепенно увеличивающихся в размерах вплоть до слияния зон абляции индивидуальных волокон друг с другом (рис. 16). На протяжении всей процедуры осуществляют визуальный контроль каждого источника излучения при помощи проводимого врачом УЗ-диагностики или ассистентом УЗ-мониторинга в режиме мультипланарной визуализации (поперечная и продольная плоскости сканирования). После абляции в области нижнего полюса узла иглы со световодами перемещают на 10 мм в направлении краниального полюса, после чего проводят вторую абляцию. Циклы перемещения/абляции повторяют до достижения иглой со световодом положения в узле на расстоянии 5 мм от его краниального полюса (рис. 17).
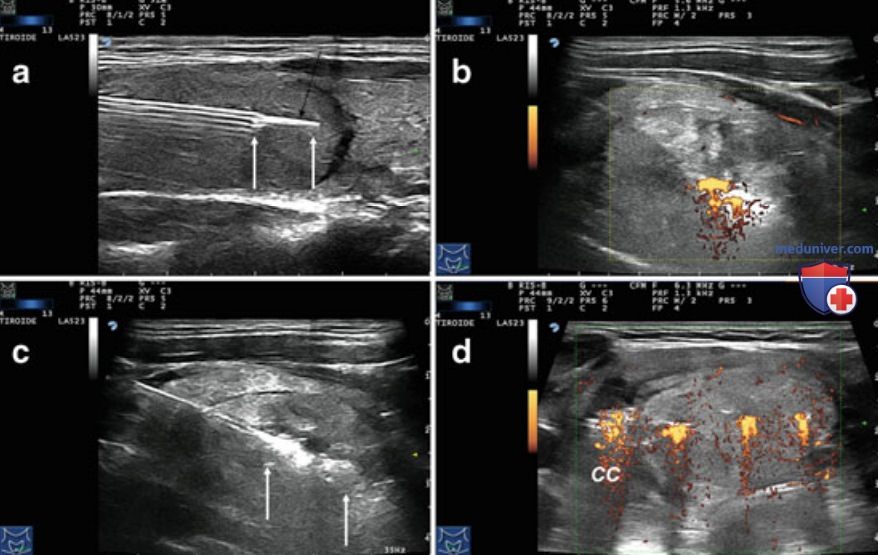
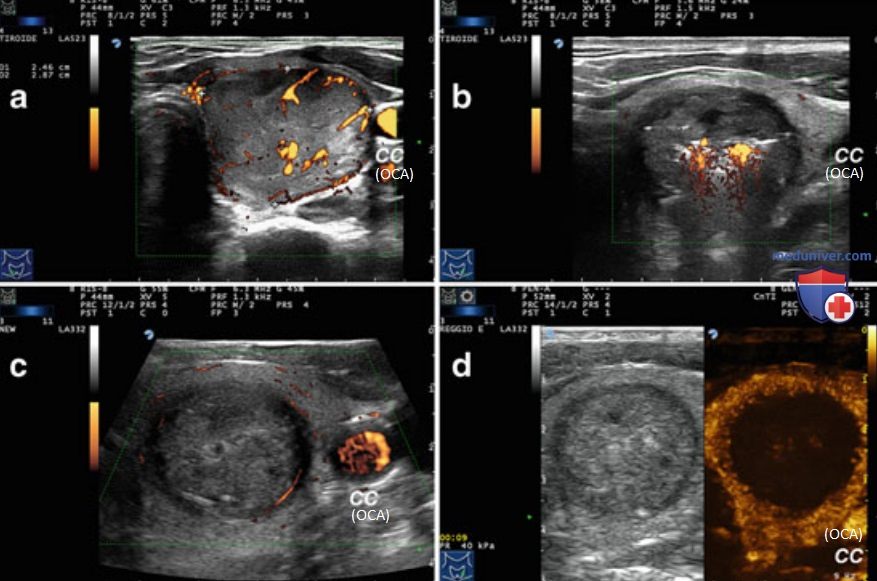
В то время как абляция узлов малых (но >5 мм) размеров может быть выполнена с использованием одного оптоволокна, комбинация нескольких оптоволоконных световодов с высокоэнергетическим излучением и перемещением световода в узле позволяет проводить абляцию узлов до 40-50 мм в ширину, 30-35 мм в толщину и 50-70 мм в длину. Количество используемых оптических волокон, число циклов перемещения иглы/абляции и энергию лазера выбирают в зависимости от объема узла. Общая длительность лазерного облучения варьирует от 6 до 30 мин в зависимости от размеров узла. В ходе процедуры ЧЛА облучение лазерами проводят непрерывно, за исключением этапов репозиционирования иглы при возникновении боли, рефлекторном кашле и иных побочных эффектах. На рис. 18 продемонстрирована УЗ-картина узла ЩЖ до, во время и после окончания процедуры ЧЛА. УЗИ с контрастным усилением демонстрирует полную абляцию узла.
д) Уход за пациентом после процедуры чрескожной лазерной абляции. Сразу после окончания ЧЛА пациенту внутривенно болюсно вводят 20 мг преднизолона. К шее пациента прижимают пакет со льдом. Пациента перевозят в палату реабилитации, где после 30-минутного инфузионного введения 100 мг кетопрофена или 1 г парацетамола за пациентом наблюдают около 2 ч. Перед гем как пациент покинет клинику, ему следует провести контрольное УЗИ шеи. Всем пациентам после процедуры ЧЛА назначается преднизолон перорально в дозировке 25 мг в течение 3 дней (1-й прием — спустя сутки после процедуры), в течение 3 дней — 12,5 мг и 4 дней — 5 мг. На время 10-дневного курса терапии преднизолоном пациенту также назначают ингибиторы протонной помпы (лансопразол 30 мг/сут).
е) Осложнения. Частота осложнений и побочных эффектов после процедуры ЧЛА низкая. Авторы данной статьи на сайте отмечают: за все время, пока они применяют ЧЛА для лечения узлов ЩЖ, ни одному пациенту не потребовалась интенсивная терапии или экстренное хирургическое вмешательство. Боль во время проведения процедуры ЧЛА обычно отсутствует или минимальная. При возникновении болевого синдрома следует отключить лазер и переместить оптоволоконные световоды ближе к центру узла. Послеоперационные боли наблюдаются в 8-40% случаев и требуют дополнительной фармакотерапии. Кровотечение из узла в процессе позиционирования иглы прекращается после быстрого введения оптоволокна и начала абляции и не требует отмены ЧЛА. В практике авторов редкими (<2,5%) осложнениями были:
- подкапсулярное кровоизлияние;
- симптомы раздражения блуждающего нерва с развитием брадикардии;
- кашель;
- обратимые изменения голоса (полное восстановление нормального голоса через 1-2 мес);
- разрыв узлового образования с развитием субфасциальной гематомы и отека, постепенно рассасывающихся в течение 3-4 мес;
- ожоги кожи;
- преходящий стридор;
- гипотиреоз или тиреотоксикоз.
Необходимо отметить, что частоту встречаемости описанных побочных эффектов изучали у пациентов, которым проводили ЧЛА с использованием лазера на лигированном неодимом алюмоиттриевом гранате в самом начале использования авторами данной методики. По опыту авторов, модификация процедуры ЧЛА с использованием установки EcholaserX4 привела к снижению частоты побочных эффектов (неопубликованные данные).
В литературе описан единичный случай разрыва трахеи спустя 50 дней после процедуры ЧЛА. Пациенту была выполнена тиреоидэктомия и пластика трахеи.
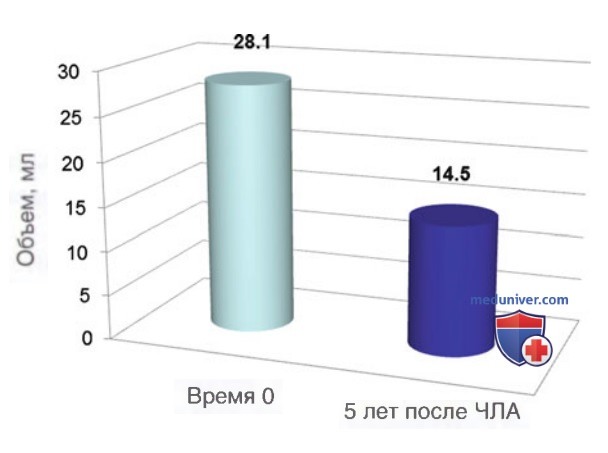
ж) Клинические результаты чрескожной лазерной абляции «холодных» доброкачественных узлов. Уменьшение объема узла после процедуры ЧЛА варьирует в пределах 36-82% от изначального объема. Авторы данной статьи на сайте изучили безопасность и эффективность Nd:YAG лазера при абляции доброкачественных «холодных» узлов ЩЖ; период наблюдения составил 3 года. На момент публикации данной книги авторы также получили предварительные данные 5-летнего наблюдения за 65 пациентами (42 женщины, 23 мужчины, возраст — 52,2±12,3 лет) после процедуры ЧЛА. Энергия лазерного излучения при ЧЛА составила 8522±5365 Дж, выходная мощность — 3,1±0,5 Вт. Объем узлов до абляции — 28,1 ±29,3 мл, через 5 лет после про цедуры ЧЛА — 14,5±17,6 мл, что соответствует среднему относительному уменьшению объема узла на 49,6% (рис. 19). Уменьшение объема узлов коррелировало с уменьшением косметических дефектов и компрессионных симптомов.
В зависимости от эхоструктуры узлы классифицировали следующим образом.
- Плотные: солидные, изогипоэхогенные, гомогенные.
- Губчатые: скопление множественных микрокистозных участков, занимающих более половины узла.
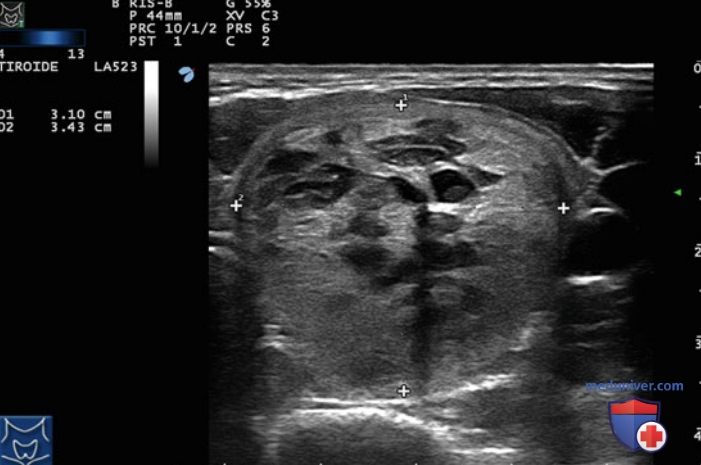
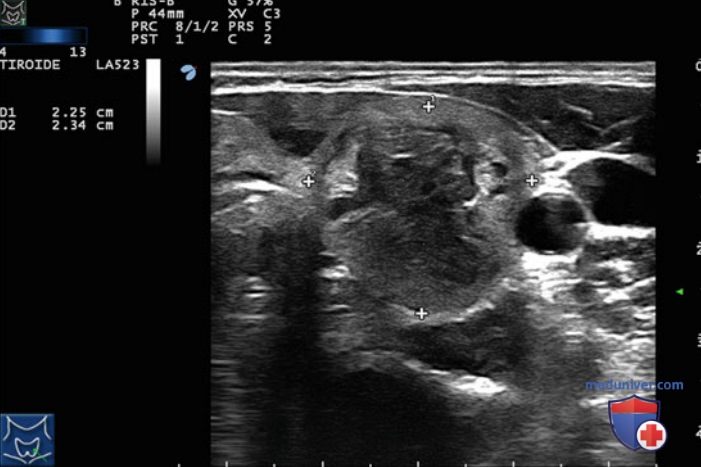
Преимущественно кистозные узлы (содержание жидкости >50%) исключали из анализа. В губчатых узлах (n=44) ЧЛА приводила к уменьшению объема с 24,8±25,9 до 7,7±7,5 мл, что соответствует среднему относительному уменьшению объема на 58,7%. У 21 пациента с плотными узлами объем уменьшился с 26,4±24,5 до 17,9±22,0 мл, то есть на 26,8%. Уменьшение образе ваний ЩЖ после процедуры ЧЛА оказалось достоверно больше для губчатых узлов, чем для плотных (р=0,01) (рис. 20). Полученные авторами результаты свидетельствуют о том, что процедура ЧЛА позволяет достичь более выраженного и стойкого эффекта у пациентов с узлами губчатой структуры по сравнению с пациентами с плотными узлами. На рис. 21 продемонстрирован типичный губчатый узел левой доли ЩЖ с множественными микрокистозными участками. Спустя год после процедуры ЧЛА УЗИ демонстрирует снижение объема узла с 23,5 до 9,2 мл (рис. 22). Таким образом, именно пациенты с узлами губчатой структуры являются наилучшими кандидатами для проведения ЧЛА.

- Рекомендуем ознакомиться далее "УЗИ при радиочастотной абляции (РЧА) щитовидной железы"
Редактор: Искандер Милевски. Дата публикации: 22.6.2023

