Пренатальная диагностика наследственных заболеваний. Дородовая диагностика наследственной патологии.
В последние годы благодаря успешному развитию цитогенетики, биохимии и молекулярной биологии, оказалось возможным выявлять хромосомные и генные мутации у человека не только в постнатальном периоде, но и на разных сроках пренатального развития, т.е. дородовая диагностика наследственной патологии стала реальностью. Пренатальная (дородовая) диагностика включает комплекс мероприятий, направленных на предотвращение появления больного ребенка в семье. Наибольшие успехи достигнуты в дородовой диагностике хромосомных синдромов и моногенньгх заболеваний, в то время как прогнозирование патологии, характеризующейся полигенным наследованием, существенно затруднено. Методы пренатальной диагностики принято делить на инвазивные и неинвазивные.
При применении инвазивных методов производят трансабдоминальный (через брюшную стенку) или трансцервикальный (через влагалище и шейку матки) забор клеток плода на различных сроках беременности и их последующий анализ (цитогенетический, молекулярно-генетический, биохимический и т.д.). Цитогенетические методы исследования позволяют выявить хромосомные аберрации у плода, с помощью биохимических методов определяют активность ферментов или концентрацию некоторых продуктов метаболизма, молекулярно-генетический анализ дает прямой ответ на вопрос о том, есть ли у плода патологическая мутация в исследуемом гене. Применение инвазивных методов дородовой диагностики оказывается наиболее эффективным, так как их результаты позволяют с высокой точностью судить о наличии у плода наследственной патологии. Забор плодного материала для дородовой диатостики может осуществляться на разных сроках беременности под контролем ультразвука. В ранние сроки беременности (от 8 до 12 недель) для анализа используют клетки плода, выделенные из материала ворсин хориона или плаценты, полученные путем хорион- или плацентобиопсии. Эти сроки беременности являются оптимальными для проведения дородовой диагностики, так как раннее обнаружение патологических изменений генотипа плода позволяет прервать беременность с минимальным риском для организма матери. Кроме того, при диагностике хромосомных аберраций у плода не требуется культивирования клеток, что позволяет получить результаты уже через 3—4 дня. Однако, несмотря на очевидные преимущества ранней пренатальной диагностики, существуют и некоторые недостатки, связанные, прежде всего, с возникновением угрозы выкидыша. Показано, что у 10%—12% женщин после проведения этой процедуры отмечаются маточные кровотечения, у 3% повышается тонус матки, а в 1,5%-2% случаев происходит самопроизвольное прерывание беременности. В ряде случаев, при нарушении технологии забора плодного материала возможно инфицирование организма плода и матери.
В более поздние сроки беременности (15—18 недель) для проведения пренатальной диагностики используют трансабдоминальный амниоцентез и затем исследуют клетки плода, выделенные из амниотической жидкости. Эта процедура значительно менее травматичная и приводит к неплановому прерыванию беременности не более чем в 0,2% случаев. К недостаткам этого метода можно отнести: 1) необходимость культивирования клеток для цитогенетического исследования (процедура занимает 2-3 недели); 2) необходимость искусственной стимуляции родов во втором триместре беременности при выявлении патологических изменений генотипа плода, что может отрицательно сказаться на репродуктивной функции женщины. Проведение амниоцентеза на более поздних сроках беременности целесообразно при подозрении на наследственную патологию обмена, а также в том случае, если на раннем сроке у беременной была угроза выкидыша,
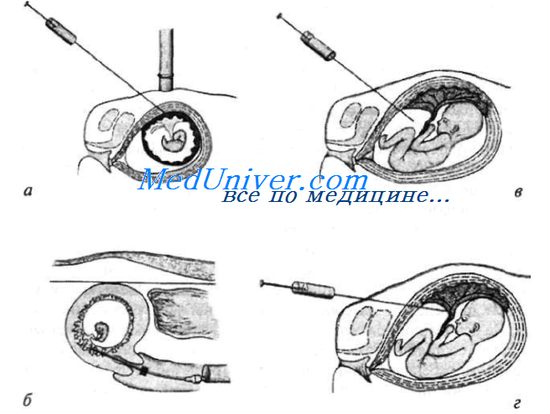
Если осуществление дородовой диагностики оказывается возможным только после 18 недель или необходимо диагностировать наследственные болезни крови и степень резус-сенсибилизации, наиболее часто в качестве объекта исследования используют клетки крови, полученные из пуповины путем кордоцентеза. Клетки крови — наиболее удобный материал и для цитогенетического анализа, так как их культивирование происходит значительно быстрее, точность полученных результатов значительно выше, а спектр выявляемых хромосомных аномалий шире.
В очень редких случаях объектом исследования служат образцы различных тканей плода. Это необходимо, например, для диагностики наследственных болезней, этиология которых не известна, а диагноз может быть поставлен только на основании морфологических изменений. Безусловно, изучение молекулярно-генетических механизмов этой группы заболеваний приведет к тому, что данный метод дородовой диагностики потеряет свое значение и будет заменен прямым анализом гена на наличие в нем мутационного повреждения.
В последние годы интенсивно разрабатываются неинвазивмые методы дородовой диагностики различной наследственной патологии. Риск осложнений при их проведении существенно ниже, чем при использовании инвазивных методов. Наиболее часто неинвазивные методы применяют для диагностики у плода врожденных пороков развития и хромосомных синдромов. Эти методы не требуют забора плодного материала, а диагностика того или иного вида патологии осуществляется на основании ультразвукового обследования плода или иммуноферментного анализа сыворотки крови беременной женщины. Наибольшего эффекта можно добиться при проведении массового обследования всех беременных женщин (скрининг). На основании полученных результатов формируются, гак называемые «группы риска», состоящие из беременных женщин, у которых предполагается рождение больного ребенка. При формировании групп риска чрезвычайно важны результаты исследования концентрации трех групп сывороточных маркеров: фетопротеина (АФП), хорионическога гонадотропина (ХГ) и неконъюгироваиного эстриола (НЭ). Диагностическое значение при обследовании имеет отклонение показателей концентрации этих маркеров от контрольных цифр для определенного срока беременности. В ряде случаев при отсутствии возможности проведения массового скрининга осуществляется выборочное обследование беременных. При формировании групп для такого селективного скрининга учитывается возраст супругов, данные анамнеза и клииико-генеалогического обследования. Критериями отбора пациенток является: возраст старше 35 лет, задержка развития плода, наличие врожденных пороков и/или хромосомных перестроек у одного из родителей или у предыдущего ребенка в семье.
В качестве диагностического теста при формировании группы риска по возникновению дефектов нервной трубки можно использовать определение в плазме крови беременной концентрации гомоцистеина, обладающего токсическим действием на клетки плода и плодных оболочек. Ценность этого скрининг-теста определяется возможностью профилактики осложнений гипергомоцистеинемии матери путем своевременного назначения беременной женщине препаратов фолиевой кислоты и витаминов группы В (веществ участвующих в превращении гомоцистеина в метионин).
Проведение ультразвукового обследования плода наиболее эффективно во втором триместре беременности, так как позволяет выявить большинство пороков развития конечностей, желудочно-кишечного тракта, сердца, почек, атакже грубые пороки центральной нервной системы. Однако существует ряд ультразвуковых маркеров, имеющих большое диагностическое значение в первом триместре беременности. К ним относятся - увеличение размеров шейной складки, отсутствие у плода закладки носового хряща, многоводие и др.
Наибольшая эффективность неинвазивной дородовой диагностики может быть достигнута при комплексном анализе результатов всех методов обследования с помощью компьютерных программ расчетов риска.
Среди неинвазивных методов дородовой диагностики в настоящее время наиболее перспективен анализ клеток плода выделенных из крови матери. В крови беременной женщины в очень малом количестве присутствуют некоторые ядросодержащие клетки плода: трофобласты, лимфоциты, гранулоциты, эритробласты. Они появляются в результате трансплацентарного переноса и приводят к развитию толерантности организма матери по отношению к плоду. Концентрация этих клеток в крови матери ориентировочно составляет 10-5—10-8. В настоящий момент наибольшее диагностическое значение имеет исследование эритробластов, что связано с некоторыми их характеристиками: 1) наличием полного комплекта ядерных генов; 2) появлением в крови беременной женщины в I триместре (в результате гемопоэза в желточном мешке); 3) присутствием в крови женщины не более 90 дней после родов, что исключает отбор для анализа эритробластов от предыдущих беременностей.
Недостатком этого метода является отсутствие эффективных методов сортировки и детекции клеток плода, получаемых из крови матери. Обычно используют морфологические, биохимические и иммунологические методы, однако наибольшей эффективности удается добиться при использовании ПЦР для амплификации генома единичных клеток или свободной ДНК плода, присутствующей в материнской плазме и сыворотке в концентрации 3,4-6,2%.
- Читать далее "Преимплантационная диагностика наследственных заболеваний. Диагностика наследственной патологии до имплантации."
Оглавление темы "Диагностика наследственных заболеваний.":1. Пероксисомные болезни. Синдром Цельвегера.
2. Генетика широко распространенных заболеваний. Механизмы развития предрасположенных болезней.
3. Болезни с наследственной предрасположенностью. Маркеры наследственно предрасположенных болезней.
4. Анализ сцепления наследственно предрасположенных болезней с маркерами. Особенности наследственных болезней.
5. Эссенциальная гипертензия и гены. Атеросклероз и генетика. Бронхиальная астма и гены.
6. Канцерогенез. Генетические аспекты канцерогенеза. Протоонкогены. Гены-супрессоры.
7. Генетические предпосылки развития опухоли. Трансформации клетки в опухоль.
8. Медико-генетическое консультирование. Профилактика наследственной патологии.
9. Пренатальная диагностика наследственных заболеваний. Дородовая диагностика наследственной патологии.
10. Преимплантационная диагностика наследственных заболеваний. Диагностика наследственной патологии до имплантации.

