Распад и обновление внеклеточного матрикса (ВКМ)
Во внеклеточном пространстве большинство коллагенов образуют полимеры, описанные выше, которые, в свою очередь, взаимодействуют с другими белками внеклеточного матрикса (ВКМ) посредством многочисленных межбелковых взаимосвязей. Это приводит к сборке мультимолекулярных структур и к организации белков ВКМ в особые сети. Кроме того, многие факторы роста и цитокины специфически взаимодействуют с белками ВКМ и поэтому накапливаются в этих сетях.
Мультимолекулярные структуры постоянно ремоделируются со скоростью, которая может значительно возрастать при развитии, заживлении раны или при некоторых патологических процессах. В результате такого ремоделирования высвобождается большое количество биологически активных пептидов, в том числе факторов роста.
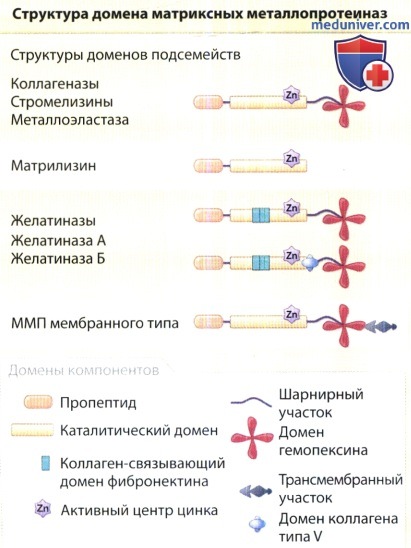
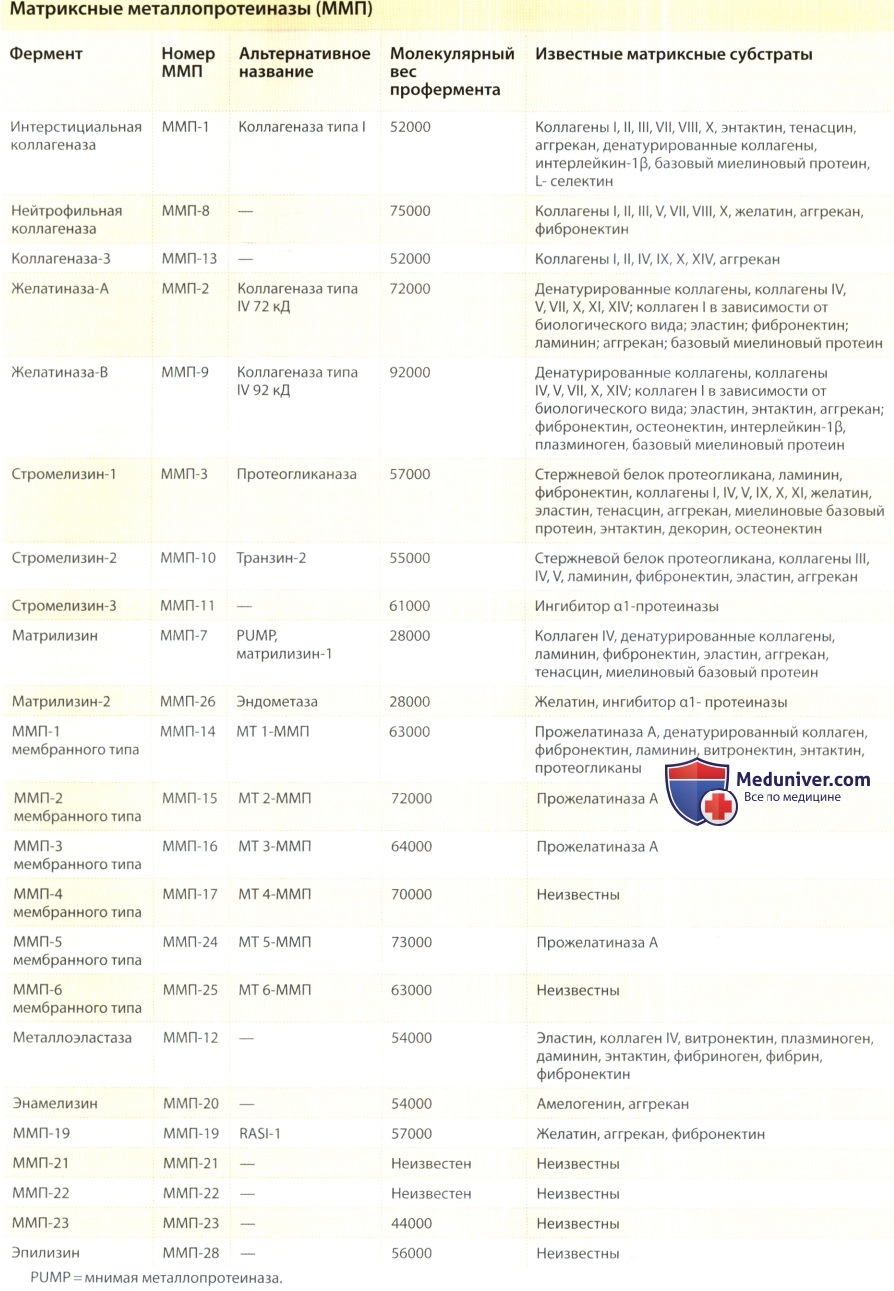
Ремоделирование внеклеточного матрикса (ВКМ) представляет собой многосторонний и многоэтапный процесс с участием целого ряда молекулярных путей и механизмов. Первоначальный этап зависит от наличия протеиназ, способных инициировать деградацию белков ВКМ. К этим ферментам относятся семейство матричных металлопротеиназ (ММП), которое включает коллагеназы, желатиназы, стромелизины, матрилизины, металлоэластазу, энамелизин и матричные ММП мембранного типа.
Интерстициальная коллагеназа (ММП-1) стала первой из открытых ферментов семейства ММП, она была идентифицирована благодаря своей способности разрушать трехспиральную структуру коллагена, устойчивую к действию большинства протеаз. Коллагеназа кожи человека была впервые выделена в активной форме из культуральной среды кожных эксплантатов, а затем в форме протофермента из монослойной культуры фибробластов. Другие присутствующие в коже типы клеток, в том числе кератиноциты, эндотелиальные клетки, моноциты и макрофаги, экспрессируют идентичный фермент.
Как и остальные ММП, ММП-1 содержит цинк в активном участке и нуждается в кальции для функционирования и термостабилизации.
ММП-1 разлагает некоторые из присутствующих в коже коллагенов, в частности типы I, III и VII, но не коллагены типов IV и V. При физиологических параметрах pH и температуры, этот фермент катализирует единичное расщепление на расстоянии трех четвертей длины молекулы от амино-терминальной группы в каждой из трех a-цепей, составляющих трехспиральный нативный мономер коллагена. В частности, ММП-1 расщепляет α1 (I) -цепь по глицин-изолейциновой (Gly-Ile) связи (остатки 775 и 776) и а2 (I) — цепь по глицин-лей-циновой (Gly-Leu) связи в гомологичном участке.
Десять остальных связей Gly-Ile или Gly-Leu в пределах трехспирального домена интерстициальных коллагенов не расщепляются, что указывает на локальную конфигурацию участка расщепления коллагеназы как на основной фактор в определении специфичности субстрата. Действительно, ММП-1 катализирует многочисленные расщепления в денатурированных цепях всех типов коллагена по связям Gly-Ile и Gly-Leu. Таким образом, получается, что тройная спираль нативного коллагена может кардинально изменять способность фибробластной коллагеназы катализировать расщепления, допустимые, исходя только лишь из первичной последовательности.
Нейтрофильная интерстициальная коллагеназа человека (ММП-8) атакует коллагены на том же участке, что и фибробластная коллагеназа, образуя типичные фрагменты в соотношении три четверти к одной четверти. У человека ММП-8 является высокогомологичной матричной металлопротеиназой к ММП-1, но имеет более высокую степень гликозилирования. Фермент не сразу секретируется, но накапливается в нейтрофильных гранулах и высвобождается при стимуляции. Хотя и фибробластная, и нейтрофильная коллагеназы обладают одинаковой аффинностью к коллагену типов I и III, фибробластная коллагеназа разлагает с более высокой скоростью растворимый коллаген типа III, в то время как нейтрофильная коллагеназа быстрее разлагает растворимый коллаген типа I.
Разница в специфичности относительно мономеров коллагена между обоими ферментами в основном нивелируется, когда субстраты восстанавливаются в нерастворимые фибриллярные формы, присутствующие в тканях.
Недавно была получена важная информация о механизме разложения коллагена. В частности, было показано, что активированная коллагеназа (ММП-1) перемещается на коллагеновых волокнах в процессе биодеградации, причем механизм этого перемещения представляет собой диффузию со смещением компонента движения в зависимости от протеолиза коллагена, а не от гидролиза АТФ. Очень важно, что близкородственные матриксные металлопротеиназы, а именно ММП-2 (желатиназа), ММП-9 и внеклеточный участок МТ 1-ММП (металлопротеиназы мембранного типа 1), также могут распространяться на коллагеновых волокнах.
Эти исследования показывают, что на клеточной поверхности существует коллагенолитический комплекс МТ1-ММП. Комплекс МТ1-ММП, который прикреплен к клеточной поверхности, имеет большое значение для генерации сил, необходимых для клеточной динамики не только при нормальных физиологических процессах ремоделирования тканей, но и при патологических процессах, таких как опухолевая инвазия.
Коллагеназа-3 (ММП-13) была впервые клонирована из клеток карциномы грудной железы и является гомологичной коллагеназе грызунов. Однако в отличие от интерстициальных и нейтрофильных коллагеназ, коллагеназа-3 действует в 3-5 раз быстрее на растворимый коллаген типа II, специфический коллаген хряща, чем на коллаген типов I и III. При физиологической температуре продукты расщепления коллагена (то есть фрагменты в соотношении три четверти/одна четверть), которые первоначально представляли собой тройную спираль, становятся растворимыми, термически нестойкими и спонтанно денатурируют, образуя желатин (денатурированный коллаген).
Эти денатурированные желатиновые пептиды подвергаются затем воздействию со стороны других протеиназ. Таким образом, интерстициальные коллагеназы находятся в ключевом участке метаболизма соединительной ткани. Они инициируют протеолитические процессы, которые приводят к распаду коллагена и полному обновлению внеклеточных матриксов.
- Рекомендуем далее ознакомиться со статьей "Состав и синтез эластических волокон"
Оглавление темы "Внеклеточный матрикс (ВКМ) дермы.":
