Белки микрофибрилл дермы
При электронной микроскопии микрофибриллы дермы в поперечном сечении выглядят как наружная электронно-плотная оболочка, окружающая внутренний светлый стержень, а в продольном сечении как цепочка бус, что указывает на вхождение в их состав более одного белка. Более того, отсутствует ассоциация имму-нореактивного эластина с микрофибриллами, расположенными на уровне дермо-эпидермального соединения, но как только микрофибриллы пересекают дерму, они ассоциируются с возрастающим количеством аморфного эластина.
Вследствие нерастворимости и сложности состава, изучение химических свойств микрофибрилл до настоящего времени прогрессирует медленно. Эти структурные белки сейчас разделяют на несколько групп в зависимости от их молекулярных характеристик. В таблице ниже эти белки перечислены с указанием некоторых характерных свойств, включая их локализацию на хромосомах человека. Эти группы белков кодируются несколькими семействами генов, которые имеют общие доменные мотивы.
а) Фибриллины. Самыми крупными из микрофибриллярных белков и, вероятно, самыми важными в количественном и функциональном отношении являются фибриллины, гликопротеины с молекулярной массой 350 кД, которые составляют неотъемлемую часть структуры микрофибриллов. Электронно-микроскопические изображения мономерного фибриллина человека, синтезированного в культуре фибробластов, показывают протяженную гибкую молекулу длиной около 148 нм и шиной 2,2 нм.
В исследованиях с молекулярным клонированием пока идентифицированы три гомологичных гена человека — FBN1, FBN2 и FBN3, кодирующих соответственно фибриллин-1, -2 и -3. Анализ аминокислотных последовательностей, расшифрованных на основании клонированных комплементарных ДНК, показал, что эти белки содержат многочисленные повторы мотива, впервые наблюдавшегося в прекурсорной модели эпидермального фактора роста (EGF). Эти повторы мотива имеют либо шесть, либо восемь консервативных цистеинов, а многие из них содержат консенсусную последовательность для связывания кальция.
Такие EGF-подобные мотивы довольно часто встречаются в белках ВКМ и присутствуют в нескольких копиях, например, в ламининах, фибулинах, нидогенах, агрине, перлекане, тенасцинах и латентных, связывающих трансформирующий фактор-бета (TGF-β) белках (LTBP). Кроме важных для архитектоники тканей структурных функций, теперь ясно, что фибриллины регулируют процессы сигнализации и как прямо, так и косвенно контролируют клеточную деятельность. Следовательно, они играют важные роли в развитии организма и в болезнетворных процессах.
б) Латентные белки, связывающие трансформирующий фактор роста-В. Интересно отметить, что белки LTBP содержат EGF-подобные мотивы, одинаковые с мотивами, обнаруженными в фибриллинах (рисунок ниже дает сравнение структур фибриллинов и белков LTBP). Фактор TGF-β всегда секретируется как латентный комплекс с LAP (от англ. Latency-Associated Peptide — ассоциированный с латентностью пептид), и этот комплекс связывается с белком LTBP. К настоящему времени клонированы и описаны четыре различных белка группы LTBP (jn LTBP1 до LTBP4), размер которых варьирует от 125 до 310 кД.
Хотя белки LTBP могут способствовать секреции TGF-β или связыванию неактивного комплекса с тем участком клеточной поверхности, где происходит активация, они встречаются также в форме свободных белков в сочетании с компонентами ВКМ. Создание нокаутной мыши с отсутствием LTBP3 выявило наличие черепно-лицевых деформаций, нарушение оссификации и развитие остеосклероза и остеоартрита у животных с дефицитом этого белка. Эти факты означают важность LTBP3 для контроля функции TGF-β, в частности способности белков группы LTBP модулировать биодоступность TGF-β. При иммунологических исследованиях LTBP1 был обнаружен в микрофибриллах эластических волокон. Это с большой долей вероятности указывает на то, что один или более белков LTBP являются компонентами этих фибрилл.
Кроме того, уровни LTBP изменяются при ряде патологических состояний, включая актинический эластоз.
в) Фибулины. Фибулины являются семейством гликопротеинов внеклеточного матрикса (ВКМ), которые, также как фибриллины и белки LTBP, содержат тандемные, EGF-подобные повторы, а также общий карбоксильно-терминальный глобулярный домен. Посредством молекулярного клонирования идентифицировано пять различных генов фибулина. Фибулины широко распространены в соединительных тканях, включая кожу, где они расположены в эластических волокнах. Для мышей с дефицитом FBLN-4 и FBLN-5, созданных путем целевой абляции соответствующих генов, характерно выраженное ослабление эластогенеза.
У мышей с дефицитом FBLN-4 наблюдается тяжелый фенотип, который приводит к перинатальной гибели, главным образом вследствие аномалий легочной и сердечно-сосудистой систем. Особенно интересен клинический фенотип нокаутной по гену FBLN-5 мыши, у которой наблюдается прогрессирующая вялость кожи в дополнение к сосудистым аномалиям и эмфизематозным изменениям легких. Изменения кожи похожи на изменения кожи у пациентов с врожденной вялой кожей (cutis laxa). Фактически, мутации в генах FBLN-4 и FBLN-5 зарегистрированы в некоторых случаях cutis laxa.
В состав микрофибрилл входит также ряд других белков, неродственных фибриллинам, группе LTBP и фибулинам. К ним относятся лизилоксидазы, интерфейсные белки эмилины и несколько белков, принадлежащих к семействам микрофибрил-ассоциированных белков (МАР) или микрофибрилл-ассоцированных гликопротеинов.
Среди последних примечателен микрофибрилл-ассоциированный белок-1, который является чрезвычайно кислым, поскольку 23% остатков составляет глютаминовая кислота и 6% остатков — аспартановая кислота. Исключительно кислая природа белка указывает на то, что он может выполнять важную функцию в сборке базовых молекул тропоэластина. И, наконец, лизиолоксидазы играют решающую роль в перекрестном связывании и стабилизации структур эластических волокон.
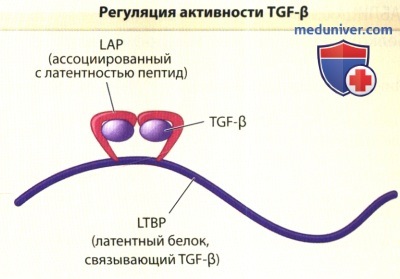
TGF-β синтезируются и секретируется в латентной неактивной форме в комплексе с белком, ассоциированным с латентностью и латентным белком, связывающим TGF-β.
Поэтому он может аккумулироваться в неактивной форме в крупных скоплениях внеклеточного матрикса.
Диссоциация белкового комплекса приводит к активации TGF-β и быстрой доступности, в зависимости от биологической потребности.
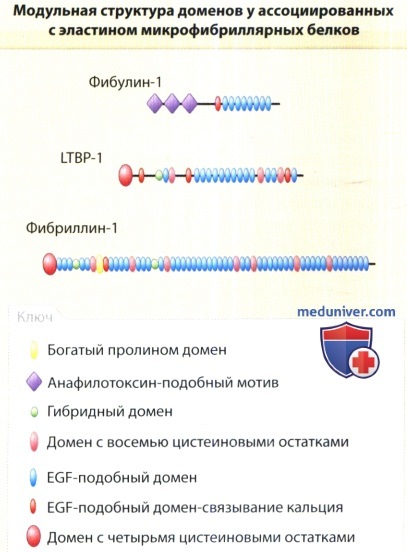
Представлен первый член каждого семейства генов. Семейства FBN, LTBP и FBLN являются родственными, поскольку они имеют общие белковые мотивы. EGF = эпидермальный фактор роста.

- Рекомендуем далее ознакомиться со статьей "Состав и синтез протеогликанов"
Оглавление темы "Внеклеточный матрикс (ВКМ) дермы.":
