Состав и синтез эластических волокон
а) Структура и формирование эластических волокон. Эластические волокна соединительной ткани образуют сеть, ответственную за эластичные свойства различных органов и анатомических структур. Относительная концентрация эластических волокон является максимальной в аорте и артериальных кровеносных сосудах, а также в легких, однако в коже они составляют лишь незначительный процент. Так, в закрытой от воздействия солнца коже взрослого человека содержание эластина составляет 1-2% от общего сухого веса дермы. В сосочковом слое дермы эластичные волокна представлены либо пучками микрофибрилл (окситалановые волокна), либо небольшими количествами перекрестно-связанного эластина (элауниновые волокна).
В сетчатом слое дермы эластичные волокна, которые состоят преимущественно из эластина, горизонтально ориентированы в сеть с вертикальными ответвлениями в сосочковый слой дермы в форме окситалановых волокон. Исследование эластичных соединительных тканей с помощью трансмиссионной электронной микроскопии показало, что зрелые эластические волокна состоят из двух различных компонентов. Аморфный электронно-светлый стержень состоит преимущественно из эластина, который окружен характерными, электронно-плотными микрофибриллярными структурами с постоянным диаметром 10-12 нм и включает ряд микрофибриллярных белков, таких как фибриллины и фибулины.
Эластин и микрофибриллы существуют в различных соединительных тканях в тесной взаимосвязи, однако сравнительные пропорции этих компонентов в ходе эмбрионального развития меняются. Первые элементы эластических волокон, которые образуются в ходе развития плода, состоят из пучков микрофибрилл, которые визуализируются методом трансмиссионной электронной микроскопии в начале первого триместра беременности. Предполагается, что микрофибриллы образуют каркас, в котором организуются молекулы эластина. Исследование полностью созревших эластических волокон методом электронной микроскопии показывает, что белок эластин составляет более 90% в общем составе таких волокон.
Однако следует отметить, что кожа, как и другие ткани, содержит микрофибриллы, лишенные эластина.
б) Биология эластических волокон. Изучению эластина длительное время препятствовала его исключительная нерастворимость в зрелых тканях животных.
Однако выяснилось, что эта нерастворимость вызвана наличием комплексных ковалентных перекрестных связей — десмозинов, образованию которых можно воспрепятствовать, если содержать животных на диете, лишенной меди, или кормить их латирогенами, такими как β-аминопроприонитрил, которые препятствуют перекрестному связыванию эластина и коллагена. Если перекрестные связи не образуются, из тканей можно экстрагировать большую фракцию вновь синтезированного эластина.
Клонирование комплементарных ДНК, которые соответствуют мРНК эластина человека и имеют размер примерно 3,5 килобазы (kb), позволило расшифровать всю первичную последовательность тропоэластина. Базовая молекулярная структура эластина представляет собой линейный полипептид тропоэластин, который состоит примерно из 800 аминокислот и имеет молекулярную массу 70 кД. Как и в коллагене типа I, примерно треть аминокислотных остатков эластина состоит из глицина, однако он распределен не так равномерно, как в типичной коллагеновой последовательности.
Вместо этого, глициновые остатки сгруппированы в участках, богатых валином и пролином, в которые вкраплены последовательности, богатые аланином. Эластин содержит также гидроксипролин, но сравнительное содержание этой аминокислоты значительно ниже, чем в коллагене, и параметры гидропролина вариабельны. Эластин не содержит ковалентно связанных с полипептидной цепью гидроксилизинновых или углеводных групп.
Характерным признаком эластических волокон является присутствие перекрестных связей, которые ковалентно соединяют полипептидные цепи эластина в сеть волокон. Расшифрованная аминокислотная последовательность содержит чередующиеся сегменты доменов перекрестной связи, для которых характерно присутствие лизиловых остатков, разделенных двумя-тремя аланиновыми остатками, и гидрофобные домены. Два основных компонента перекрестной связи, десмозин и его изомер изодесмозин, являются структурами, уникальными для эластина. Содержание десмозинов в различных препаратах эластина довольно постоянное — около 1,5 остатка на 1000 аминокислот. Следовательно, показатели десмозина и изодесмозина могут быть количественной мерой, которая определяет содержание эластина в тканях.

фибробласт (F) в окружении эластических структур (Е) и коллагеновых волокон (С).
1. Конститутивный и альтернативный сплайсинг. Ген эластина человека состоит из 34 отдельных экзонов, занимающих в целом 45 кб геномного ДНК. Информация, хранящаяся в ДНК-последовательности гена эластина, транскрибируется в ядре клеток в крупный прекурсор матричной РНК (мРНК), который подвергается нескольким посттраскрипционным модификациям, в том числе сплайсингу и полиаденилированию. После этого молекулы транспортируются в цитоплазму, где функциональные мРНК служат шаблонами для синтеза полипептидов эластина в ходе трансляции. Некоторые данные указывают на то, что скорость биосинтеза эластина в большой мере регулируется избытком функциональных мРНК и, следовательно, определение уровней мРНК эластина позволяет измерить скорость биосинтеза эластина в тканях и клетках.
Еще во время выделения комплементарных ДНК эластина человека было выявлено, что некоторые совпадающие клоны были идентичными, за исключением коротких последовательностей, которые отсутствовали в одних клонах, но присутствовали в других. Сравнение этих последовательностей в комплементарных ДНК с соответствующими сегментами геномной ДНК показали, что эти различия возникали вследствие альтернативного сплайсинга некоторых экзонов в ходе посттранскрипционного процессинга пре-мРНК эластина. Фактически как минимум шесть экзонов в гене человека подвергаются альтернативному сплайсингу, и несколько вариантов матричных РНК транслируются в белок. Этот механизм может обеспечить значительные вариации в аминокислотном составе индивидуальных полипептидов эластина и, вероятно, в функции эластических волокон в различных тканях.
Однако значение альтернативного сплайсинга для эволюции и специфичности тканей до конца не выяснено.
2. Регулировка экспрессии генов эластина. Промоутер гена эластина содержит особое сочетание потенциальных мест связывания транскрипционных регуляторных факторов, что указывает на комплексную транскрипционную регуляцию. К ним относятся множественные места связывания Sp1 и АР2, глюкокортикоид-чувствительные элементы и ТРА (фор-бол-эфирный промоутер опухоли, элементы чувствительные к 12-О-тетрадеканоилфорболу и циклической аденозин-монофосфатазе). Отсутствие ТАТА-бокса в регионе промоутера указывает на то, что участков инициации транскрипции может быть много, и различные молекулярные тесты подтверждают эту концепцию.
Были проведены функциональные анализы промоутерного сегмента эластина человека, в ходе которых была сконструирована панель генных конструкций по типу «промоутер-репортерный ген» (например, ген хлорамфениколацетилтрансферазы).
Эти конструкции применялись в транзиторных трансфекциях с различными культурами клеток, включая фибробласты кожи человека. Данные исследования указывают, что основной промоутер, необходимый для базальной экспрессии гена, содержится в регионе от -128 до -1 (относительно места инициации трансляции -1, +1), а последовательности, расположенные перед промоутерным участком, содержат несколько элементов, усиливающих и ослабляющих экспрессию гена. У трансгенных мышей с экспрессией промоутера эластина человека было выявлено, что участок ДНК длиной 5,2 кб, примыкающий к гену эластина человека, содержит элементы, необходимые для тканеспецифической экспрессии.
Кроме 5’-последовательностей, первые нитроны генов эластина как быка, так и человека содержат участки с чрезвычайно выраженной гомологией последовательностей. Поскольку было показано, что первый интрон трех различных генов коллагена содержит сегменты, которые действуют как энхансеры активности промоутера, сильная консервативность в интронегена эластина предполагает возможное наличие энхансера и в этом гене.
3. Цитокиноваия и гормональная регуляция синтеза эластина. Наличие множества цис-элементов в промоутерном участке эластина указывает на то, что экспрессия гена эластина модулируется на транскрипционном уровне транс-факторами. Например, ранее проведенные исследования показали, что фактор некроза опухоли-α уменьшает избыточность эластина, прежде всего, путем подавления активности промоутера. В других работах было установлено, что трансформирующий фактор роста бета (TGF-β) увеличивает избыточность мРНК эластина человека примерно в 30 раз, однако данные исследований транзиторной трансфекции указывают, что такое увеличение, по крайне мере частично, является посттраскрипционным.
Фактически изучение полураспада мРНК эластина свидетельствует о том, что TGF-β стабилизирует мРНК эластина, поэтому уровни оказываются постоянно повышенными. Совокупность этих наблюдений предполагает, что медиаторы, которые высвобождаются из воспалительных клеток, способны модулировать экспрессию гена эластина, и такая модуляция может играть определенную роль при заболеваниях, признаком которых является нарушение накопления эластических волокон в тканях.
Витамин D3 также модулирует экспрессию гена эластина. В частности, инкубация фибробластов с витамином D, приводит к 80-90% уменьшению общего накопления тропоэластина, что сопровождается частичным уменьшением постоянных уровней соответствующей мРНК. В то же время инсулиноподобный фактор роста 1 увеличивает экспрессию гена эластина на транскрипционном уровне. Хотя предварительные данные свидетельствуют о модуляции экспрессии гена эластина отдельными факторами роста и гормоноподобными веществами, точные детали такого процесса остаются во многом неизвестными.
4. Биосинтез эластина. Биосинтез эластина включает в себя несколько специфических этапов, необходимых для сборки эластических волокон. Несколько недавних исследований показали, что гладкие миоциты в культуре синтезируют сравнительно большие количества эластина, что указывает на их роль как главного источника эластина в тканях, богатых эластическими волокнами, таких как соединительная ткань сосудов. Количество эластина, синтезируемого культурой фибробластов кожи человека, сравнительно невелико; тем не менее фибробласты могут быть основным источником эластина в дерме.
После завершения трансляции, вновь синтезированные пептиды транслоцируются в цистерны шершавой эндоплазматической сети таким же образом, как это происходит при биосинтезе коллагена и других белков, предназначенных для экспортирования из клеток. Эти наблюдения позволяют предположить, что секреция полипептидов эластина является процессом, в котором участвуют микротубулы клеток, и что молекулы могут транспортироваться из клеток упакованными в пузырьки Гольджи или родственные им структуры.
5. Фибриллогенез и перекрестное связывание. Образование десмозинов происходит во внеклеточном пространстве. Первым этапом является оксидативное деаминизирование лизиловых остатков в соответствующие альдегиды, называемые аллизинами. Катализацию этого преобразования осуществляют требующие наличия меди ферменты — лизилоксидазы. Десмозины образуются путем слияния трех аллизинов и четвертого немодифицированного лизилового остатка в двух соседних цепях тропоэластина. Таким образом, десмозины связывают отдельные полипептиды эластина в нерастворимую сеть.
Лизилоксидазам, группе близкородственных ферментов, в качестве кофакторов требуются медь и молекулярный кислород. Было показано, что у животных с дефицитом меди активность лизилоксидаз ослаблена, и вновь синтезируемые эластические волокна не стабилизируются образующимися десмозинами. В частности, индивидуальные полипептиды тропоэластина остаются растворимыми, а богатые эластином ткани становятся хрупкими.
6. Распад и ремоделирование эластина. Хотя метаболизм эластина очень медленный по сравнению с метаболизмом белков в целом, часть эластина организма непрерывно распадается и частично заменяется вновь синтезируемыми волокнами. Кроме того, при патологических состояниях распад эластина значительно усиливается. Таким образом, в тканях, содержащих эластин, должны присутствовать протеолитические ферменты, которые способны разлагать эластические волокна.
Сведения об эластазе, специфическом протеолитическом ферменте эластина, впервые получены при изучении поджелудочной железы. С тех пор эластолитические ферменты были обнаружены в некоторых других тканях, а также в различных типах клеток, включая полиморфоядерные лейкоциты, моноциты/макрофаги и тромбоциты. Однако эластазы из различных источников (например, поджелудочной железы и полиморфоядерных лейкоцитов) имеют различные особенности, что видно из пептидного картирования продуктов разложения.
Классические эластазы представляют собой сериновые протеазы, разлагающие нерастворимые эластические волокна при нейтральном или слегка щелочном pH. Активность этих ферментов ингибируют сывороточные факторы, такие как α1-антитрипсин и α2-макроглобулин. Кроме классических эластаз, какими являются сериновые протеазы, другие эластазы являются метал-лоферментами, и для их функционирования требуется кальций. Один из таких ферментов секретируется макрофагами, изолированными из богатых макрофагами экссудатов альвеол человека.
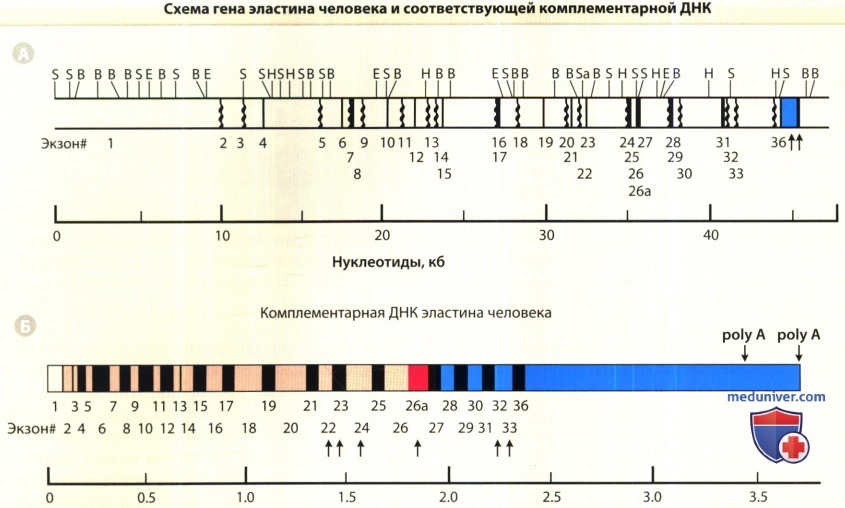
А. Экзоны пронумерованы, начиная с 5» конца гена, и соответствуют экзонам, изображенным на кДНК (см. Б).
Сверху обозначены места расщепления эндонуклеаз рестрикции: BamН 1 (В), EcoR (Е), HindIII (Н), Sacl (S).
Б. Комплементарная ДНК, размером примерно 3,5 килобаз (кб), разделена на отдельные экзоны, которые пронумерованы от 1 до 36 и масштабированы.
Обратите внимание, что ген эластина человека содержит только 34 экзона, однако для сохранения постоянной системы нумерации для генов эластина быка и человека, последний экзон нумеруется числом 36;
таким образом, в гене человека отсутствуют соответствия экзонам быка 34 и 35. Стрелками указаны экзоны, которые подвергаются альтернативному сплайсингу.
Стрелки, обозначенные «poly А», указывают места полиаденилирования.
- Рекомендуем далее ознакомиться со статьей "Белки микрофибрилл дермы"
Оглавление темы "Внеклеточный матрикс (ВКМ) дермы.":
