Строение и типы коллагена
Белки семейства коллагенов являются основными структурными компонентами соединительных тканей и основными внеклеточными белками в организме человека. В коже человека коллагены составляют примерно 80% сухого веса дермы. Классической и первоначально установленной ролью коллагенов в коже является обеспечение прочностных характеристик, которые позволяют коже служить органом защиты от внешней травмы. Кроме того, коллагены обладают важными биологическими свойствами, регулирующими многочисленные процессы в клетках и тканях.
а) Тройная спираль коллагенов. В коже человека коллагеновые волокна образуют основную массу внеклеточного матрикса и составляют примерно 80% сухого веса дермы. Коллаген организован в крупные пучки волокон, состоящих из фибрилл, что создает картину поперечной исчерченности при электронной микроскопии. Наиболее выраженные поперечные полосы выглядят как повторяющиеся полоски, расположенные на расстоянии 70 нм друг от друга. Основным компонентом этих фибрилл является коллаген типа I, первый идентифицированный член семейства коллагенов и наиболее изобильный коллаген в дерме и в большинстве других соединительных тканей. Характерные структурные признаки коллагенов были расшифрованы в ходе изучения коллагена типа I, который поэтому считается прототипом семейства коллагенов.
Молекула коллагена типа I имеет молекулярный вес около 290 кД и состоит из трех полипептидных цепей, каждая примерно 94 кД. Эти три полипептида, известные как a-цепи, закручены друг вокруг друга подобно жилам веревки, так что мономер коллагена имеет структуру тройной спирали. Такая конфигурация придает молекуле жесткую палочковидную форму размерами примерно 1,5x300 нм. Особая структура коллагена в форме тройной спирали объясняется необычным аминокислотным составом α-цепей.
В частности, каждая a-цепь коллагена типа 1 включает примерно 1000 аминокислот, причем глицин (Gly), самая малая аминокислота, составляет примерно одну треть от общего количества аминокислот, равномерно распределенных на коллагеновом участке полипептида. Следовательно, полнпептидные цепи коллагена можно описать как повторяющиеся триплеты, представленные последовательностью (Gly-X-Y). X и У позиции в этой повторяющейся последовательности заняты различными аминокислотами, при этом Х-позиция часто занята пролином, а У-позиция — гидроксипролином.
Эти две аминокислоты составляют примерно 22% общего аминокислотного состава коллагена типа I. Сравнительно высокое содержание данных аминокислот и характерная локализация глицина в каждой третьей позиции необходимы для конфигурации молекулы коллагена в форме тройной спирали, причем гидрокси-пролин играет главную роль в стабилизации тройной спирали при температуре тела. Так называемый коллагеновый домен имеет конфигурацию тройной спирали, которая придает коллагену типа I многие из его уникальных свойств. Она, в частности, важна при сборке коллагена в фибриллы. Мутации, которые влияют на образование стабильной тройной спирали, не позволяют коллагену организоваться в волокна, что приводит к серьезным функциональным дефектам соединительной ткани и целому спектру клинических фенотипов.
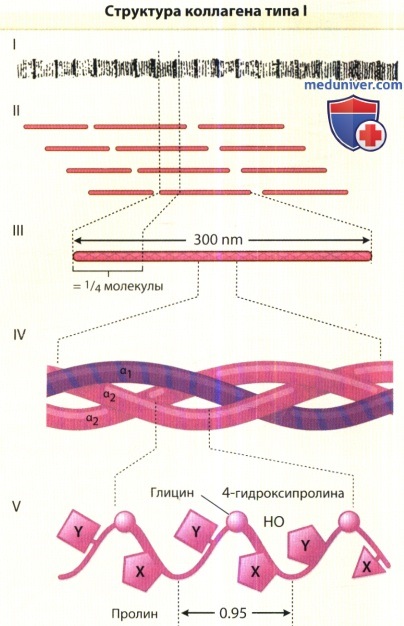
Коллагеновые волокна (I), которые при электронной микроскопии демонстрируют повторяющуюся периодичность,
состоят из индивидуальных молекул коллагена, имеющих четырехступенчатое расположение (II).
Каждая молекула коллагена типа I представляет собой палочковидную структуру (III) длиной примерно 300 нм,
состоящую из трех отдельных полипептидов, известных как a-цепи, которые скручены друг с другом в форме правой тройной спирали (IV).
Каждая цепь состоит из аминокислот в повторяющейся последовательности Gly-X-Y (V);
как указывалось ранее, Х-позицию часто занимает пролиновый остаток, а У-позицию—4-гидроксипролиновый остаток.
Индивидуальные a-цепи имеют вторичную левозакрученную спиральную структуру с шагом спирали 0,95 нм.
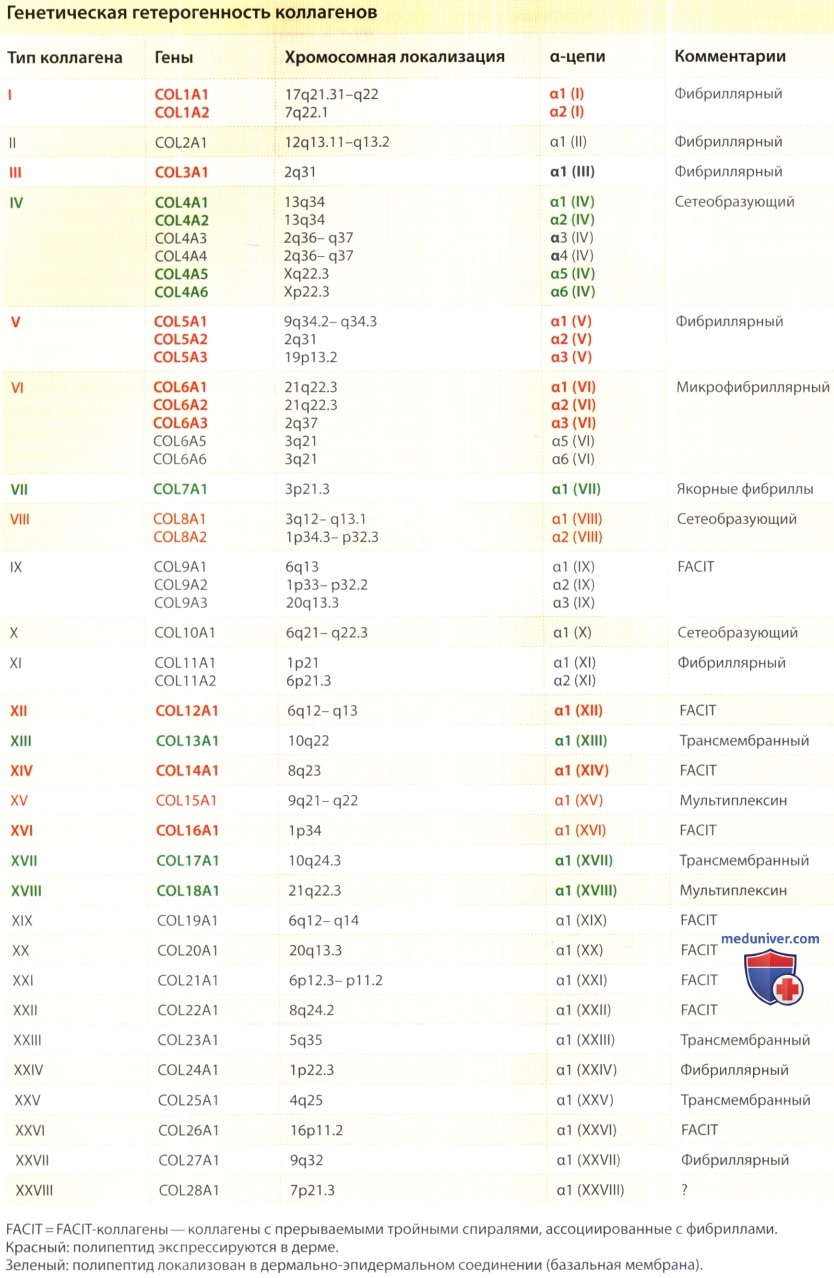
б) Генетическая гетерогенность коллагенов. Коллагены составляют семейство близкородственных, но генетически различных белков. В геноме человека насчитывается 42 разных гена, кодирующих a-цепи с различными аминокислотными последовательностями. Эти a-цепи соответствуют как минимум 28 различным типам коллагена, которые обозначаются римскими цифрами от I до XXVIII. Они подразделяются на несколько подсемейств, главным образом, в зависимости от длины и количества коллагеновых и неколлагеновых доменов. Кроме хорошо известных коллагенов, короткие трехспиральные коллагеновые сегменты присутствуют в других белках, включая ацетилхолинэстеразу, компонент С1q системы комплемента, сурфактантные белки легких, скавенджер-рецепторы макрофагов, эмилины (гликопротеины микрофибрилл эластина, регулирующие интерфейс между сердцевиной эластина и микрофибриллами) и эктодисплазин А, продукт гена, мутировавшего в случае Х-сцепленной ангидротической эктодермальной дисплазии.
Однако эти белки не включены в семейство коллагенов, поскольку их коллагеновые домены не являются доминирующей частью молекулы, и белки не функционируют в первую очередь как структурные компоненты внеклеточного матрикса соединительной ткани.
Коллагены с характерными генетическими характеристиками подразделяются не несколько классов, главным образом в зависимости от длины и количества трехспиральных коллагеновых сегментов и неколлагеновых доменов, присутствующих в молекуле, а также на основании архитектоники их сборки в тканях. Классификация и обзор основных типов коллагена, участвующих в физиологических и патологических процессах в коже, изложены в следующих параграфах. Некоторые типы коллагена подробно не обсуждаются, поскольку не присутствуют в коже в значительных количествах или не влияют на физиологические свойства дермы, или же из-за отсутствия соответствующей информации.
Первый класс включает коллагены, образующие фибриллы, а именно типы I, II, III, V, XI, XXIV и XXVII. Кроме коллагенов II, XXIV и XXVII, которые в коже не обнаружены, все остальные образующие фибриллы коллагены экспрессированы в дерме. Коллагены этого типа состоят из одного коллагенового домена длиной 300 нм с очень короткими, не имеющими трехспиральной конфигурации удлинениями и собираются в сравнительно крупные фибриллы.
Коллаген типа I, самая распространенная и наиболее подробно описанная форма коллагена, находится преимущественно в костях и сухожилиях и составляет примерно 80% общего коллагена дермы взрослого человека. Она образована двумя идентичными a-цепями, обозначенными α1 (I), и третьей цепью, названной α2 (I), которая четко отличается по составу аминокислот. Таким образом, состав цепей коллагена типа I обозначается как [α1 (I)]2α2(I).
Коллаген типа III составляет примерно 10% общего коллагена в дерме взрослого человека. Коллаген типа III состоит из трех идентичных α-цепей, al (III), которые отличаются от цепей коллагена типа I сравнительно высоким содержанием гидроксипролина и глицина, также наличием цистеинового остатка. Коллагены типов I и III образуют сравнительно широкие внеклеточные волокна, которые отвечают, главным образом, за силу растяжения дермы человека. Мутации в генах коллагена типов I и II могут привести к аномалиям в соединительной ткани кожи и суставов, а также в других тканях, что наблюдается при различных формах синдрома Элерса-Данлоса и хрупкости костей при несовершенном остеогенезе.
Коллаген типа V образует подсемейство сходных и взаимосвязанных коллагенов, образованных путем различной сборки трех разных типов а-це-пей: α1 (V), α2 (V) и α3 (V). В коже преобладает форма [α1 (V)]2α2 (V), которая составляет менее 5% общего коллагена дермы. В дерме коллаген типа V связан с основными коллагеновыми волокнами, состоящими из коллагенов типа I и III, при этом считается, что коллаген типа V регулирует диаметр волокон в ходе фибриллогенеза. Важность коллагена типа V была показана при обнаружении мутаций в генах коллагена типа V у пациентов с классическими аутосомно-доминантными формами (типы I и II) синдрома Элерса-Данлоса. Интересно отметить, что клинически схожий классический тип синдрома Элерса-Данлоса может вызываться отсутствием экспрессии тенасцина-Х, что приводит к аутосомно-рецессивной форме заболевания.
Тенасцин-Х ассоциируется с фибриллогенезом коллагенов и его отсутствием может объясняться наличие дефектных коллагеновых волокон, похожих на волокна, обнаруживаемые у пациентов с мутациями в генах коллагена типа V.
Еще один класс включает сетеобразующие коллагены типов IV, VIII и X, которые, однако, имеют очень разную структуру. Коллаген типа IV является типичным компонентом базальных мембран, где он образует скорее решетку, а не волокна, характерные для дермальных коллагенов. Имеется шесть различных α(IV)-цепей, от α1 (IV) до α6 (IV), которые участвуют в сборке гетеротримеров. В коже человека цепи α1 (IV) — α4 (IV) присутствуют в базальной мембране у дермо-эпидермального соединения, при этом преобладает гетеротример [α1 (IV)],α2 (IV). Цепи коллагена типа IV содержат несовершенные триплеты Gly-X-Y, и это свойство придает гибкость тройному спиральному домену этой молекулы.
Неколлагеновый глобулярный домен в амино-терминальном участке молекулы способствует образованию димера, а короткий сегмент в карбоксильном терминальном участке молекулы обеспечивает сборку тетрамера, и все это вместе приводит к сборке сети коллагена IV, характерно напоминающей проволочную сетку «изгороди для цыплят». Хотя кожные заболевания в связи с генетическими мутациями в коллагене IV типа не описаны, мутации в гене COL4A1 идентифицированы в семье с аутосомно-доминантной порэнцефалией и младенческим гемипарезом, а мутации в гене COL4A5 приводят к синдрому Олпорта, сцепленной с Х-хромосомой болезни почек. Кроме того, аутоантитела, распознающие α3 (IV)-цепь коллагена лежат в основе синдрома Гудпасчера, а аутоантитела, нацеленные на цепь коллагена α5 (IV), ассоциируются с новым аутоиммунным заболеванием, для которого характерны образование субэпидермальных пузырей и почечная недостаточность.
Следующие два коллагена, коллаген типа VI и коллаген типа VII, являются уникальными, каждый из них имеет характерную молекулярную структуру и тип супрамолекулярной сборки. Коллаген типа VI образует в дерме особые микрофибриллы, а коллаген типа VII формирует якорные фибриллы в дермо-эпидермальном соединении. Образующий микрофибриллы коллаген типа VI представлен в сравнительном изобилии в различных тканях, в том числе в коже. У человека были идентифицированы пять характерных a-цепей: α1 (VI), α2 (VI), α3 (VI), α5 (VI) и α6 (VI) 11 (табл. 63-2). Цепи α1(VI), α2 (VI) и α3 (VI) собраны в тройной спиральный домен длиной примерно 100 нм, с глобулярными доменами на обоих концах. При супрамоле -кулярной сборке происходит образование антипараллельных димеров, а затем тетрамеров, которые, в свою очередь, организуются в ряды, что приводит к образованию сравнительно тонких микрофибрилл независимо от широких коллагеновых волокон.
Микрофибриллы коллагена типа VI могут выполнять якорную функцию, стабилизируя сборку широких коллагеновых волокон, а также базальные мембраны. Исследования показали, что мутации в каждом из трех генов коллагена VI могут приводить к различным формам врожденной мышечной дистрофии с многочисленными суставными контрактурами, слабостью дистальных суставов и характерным поражением кожи.
Коллаген типа VII является основным, если не единственным, компонентом якорных фибрилл дермо-эпидермальной зоны базальной мембраны. Первоначально он обозначался как длинноцепочечный коллаген, поскольку имеет необычно длинный трехспиральный участок протяженностью примерно 450 нм. Этот коллаген имеет только один тип a-цепей, α1 (VII), а к его трехспиральному коллагеновому домену примыкает крупный неспиральный (неколлагеновый) домен (NC-1) у аминовой терминальной группы и более короткий неспиральный домен у карбоксильной группы (NC-2).
Молекулы коллагена типа VII простираются от нижней части плотной пластинки (lamina densa) к сосочковому слою дермы, при этом они образуют антипараллельные димеры, сцепленные своими карбоксильными концами. Крупные амино-терминальные неколлагеновые домены коллагена типа VII взаимодействуют с коллагенами типа IV и компонентами ламинина-332 дермо-эпидермальной базальной мембраны; предполагается, что большинство якорных фибрилл образуют U-образные петли, которые улавливают широкие дермальные коллагеновые волокна, состоящие из коллагенов типа I и III. Таким образом, изменения в экспрессии, структуре или молекулярных взаимодействиях коллагена типа VII с другими компонентами базальной мембраны могут привести к хрупкости кожи. Примером такой ситуации является дистрофический буллезный эпидермолиз (ДБЭ) — группа механобуллезных заболеваний, для которых характерно образование пузырей на коже в результате незначительных травм. Характерные мутации в гене коллагена VII (COL17A1) обнаружены у 500 семей с различными формами ДБЭ, и ни у одной из этих семей на данный момент не выявлены мутации в других генах, кроме кодирующих α1 (VII)-пoлипeптид коллагена типа VII. Кроме того, коллаген типа VII служит аутоантигеном при приобретенной форме буллезного эпидермолиза — аутоиммунного заболевания с наличием циркулирующих антител к антигену коллагена типа VII.
Еще одна группа ассоциированных с фибриллами коллагенов с перерывами в тройных спиралях, обозначаемая аббревиатурой FACIT (от англоязычного наименования fibril-Associated Collagens with Interrupted Triple helices) включает коллагены типов IX, XII, XIV, XVI, XIX, XX, XXI, XXII и XXVI. Для некоторых из этих коллагенов была установлена связь с коллагеновыми волокнами и предложена концепция их роли в качестве важных молекулярных мостиков для организации и стабильности внеклеточных матриксов. Эти типы коллагенов образуют гомотримеры со сравнительно коротким тройным спиральным доменом и 2-4 неколлагеновыми доменами. В коже коллагены типов XII и XIV ассоциируются с крупными коллагеновыми фибриллами дермы.
Коллагены типа XV и XVIII являются коллагенами базальной мембраны. Их называют мультиплексинами, поскольку в их коллагеновой последовательности содержатся многочисленные неколлагеновые домены. Интерес к этим коллагенам вызван тем фактом, что высвобождаемые в ходе протеолиза фрагменты наделены функциями, отличными от функций исходных интактных молекул.
Коллагены типов XIII, XVII, XXIII и XXV являются трансмембранными белками. Виды их супрамолекулярной сборки остаются неизвестными, и их присутствие в коже, за исключением коллагена типов XIII и XVII, не установлено.
Коллаген типа XVII особенно важен для физиологии и патологии кожи. Он представляет собой трансмембранный белок, закрепленный в мембране базальных кератиноцитов посредством внутриклеточного домена и крупного внеклеточного домена, или эктодомена, который является компонентом базальной мембраны у дермо-эпидермального соединения. Методом иммуноэлектронной микроскопии локализация коллагена типа XVII была определена в полудесмосомах базальных кератиноцитов и тонких якорных филаментах, идущих от полудесмосом через светлую пластинку в направлении плотной пластинки базальной мембраны. Эктодомен коллагена типа XVII состоит из 15 коллагеновых доменов с характерными повторяющимися последовательностями Gly-X-Y, которые образуют тройную спираль. Эти коллагеновые домены разделены неколлагеновыми сегментами различных размеров, следовательно, коллаген типа XVII является белком, для которого характерно чередование коллагеновых и неколлагеновых сегментов.
Эктодомен совместно локализуется и взаимодействует с ламинином-332, также являющимся компонентом якорных филаментов. Коллаген типа XVII был вначале идентифицирован как антиген буллезного пемфигоида с молекулярном весом 180 кДА (BPAG2), который распознавался циркулирующими аутоантителами в сыворотке пациентов с буллезным пемфигоидом или герпесом беременных. Важность коллагена типа XVII подтверждается также тем, что мутации в соответствующем гене (COL17A1) лежат в основе нелетального варианта пограничного буллезного эпидермолиза — генерализованного атрофического доброкачественного буллезного эпидермолиза. У таких пациентов отмечается длительное, в течение жизни, образование пузырей на коже, атрофическое рубцевание, алопеция и дистрофия ногтей.

в виде периодических полосок с интервалом примерно в 70 нм (х 45000).
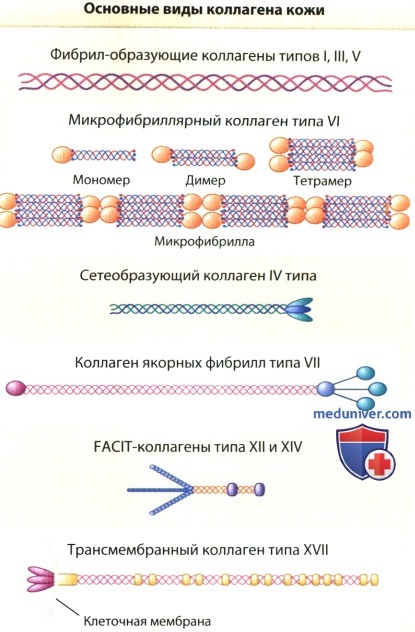
Молекулы коллагена сгруппированы в несколько семейств согласно различным признакам, включая длину и число коллагеновых и неколлагеновых доменов, а также супрамолекулярных модулей.
Коллагены I, III, V типов имеют характерную линейную структуру и образуют основную часть коллагеновых фибрил дермы.
Моллекулы коллагенов VI типа в дерме собраны в соответствии с уникальным микрофибриллярным паттерном из тонких и длинных агрегатов.
Также в экстрацеллюларном матриксе дермы представлены два типа FACIT-коллагенов (ассоциированные с фибриллами коллагены с прерываемыми тройными спиралями),
коллаганы XII и XIV типов, ассоциированные с крупными коллагеновыми фибриллами из коллагенов типа I, III и V.
Коллаген типа IV присутствует во всех базальных мембранах, где из него образуется крупная гексагональная сеть.
Еще два типа коллагена, VII и XVII типы, являются специфическими для дермально-эпидермального соединения,
где коллаген VII типа входит в состав якорных фибрилл, тогда как эктодомен трансмебранного коллагена XVII типа входит в состав якорных фибрилл,
фиксирующих базальные кератиноциты эпидермиса к подлежащей базальной мембране.
- Рекомендуем далее ознакомиться со статьей "Этапы синтеза коллагена и сборки коллагеновых волокон"
Оглавление темы "Внеклеточный матрикс (ВКМ) дермы.":
